Патфиз ч.1. Патфиз ч. Гл. 1 Введение в предмет Гл. 2 Общая нозология
 Скачать 9.21 Mb. Скачать 9.21 Mb.
|
|
Фагоцитоз осуществляют специальные клетки — фагоциты (преимущественно макрофаги и нейтрофилы). В ходе фагоцитоза образуются большие эндоцитозные пузырьки — фагосомы. Фагосомы сливаются с лизосомами и формируют фаголизосомы. Фагоцитоз индуцируют сигналы, воздействующие на рецепторы в плазмолемме фагоцитов (например, АТ, опсонизирующие фагоцитируемую частицу). 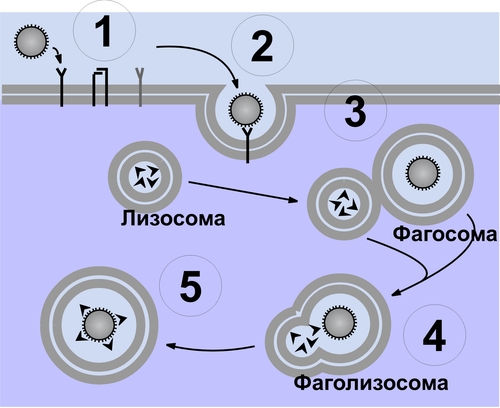 Стадии фагоцитоза: 1 — адгезия частицы (например, бактерии) с помощью Fc-рецептора мембраны фагоцита; 2 — погружение адгезированной частицы в фагоцит и образование фагосомы; 3 — приближение и присоединение к фагосоме лизосом; 4 — слияние мембран фагосомы и лизосом с образованием фаголизосомы; 5 — разрушение поглощённой частицы. [по 4]. ФАГОЦИТЫ Термин «фагоцит» предложил И.И. Мечников. В настоящее время принято различать два основных класса фагоцитирующих клеток: микрофаги и макрофаги. • Микрофаги К микрофагам отнесены полиморфноядерные гранулоциты: нейтрофилы (в наибольшей мере), эозино и базофилы (существенно меньше). Их называют микрофагами, поскольку диаметр гранулоцитов сравнительно мал (6–8 мкм). • Макрофаги Макрофагами (диаметр клеток достигает 20 мкм), или мононуклеарными фагоцитами называют моноциты крови и происходящие из них тканевые макрофаги. Все клетки моноцитарного генеза (например, клетки фон Купффера печени, остеокласты, клетки микроглии, альвеолярные макрофаги, перитонеальные макрофаги и т.д.) рассматривают как систему мононуклеарных фагоцитов (ранее эти фагоцитирующие клетки обозначали термином «ретикуло–эндотелиальная система»). • Астроциты и клетки микроглии мозга также могут быть отнесены к фагоцитам, так как они экспрессируют Аг MHC II и могут фагоцитировать. ОБЪЕКТЫ ФАГОЦИТОЗА Объектами фагоцитоза для микрофагов являются микроорганизмы и инородные неживые частицы, а для макрофагов — повреждённые, погибшие и разрушенные клетки (чужеродные и собственного организма), а также инородные неживые частицы. ТЕРМИНОЛОГИЯ Применительно к процессу фагоцитоза применяют следующие уточняющие определения. • Собственно фагоцитоз: поглощение клеток, их фрагментов и их внутриклеточное переваривание. • Незавершённый фагоцитоз (см. ниже) • Иммунный (специфический) фагоцитоз и опсонизация (см. далее). • Неспецифический фагоцитоз характерен, например, для альвеолярных макрофагов, захватывающих пылевые частицы различной природы, сажу и т.п. • Ультрафагоцитоз: захватывание фагоцитом мелких корпускулярных частиц (пыли, попадающей с воздухом в лёгкие или инородных частиц в тканях). СТАДИИ ФАГОЦИТОЗА В процессе фагоцитоза условно выделяют несколько основных стадий: • Сближение фагоцита с объектом фагоцитоза. • Распознавание фагоцитом объекта поглощения и адгезия к нему. • Поглощение объекта фагоцитом с образованием фаголизосомы. • Разрушение объекта фагоцитоза. СБЛИЖЕНИЕ ФАГОЦИТА С ОБЪЕКТОМ ФАГОЦИТОЗА Первая стадия фагоцитоза — сближение фагоцита с объектом фагоцитоза — рассмотрена выше в разделе главы 5 «Направленная миграции лейкоцитов». РАСПОЗНАВАНИЕ ОБЪЕКТА ФАГОЦИТОЗА Этапы распознавания фагоцитом объекта поглощения и «приклеивания» к нему перечислены на рис. 5–22. 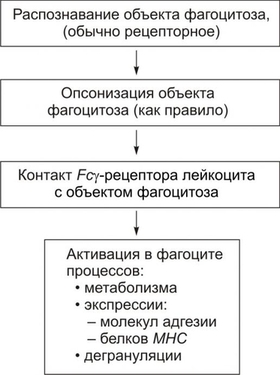 Рис. 5–22. Стадия распознавания и «приклеивания» лейкоцита к объекту фагоцитоза. • Распознавание поверхностных детерминант объекта фагоцитоза Большинство объектов идентифицируется с помощью рецепторов на поверхности лейкоцитов. К таким объектам относятся микроорганизмы, грибы, паразиты, собственные повреждённые или опухолевые, или вируссодержащие клетки, а также фрагменты клеток. • Опсонизация Опсонизация (иммунный фагоцитоз) — связывание АТ с клеточной стенкой микроорганизма с последующим эффективным поглощением образовавшегося комплекса фагоцитом при взаимодействии Fcфрагмента АТ с соответствующим Fcрецептором (FcR) на мембране фагоцита. Наиболее активные опсонины: Fcфрагмент IgG, IgM, факторы комплемента C3bi, лектины. IgG. Бактерия, покрытая молекулами IgG, эффективно фагоцитируется макрофагом или нейтрофилом. Fabфрагменты IgG связываются с антигенными детерминантами на поверхности бактерии, после чего те же молекулы IgG своими Fcфрагментами взаимодействуют с рецепторами Fcфрагментов, расположенными в плазматической мембране фагоцита, и активируют фагоцитоз. IgM . Большая молекула IgM легко активирует комплемент и служит опсонином при фагоцитозе. Многие АТ к грамотрицательным бактериям являются IgM. • Адгезия фагоцита к объекту фагоцитоза реализуется с участием рецепторов лейкоцита Fс • При фагоцитозе в зернистых лейкоцитах происходит активация реакций метаболизма («метаболический взрыв»), что обеспечивает ряд важных событий: экспрессию гликопротеинов HLA и молекул адгезии, респираторный взрыв, а также дегрануляцию лейкоцитов. † Метаболический взрыв К наиболее значимым метаболическим изменениям относятся активация реакций пентозофосфатного шунта, усиление гликолиза, потенцирование гликогенолиза, накопление восстановленного НАДФ. † Дегрануляция лейкоцитов Дегрануляция нейтрофилов, эозинофилов и базофилов сопровождается высвобождением в интерстициальную жидкость медиаторов воспаления (например, ИЛ1 и ИЛ6, ФНО, лейкотриенов) и активных форм кислорода, образовавшихся при респираторном взрыве. ПОГЛОЩЕНИЕ ОБЪЕКТА И ОБРАЗОВАНИЕ ФАГОЛИЗОСОМЫ Фагоцитируемый материал погружается в клетку в составе фагосомы — пузырька, образованного плазматической мембраной. К фагосоме приближаются лизосомы и выстраиваются по её периметру. Затем мембраны фагосомы и лизосом сливаются и образуется фаголизосома. В образовании фаголизосомы принимают участие и специфические гранулы нейтрофильного лейкоцита — видоизменённые лизосомы, а для самого процесса слияния необходимы микрофиламенты цитоскелета, Ca2+, протеинкиназа C. Погружение объекта фагоцитоза в лейкоцит сопровождается секрецией медиаторов воспаления и других компонентов специфических гранул лейкоцита. При дегрануляции все эти факторы поступают в воспалительный экссудат, где оказывают бактериолитическое и цитолитическое действие. ВНУТРИКЛЕТОЧНОЕ «ПЕРЕВАРИВАНИЕ» Разрушение объекта фагоцитоза — внутриклеточное «переваривание» — реализуется в результате активации двух сложных механизмов: кислородзависимой (респираторный взрыв) и кислороднезависимой цитотоксичности фагоцитов. • Кислороднезависимые механизмы активируются в результате контакта опсонизированного объекта с мембраной фагоцита. В процессе фагосомо–лизосомального слияния первыми с мембраной фагосомы сливаются гранулы, содержащие лактоферрин и лизоцим, затем к ним присоединяются азурофильные гранулы, содержащие катионные белки (например, САР57, САР37), протеиназы (например, эластаза и коллагеназа), катепсин G, дефензины и др. Эти химические соединения вызывают повреждение клеточной стенки и нарушение некоторых метаболических процессов; в большей степени их активность направлена против грамположительных бактерий. • Кислородзависимая цитотоксичность фагоцитов играет ведущую роль в деструкции объекта фагоцитоза. Цитотоксичность сопряжена со значительным повышением интенсивности метаболизма с участием кислорода. Этот процесс получил название метаболического (дыхательного, респираторного, кислородного) взрыва. При этом потребление кислорода фагоцитом может увеличиться в течение нескольких секунд во много раз. † В результате дыхательного взрыва образуются цитотоксичные метаболиты кислорода (так называемые активные формы кислорода), свободные радикалы и перекисные продукты органических и неорганических соединений. † К этому времени в цитоплазме фагоцита накапливается большое количество восстановленного НАДФ. НАДФ-оксидаза (флавопротеин цитохромредуктаза) плазматической мембраны и цитохром b в присутствии хинонов трансформируют О2 в анион супероксида (О2–), проявляющий выраженное повреждающее действие. † В последующих реакциях O2– может трансформироваться в другие активные формы: синглетный кислород (1O2), гидроксильный радикал (OH–), пероксид водорода (Н2О2). Последний процесс катализирует СОД. † Пероксид водорода (Н2О2) проявляет меньший, чем О2– повреждающий эффект, но в присутствии миелопероксидазы конвертирует ионы Сl– в ионы HClO–, обладающие бактерицидным действием, во многом аналогичным эффекту хлорной извести (NaClO). † Образующиеся активные радикалы обусловливают повреждение и деструкцию белков и липидов мембран, нуклеиновых кислот и других химических соединений объекта фагоцитоза. При этом сам фагоцит защищён от действия указанных выше агентов, поскольку в его цитоплазме имеются комплексы защитных неферментных факторов (глутатион, витамины E и C) и ферментов (СОД, устраняющая супероксидный анион, глутатионпероксидаза и каталаза, инактивирующие Н2О2). Повреждённый кислородзависимыми и независимыми механизмами объект фагоцитоза подвергается деструкции с участием лизосомальных ферментов. Образовавшиеся продукты какое-то время хранятся в остаточных тельцах и могут утилизироваться клеткой или выводиться из неё путём экзоцитоза. НЕЗАВЕРШЁННЫЙ ФАГОЦИТОЗ Поглощённые фагоцитами бактерии обычно погибают и разрушаются, но некоторые микроорганизмы, снабжённые капсулами или плотными гидрофобными клеточными стенками, захваченные фагоцитом, могут быть устойчивы к действию лизосомальных ферментов или способны блокировать слияние фагосом и лизосом. В силу этого обстоятельства они на длительное время остаются в фагоцитах в жизнеспособном состоянии. Такая разновидность фагоцитоза получила название незавершённого. Существует множество причин незавершённого фагоцитоза, основные из них перечислены на рис. 5–23. 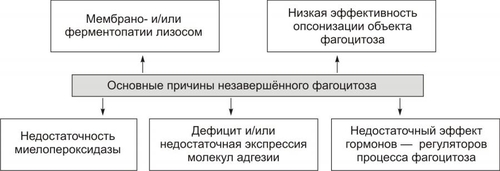 Рис. 5–23. Основные причины незавершённого фагоцитоза. Многие факультативные и облигатные внутриклеточные паразиты не только сохраняют жизнеспособность внутри клеток, но и способны размножаться. Персистирование патогенов опосредуют три основных механизма. • Блокада фагосомо–лизосомального слияния. Этот феномен обнаружен у вирусов (например, у вируса гриппа), бактерий (например, у микобактерий) и простейших (например, у токсоплазм). • Резистентность к лизосомальным ферментам (например, гонококки и стафилококки). • Способность патогенных микроорганизмов быстро покидать фагосомы после поглощения и длительно пребывать в цитоплазме (например, риккетсии). ФАГОЦИТОЗ И ИММУННЫЕ РЕАКЦИИ Фагоцитоз сопряжен с процессом передачи информации об Аг лимфоцитам. Это происходит тогда, когда объектом фагоцитоза являлся носитель чужеродной антигенной информации (клетки, микроорганизмы, опухолевые и вируссодержащие клетки, белковые неклеточные структуры и др.). В этом случае Аг после его модификации в фагоците (процессинг) экспрессируется на поверхности клетки. Такой Аг значительно более иммуногенен, чем интактный Аг. Фагоцитирующие клетки, осуществляющие процессинг, называют антигенпредставляющие клетки. При этом фагоцит представляет (презентирует) клеткам иммунной системы двоякую информацию: о чужеродном Аг и о собственных Аг, кодируемых генами HLA и необходимых для сравнения их с чужими Аг. Фагоциты также продуцируют и выделяют в межклеточную жидкость ряд БАВ, регулирующих развитие либо иммунитета, либо аллергии, либо состояния толерантности. Таким образом, воспаление непосредственно связано с формированием иммунитета или иммунопатологических реакций в организме. ПРОЛИФЕРАЦИЯ Пролиферация — компонент воспалительного процесса и завершающая его стадия — характеризуется увеличением числа стромальных и, как правило, паренхиматозных клеток, а также образованием межклеточного вещества в очаге воспаления, Эти процессы направлены на регенерацию альтерированных и/или замещение разрушенных тканевых элементов. Существенное значение на этой стадии воспаления имеют различные БАВ, в особенности стимулирующие пролиферацию клеток (митогены). Пролиферативные процессы при остром воспалении начинаются вскоре после воздействия флогогенного фактора на ткань и более выражены по периферии зоны воспаления. Одним из условий оптимального течения пролифрации является затухание процессов альтерации и экссудации. Формы и степень пролиферации органоспецифических клеток различны и определяются характером клеточных популяций (см. статью «Популяция клеток» в приложении «Справочник терминов» на компакт-диске). • У части органов и тканей (например, печени, кожи, ЖКТ, дыхательных путей) клетки обладают высокой пролиферативной способностью, достаточной для ликвидации дефекта структур в очаге воспаления. • У других органов и тканей эта способность весьма ограничена (например, у тканей сухожилий, хрящей, связок, почек и др.). • У ряда органов и тканей паренхиматозные клетки практически не обладают пролиферативной активностью (например, миоциты сердечной мышц, нейроны). В связи с этим при завершении воспалительного процесса в тканях миокарда и нервной системы на месте очага воспаления пролиферируют клетки стромы, в основном фибробласты, которые образуют и неклеточные структуры. В результате этого формируется соединительнотканный рубец. Вместе с тем известно, что паренхиматозные клетки указанных тканей обладают высокой способностью к гипертрофии и гиперплазии субклеточных структур. Активация пролиферативных процессов коррелирует с образованием БАВ и других факторов, обладающих антивоспалительным эффектом (своеобразных противовоспалительных медиаторов). К числу наиболее действенных среди них относятся: • ингибиторы гидролаз, в частности протеаз (например, антитрипсин), • антиоксиданты (например, церулоплазмин, гаптоглобин, пероксидазы, СОД); • полиамины (например, путресцин, спермин, кадаверин); • глюкокортикоиды; • гепарин (подавляющий адгезию и агрегацию лейкоцитов, активность кининов, биогенных аминов, факторов комплемента). Замещение погибших и повреждённых при воспалении тканевых элементов отмечается после деструкции и элиминации их (этот процесс получил название раневого очищения). РЕГУЛЯЦИЯ ПРОЦЕССА ПРОЛИФЕРАЦИИ Реакции пролиферации как стромальных, так и паренхиматозных клеток регулируется различными факторами. К числу наиболее значимых среди них относят: • многие медиаторы воспаления (например, лейкотриены, кинины, биогенные амины, стимулирующие деление клеток). • специфические продукты метаболизма лейкоцитов (например, монокины, лимфокины, ИЛ, факторы роста), а также тромбоцитов, способные активировать пролиферацию клеток. • Низкомолекулярные пептиды, высвобождающиеся при деструкции тканей, полиамины (путресцин, спермидин, спермин), а также продукты распада нуклеиновых кислот, активирующие размножение клеток. • гормоны (СТГ, инсулин, T4, кортикоиды, глюкагон), многие из них способные как активировать, так и подавлять пролиферацию в зависимости от их концентрации, активности, синергических и антагонистических взаимодействий; например, глюкокортикоиды в низких дозах тормозят, а минералокортикоиды — активируют реакции регенерации. На процессы пролиферации оказывает влияние и ряд других факторов, например, ферменты (коллагеназа, гиалуронидаза), ионы, нейромедиаторы и другие. ИСХОДЫ При благоприятном течении воспаления в очаге воспаления наблюдается, как правило, полная регенерация ткани — восполнение её погибших и восстановление обратимо повреждённых структурных элементов. При значительном разрушении участка ткани или органа на месте дефекта паренхиматозных клеток образуется вначале грануляционная ткань, а по мере её созревания — рубец, т.е. наблюдается неполная регенерация. ОСТРОЕ И ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ Со времён Галена выделяют острое и хроническое воспаление (рис. 5–24). 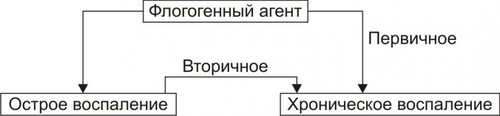 Рис. 5–24. Виды воспаления. ОСТРОЕ ВОСПАЛЕНИЕ Острое воспаление характеризуется: • интенсивным течением и завершением воспаления обычно в течение одной–двух недель (в зависимости от повреждённого органа или ткани, степени и масштаба их альтерации, реактивности организма и др.). • умеренно выраженной альтерацией и деструкцией тканей, экссудативных и пролиферативных изменений в очаге повреждения при нормергическом характере воспаления. При гиперергическом его течении в очаге воспаления доминируют альтерация и разрушение тканей. Данная глава посвящена, в основном, характеристике «классического» — острого течения воспаления. Хроническое воспаление — вариант его неадекватного протекания. ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ Хроническое воспаление может быть первичным и вторичным. • Если воспаление после острого периода приобретает затяжной характер, то оно обозначается как «вторично хроническое». • Если воспаление изначально имеет персистирующее — вялое и длительное — течение, его называют «первично хроническим». Учитывая, что в очаге хронического воспаления находят большое количество мононуклеарных фагоцитов и лимфоцитов, хроническое воспаление (в том числе специфические его формы при ряде инфБ) обозначают как мононуклеарноинфильтративное. ПРОЯВЛЕНИЯ ХРОНИЧЕСКОГО ВОСПАЛЕНИЯ Для хронического воспаления характерен ряд признаков: гранулёмы, капсула, некроз, преобладание моноцитарного и лимфоцитарного инфильтрата. • Формирование гранулем (например, при туберкулёзном, бруцеллёзном или сифилитическом воспалении). • Значительная инфильтрация очага воспаления различными видами лейкоцитов, но преимущественно моноцитами и лимфоцитами. • Образование фиброзной капсулы (например, при наличии в ткани инородного тела или отложении солей кальция). • Частое развитие некроза в центре очага хронического воспаления. Протекает такое воспаление в течение многих лет и даже всей жизни пациента (например, у больных проказой, туберкулёзом, токсоплазмозом, хроническими формами пневмонии, гломерулонефрита, гепатита, ревматоидного артрита и др.). 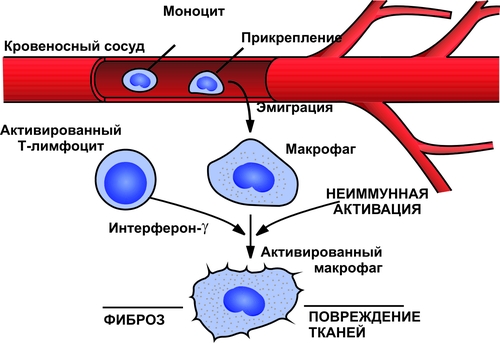 Роль активированных макрофагов в развитии и течении хронического воспаления. Активированные макрофаги синтезируют арахидоновую кислоту, тромбоцитарные факторы роста и другие медиаторы воспаления, потенцирующие вторичную альтерацию. В развитии повреждения тканей принимают участие токсические метаболиты кислорода, протеазы, факторы хемотаксиса нейтрофилов, факторы свёртывания, метаболиты арахидоновой кислоты и оксид азота. Для развития неиммунной активации важны эндотоксины, фибронектин, химические медиаторы воспаления. Развитие фиброза зависит от перестройки коллагенов под влиянием разных факторов роста и цитокинов, а также от факторов ангиогенеза. [по 4]. ПРИЧИНЫ ХРОНИЧЕСКОГО ВОСПАЛЕНИЯ Причины хронического воспаления многообразны (рис. 5–25). 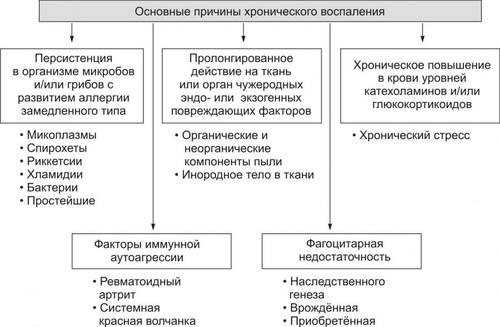 Рис. 5–25. Основные причины хронического воспаления. • Персистирующая инфекция и/или интоксикация (например, хроническая микробная и/или грибковая инфекция нередко сочетается с аллергическими реакциями). • Повторное повреждение ткани или органа (например, лёгких компонентами пыли), сопровождающееся образованием чужеродных Аг и развитием иммунопатологических реакций. • Длительный стресс и другие состояния, сопровождающиеся повышенной концентрацией в крови катехоламинов и глюкокортикоидов. Указанные группы гормонов подавляют процессы пролиферации, созревание и активность фагоцитов, потенцируют их разрушение. • Различные формы фагоцитарной недостаточности. УСЛОВИЯ, СПОСОБСТВУЮЩИЕ ХРОНИЧЕСКОМУ ТЕЧЕНИЮ ВОСПАЛЕНИЯ К условиям, способствующим хроническому, персистирующему течению воспаления, относят: • Значительное накопление в очаге воспаления активированных макрофагов. Это характерно для некоторых видов незавершённого фагоцитоза при поглощении фагоцитами возбудителей токсоплазмоза, проказы, бруцеллёза, туберкулёза или при захвате макрофагами органических и неорганических объектов, которые не подвергаются деструкции и экзоцитозу (частиц пыли, макромолекул декстрана и др.). • Длительная стимуляция макрофагов различными цитокинами, иммунными комплексами, продуктами распада микробов или клеток организма. 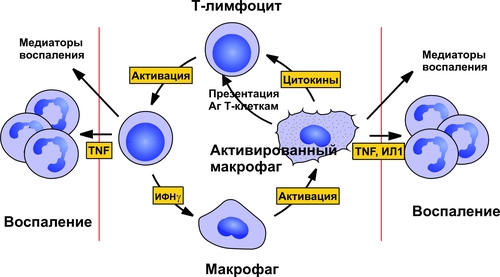 Взаимодействие макрофагов и лимфоцитов при хроническом воспалении. Активированные лимфоциты и макрофаги оказывают влияние друг на друга, а также выделяют медиаторы воспаления, которые повреждают окружающие клетки. TNF — фактор некроза опухоли. [по 4]. • Миграция в очаг воспаления избыточного количества полиморфноядерных лейкоцитов. Они вызывают деструкцию матрикса соединительной ткани, секретируют большое количество БАВ, обусловливающих в свою очередь привлечение в зону повреждения мононуклеарных фагоцитов и их активацию. • Активация ангиогенеза в очаге хронического воспаления. При этом могут образоваться (как при хоминге) венулы с высоким эндотелием. Плазмолемма этих эндотелиальных клеток содержит адрессины, стимулирующие миграцию лимфоцитов и моноцитов в очаг хронического воспаления. • Названные выше и другие факторы приводят к накоплению в очаге воспаления большого числа активированных макрофагов. Эти клетки, в свою очередь, обеспечивают потенцирование процессов развития хронического воспаления. К числу основных среди них относятся: † повреждение ткани продуктами активированных макрофагов: ‡ гидролазами (протеазами, липазами и др.); ‡ избытком метаболитов арахидоновой кислоты (лейкотриенами, Пг, тромбоксаном А2 и др.); ‡ активными формами кислорода; ‡ продуктами липопероксидации. † образование фиброзной ткани, стимулируемое: ‡ тканевыми факторами роста, ‡ факторами ангиогенеза, ‡ стимуляторами фиброгенеза. • Характер течения хронического воспаления определяется: † Местными факторами (клеточным составом, цитокинами, медиаторами воспаления, характером, степенью и масштабом повреждения ткани и др.); † Общими, системными факторами; к ним относят: ‡ Гормоны (адреналин, глюкокортикоиды, СТГ, тиреоидные, пролактин, глюкагон и др.), ‡ Эндорфины и энкефалины. Так, лимфо и моноциты в очаге хронического воспаления вырабатывают пептиды, регулирующие синтез ИЛ1, который определяет уровень продукции кортикотропинрилизингфактора в гипоталамусе. Последний контролирует процессы образования АКТГ и глюкокортикоидов, детерминирующих реакции в очаге хронического воспаления. ПРИЗНАКИ ОСТРОГО ВОСПАЛЕНИЯ Признаки острого воспаления и их основные причины подразделяют на местные и общие (системные). МЕСТНЫЕ ПРИЗНАКИ ОСТРОГО ВОСПАЛЕНИЯ Местные признаки острого воспаления сформулированы ещё в Античности. К ним отнесены rubor, tumor, dolor, calor, functio laesa. Rubor Причины покраснения (лат. rubor): • артериальная гиперемия. • увеличение числа, а также расширение артериол и прекапилляров. • возрастание количества функционирующих капилляров, заполненных артериальной кровью. • «артериализация» венозной крови, обусловленная повышением содержания HbO2 в венозной крови. Tumor Причины припухлости (лат. tumor): • увеличение кровенаполнения ткани в результате развития артериальной и венозной гиперемии; • увеличение лимфообразования (в связи с артериальной гиперемией); • развитие отёка ткани; • пролиферация в очаге воспаления. Dolor Причины боли (лат. dolor): • воздействие на рецепторы медиаторов воспаления (гистамина, серотонина, кининов, некоторых Пг); • высокая концентрация H+, метаболитов (лактата, пирувата и других); • деформация ткани при скоплении в ней воспалительного экссудата. Calor Причины повышения температуры (лат. calor) в зоне воспаления: • развитие артериальной гиперемии, сопровождающейся увеличением притока более тёплой крови; • повышение интенсивности обмена веществ, что сочетается с увеличением высвобождения тепловой энергии; • разобщение процессов окисления и фосфорилирования, обусловленное накоплением в очаге воспаления избытка ВЖК, Ca2+ и других агентов. Functio laesa Причины нарушения функции (лат. functio laesa) органа или ткани: • повреждающее действие флогогенного фактора; • развитие в ответ на это альтеративных процессов, сосудистых реакций и экссудации; нередко расстройство функции ограничивается лишь тем органом или тканью, где развивается воспаление, но может нарушаться и жизнедеятельность организма в целом, особенно если воспалительный процесс затрагивает такие органы как мозг, сердце, печень, железы внутренней секреции, почки. СИСТЕМНЫЕ ИЗМЕНЕНИЯ ПРИ ОСТРОМ ВОСПАЛЕНИИ Системные, общие изменения в организме представлены на рис. 5–26. 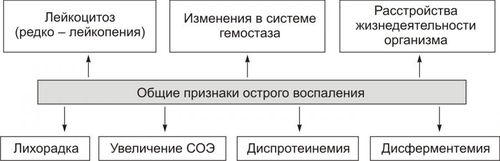 Рис. 5–26. Общие признаки острого воспаления. ЛЕЙКОЦИТОЗ Лейкоцитоз — увеличение количества лейкоцитов в определённом объёме крови и, как правило, в организме в целом. Причины • Действие флогогенного агента, особенно если он относится к микроорганизмам. • Продукты, образующиеся и высвобождающиеся при повреждении собственных клеток активируют синтез непосредственных стимуляторов лейкопоэза — лейкопоэтинов и/или блокируют активность ингибиторов пролиферации лейкоцитов. Значение Лейкоцитоз играет защитную роль, поскольку лейкоциты: • участвуют в обнаружении, локализации и уничтожении флогогенного агента, а также собственных погибших и повреждённых клеток; • регулируют развитие воспаления в целом путём синтеза и высвобождения БАВ различных классов. Оценка характера сдвигов количества лейкоцитов в лейкоцитарной формуле должна учитываться при диагностике воспалительных заболеваний, определении прогноза их развития, эффективности лечения. ЛИХОРАДКА Основная причина лихорадки — образование избытка ИЛ1 и ИЛ6, обладающих, помимо прочего, также и пирогенным действием. Значение Развитие лихорадки при воспалении имеет адаптивную направленность. Умеренное повышение температуры тела: • препятствует размножению многих микроорганизмов, • снижает устойчивость их к ЛС, • активирует иммунные реакции, • стимулирует метаболизм, • способствует повышению функции клеток ряда органов и тканей. Чрезмерное повышение температуры тела может нарушать жизнедеятельность организма и снижать его резистентность. ДИСПРОТЕИНЕМИЯ Причины диспротеинемии • Увеличение в крови фракции глобулинов. Это связано с активацией гуморального звена иммунитета. • При воспалении, сочетающемся с интоксикацией или расстройством функций ССС, дыхательной, эндокринной и других систем, может нарушаться синтез альбуминов в печени с развитием дисбаланса альбуминов и глобулинов. УСКОРЕНИЕ СОЭ Причины ускорения СОЭ • Диспротеинемия. • Изменение физикохимических параметров крови (развитие ацидоза, гиперкалиемии, увеличение уровня проагрегантов). • Активация процессов адгезии, агрегации и оседания эритроцитов. ИЗМЕНЕНИЕ ГОРМОНАЛЬНОГО СТАТУСА ОРГАНИЗМА Причины • Активация симпатикоадреналовой системы. • Стимуляция комплекса «гипоталамус–гипофиз–кора надпочечников». • Изменение функции желёз внутренней секреции. ДРУГИЕ ОБЩИЕ ИЗМЕНЕНИЯ В ОРГАНИЗМЕ При развитии воспаления наблюдаются и иные общие изменения в организме: • отклонения содержания в биологических жидкостях активности ферментов; • изменение содержания или активности компонентов свёртывающей, противосвёртывающей и фибринолитической систем; • аллергизация организма. Таким образом, воспаление, являясь местным процессом, отражает общую, системную реакцию организма на действие флогогенного агента и его последствий. ПРИНЦИПЫ ТЕРАПИИ ВОСПАЛЕНИЯ При разработке схемы лечения воспаления базируются на этиотропном, патогенетическом, саногенетическом и симптоматическом принципах. ЭТИОТРОПНАЯ ТЕРАПИЯ Этиотропный принцип лечения подразумевает устранение, прекращение, уменьшение силы и/или длительности действия на ткани и органы флогогенных факторов. ПРИМЕРЫ РЕАЛИЗАЦИИ ЭТИОТРОПНОГО ПРИНЦИПА • Извлечение из тканей травмирующих инородных предметов. • Нейтрализация кислот, щелочей и других химических соединений, повреждающих ткани. • Уничтожение инфекционных агентов, вызывающих воспаление. В последнем случае применяют антимикробные, противопаразитарные и антигрибковые препараты различных групп (ИФН, антибиотики, сульфаниламиды, производные имидазола, триазола, многие другие группы ЛС). ПАТОГЕНЕТИЧЕСКАЯ ТЕРАПИЯ Патогенетический принцип лечения имеет целью блокирование механизма развития воспаления. При этом воздействия направлены на разрыв звеньев патогенеза воспаления, лежащих в основе главным образом процессов альтерации и экссудации. Примеры • Стимуляция развития артериальной гиперемии, процессов резорбции жидкости с помощью физиотерапевтических процедур. • Применение антигистаминных препаратов, иммуностимуляторов и иммуномодуляторов, активаторов эмиграции лейкоцитов, фагоцитоза, пролиферации клеток и другие. САНОГЕНЕТИЧЕСКАЯ ТЕРАПИЯ Саногенетический принцип терапии направлен на активацию общих и местных механизмов компенсации, регенерации, защиты, восстановления и устранения повреждений и изменений в тканях и клетках, вызванных флогогенным агентом, а также — последствий его влияния. Например, стимуляция иммунных и пролиферативных реакций, развитие артериальной гиперемии, фагоцитоза и других. СИМПТОМАТИЧЕСКАЯ ТЕРАПИЯ Воспаление характеризуется более или менее выраженными изменениями в различных тканях, органах и их физиологических системах. Оно, как правило, сопровождается неприятными и тягостными ощущениями, включая болевые, а также — расстройствами жизнедеятельности организма в целом. В связи с этим проводится специальное лечение, направленное на предупреждение или устранение указанных симптомов (с этой целью применяют, например, болеутоляющие, анестезирующие ЛС, транквилизаторы, антистрессорные ЛС; вещества, способствующие нормализации функций органов и физиологических систем).
|
