Патфиз ч.1. Патфиз ч. Гл. 1 Введение в предмет Гл. 2 Общая нозология
 Скачать 9.21 Mb. Скачать 9.21 Mb.
|
|
ГИПЕРОСМИЯ В очаге воспаления в большей или меньшей мере повышается осмотическое давление. Причины • Повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и других). • Усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества. • Поступление осмотически активных соединений из повреждённых и разрушенных клеток. Последствия • Гипергидратация очага воспаления. • Повышение проницаемости сосудистых стенок. • Стимуляция эмиграции лейкоцитов. • Изменение тонуса стенок сосудов и кровообращения в очаге воспаления. • Формирование чувства боли. ГИПЕРОНКИЯ Увеличение онкотического давления в воспалённой ткани — закономерный феномен. Причины • Увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов. • Повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействия с ионами. • Выход белков (в основном — альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов. Последствия Основное: развитие отёка в очаге воспаления. ЗАРЯД И ЭЛЕКТРИЧЕСКИЕ ПОТЕНЦИАЛЫ Альтерация тканей при воспалении ведёт к нарушениям электрофизиологических процессов в клетках: изменению (как правило — снижению) поверхностного их заряда, а также — расстройствам электрогенеза в возбудимых клетках. Причины • Повреждение клеточных мембран. • Нарушение энергообеспечения трансмембранного переноса ионов. • Нарушения ионного баланса во внеклеточной жидкости. Последствия • Изменение порога возбудимости клеток. • Колебание чувствительности клеток к действию БАВ (цитокинов, гормонов, нейромедиаторов и других). • Потенцирование миграции фагоцитов за счёт электрокинеза (см. рис. 5–20). • Стимуляция кооперации клеток в связи со снижением величины отрицательного поверхностного их заряда, нейтрализацией его или даже перезарядкой (у повреждённых и погибших клеток внешняя поверхность цитолеммы заряжена положительно в связи с избытком на ней К+, Н+ и др. катионов). ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ БИОМЕМБРАН Уменьшение поверхностного натяжения клеточных мембран характерно для очага воспаления. Основная причина Значительное увеличение концентрации в очаге воспаления поверхностноактивных веществ (фосфолипидов, ВЖК, K+, Ca2+ и некоторых других). Последствия • Облегчение подвижности клетки, поскольку уменьшение поверхностного натяжения плазмолеммы способствует образованию псевдоподий. • Потенцирование адгезии клеток при фагоцитозе. • Облегчение контакта фагоцитов и лимфоцитов при реализации реакций иммунитета или аллергии. КОЛЛОИДНОЕ СОСТОЯНИЕ ЦИТОЗОЛЯ И МЕЖКЛЕТОЧНОГО ВЕЩЕСТВА Изменения коллоидного состояния цитозоля и межклеточного вещества выявляются уже на начальном этапе воспаления. Причины Избыток Н+, K+, Na+, жирных кислот, пептидов, аминокислот, других метаболитов и БАВ — наряду с изменением степени гидратации цитоплазмы — приводит к облегчению переходов «гель Основные механизмы • Изменение степени полимеризации макромолекул (гликозаминогликанов, белков, протеогликанов и других). • Фазовые переходы микрофиламентов † Переход цитозоля в состояние геля происходит при образовании из нитей F–актина упорядоченной структуры (актиновая решётка). Такая структура формируется при перекрестном соединении нитей актина с участием актинсвязывающих белков и при низкой концентрации Ca2+. † При увеличении в цитозоле содержания Ca2+ процесс формирования актиновой решётки подавляется, цитоплазма приобретает состояние золя. Последствия Потенцирование миграции фагоцитов из сосудов в очаг воспаления и далее — к объекту фагоцитоза. МЕДИАТОРЫ ВОСПАЛЕНИЯ Образование и реализация эффектов БАВ — одно из ключевых звеньев воспаления. БАВ обеспечивают закономерный характер развития воспаления, формирование его общих и местных проявлений, а также исходы воспаления. Именно поэтому БАВ нередко именуют как «пусковые факторы», «организаторы», «внутренний двигатель», «мотор» воспалительной реакции, «медиаторы воспаления».
Все медиаторы воспаления или их неактивные предшественники образуются в различных клетках организма. Тем не менее, их подразделяют на клеточные и плазменные (рис. 5–8).  Рис. 5–8. Виды медиаторов воспаления. Клеточные медиаторы высвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились. Плазменные медиаторы образуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но в не активном состоянии, а в виде предшественников. Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани. Чёткую границу между клеточными и плазменными медиаторами воспаления удаётся провести далеко не всегда. Предложено множество классификаций медиаторов воспаления. Все они содержат в качестве классифицирующих несколько критериев. Поэтому рассматриваемые далее медиаторы воспаления подразделены на группы и подгруппы в соответствии со сложившимся на момент написания учебника представлениями по этому вопросу. Некоторые пояснения приводятся в тексте этого раздела, а также в статьях «Цитокины», «Хемокины», «Факторы», «Интерлейкины», «Интерфероны», «Лейкоциты», «Макрофаги», «Тромбоциты» (см. «Справочник терминов» на компакт-диске). КЛЕТОЧНЫЕ МЕДИАТОРЫ ВОСПАЛЕНИЯ Основные группы клеточных медиаторов воспаления приведены на рис. 5–9. 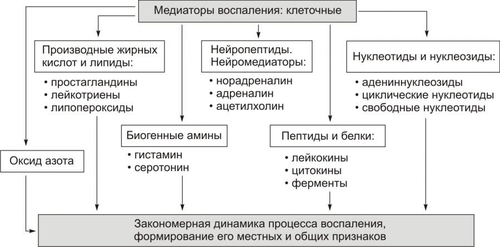 Рис. 5–9. Основные классы клеточных медиаторов воспаления. БИОГЕННЫЕ АМИНЫ Из биогенных аминов к медиаторам воспаления относят гистамин, серотонин, адреналин и норадреналин. Гистамин Основными источниками гистамина являются базофилы и тучные клетки. Действие гистамина опосредуют H1 и H2рецепторы на клеткахмишенях. H1рецепторы активируют малые дозы гистамина. Эффекты их активации: ощущения боли, жжения, зуда, напряжения. Н2рецепторы активируются гистамином в высокой концентрации. Эффекты их возбуждения: изменения синтеза Пг, потенцирование образования циклических нуклеотидов, повышение проницаемости стенок сосудов микроциркуляторного русла (особенно — венул), активация миграции макрофагов, нейтрофилов, эозинофилов в очаг воспаления, сокращение ГМК. Промежуточные дозы гистамина активируют оба вида рецепторов. Это сопровождается значительным расширением артериол и развитием в очаге воспаления артериальной гиперемии, снижением порога возбудимости и повышением чувствительности тканей, в том числе — болевой. Серотонин Источниками серотонина являются тромбоциты, тучные клетки, нейроны, энтероэндокринные клетки. В очаге воспаления серотонин повышает проницаемость стенок микрососудов, активирует сокращение ГМК венул (что способствует развитию венозной гиперемии), приводит к формированию чувства боли, активирует процессы тромбообразования. Адреналин и норадреналин Эффекты норадреналина в очаге воспаления являются в основном результатом его действия на клетки как нейромедиатора симпатической нервной системы (его прямые метаболические эффекты — в отличие от адреналина — сравнительно мало выражены). НЕЙРОМЕДИАТОРЫ Из нейромедиаторов при развитии воспалении важную роль выполняют катехоловые амины и ацетилхолин. Катехоловые амины • Норадреналин и адреналин синтезируются из тирозина в нейронах головного мозга, симпатической нервной системы, а также в хромаффинных клетках параганглиев и мозгового вещества надпочечников. Эффекты адреналина и норадреналина реализуются через • Источники в очаге воспаления † Норадреналин выделяется из окончаний нейронов симпатической нервной системы. † Катехоламины надпочечникового происхождения поступают к тканям (в том числе — в очаге воспаления) с кровью. • Эффекты † Активация гликолиза, липолиза, липопероксидации. † Увеличение транспорта Ca2+ в клетки. † Сокращение ГМК стенок артериол, уменьшение просвета артериол и развитие ишемии. † Регуляция эмиграции лейкоцитов из сосудов в ткань и течения фагоцитарной реакции. Ацетилхолин Ацетилхолин cинтезируется в нейронах из холина и ацетилкоэнзима А при участии холинацетилтрансферазы, выделяется из окончаний нейронов парасимпатической нервной системы и реализует свои эффекты через холинорецепторы. Эффекты † Снижение тонуса ГМК артериол, расширение их просвета и развитие артериальной гиперемии. † Регуляция процессов эмиграции лейкоцитов в очаг воспаления. † Стимуляция фагоцитоза. † Активация пролиферации и дифференцировки клеток. ПЕПТИДЫ И БЕЛКИ Нейропептиды Из нейропептидов при развитии воспалении важную роль выполняет вещество P (см. в «Справочнике терминов» статьи «Вещество» и «Тахикинины» на компакт-диске). Цитокины Цитокины играют важную роль в защитном ответе организма (в том числе иммунном, аллергическом и при воспалении), регулируют дифференцировку, пролиферативную активность и экспрессию фенотипа клетокмишеней. К цитокинам отнесены факторы роста, интерлейкины (ИЛ), факторы некроза опухоли, колониестимулирующие факторы, интерфероны (ИФН), хемокины и некоторые другие. Общий современный термин для всего класса — цитокин, устаревшие наименования подклассов: лимфокины и монокины. Интерлейкины ИЛ — вещества белковой природы, синтезирующиеся множеством клеток (в том числе моноцитами, макрофагами и лимфоцитами). В очаге воспаления ИЛ (в особенности ИЛ 1–4, 6 и 8) регулируют взаимодействие лейкоцитов между собой и с другими клетками. Эффекты интерлейкинов • Хемотаксис лейкоцитов. • Активация захвата и внутриклеточной деструкции объекта фагоцитоза. • Стимуляция синтеза Пг клетками эндотелия. • Активация адгезивной способности эндотелиоцитов. • Стимуляция пролиферации и дифференцировки различных клеток. • Потенцирование микротромбообразования. • Развитие лихорадки. Интерфероны ИФН — гликопротеины, вырабатываемые различными клетками и имеющие антивирусную активность. В очаге воспаления ИФН стимулируют фагоцитоз, активируют цитотоксическую активность лейкоцитов, регулируют иммунные и аллергические процессы. Хемокины Хемокины — низкомолекулярные секреторные пептиды, в первую очередь регулирующие перемещения лейкоцитов. Значение хемокинов для иммуногенеза, иммуномодуляции, воспаления и патогенеза исключительно велико (подробнее см. статью «Хемокины» в «Справочнике терминов»). Лейкокины Лейкокины — общее название для различных БАВ, образуемых лейкоцитами, но не относящихся к иммуноглобулинам (Ig) и цитокинам. С функциональной точки зрения лейкокины — местные медиаторы воспалительной реакции. К группе лейкокинов относятся белки острой фазы, катионные белки, а также фибронектин и некоторые другие выделямые разными лейкоцитами химические вещества, имеющие значение для патогенеза воспаления. Белки острой фазы Белки острой фазы (см. статью «Белки острой фазы» в «Справочнике терминов» на компакт-диске) и компонент комплемента C3 (субстрат в реакции активации комплемента, подробнее см. статью «Комплемент» в «Справочнике терминов» на компакт-диске) — важные факторы патогенеза воспаления. Расщепление C3 его конвертазой сопровождается образованием большой группы белков, обладающих высокой хемотаксической способностью и свойством стимулировать выход гранулоцитов из костного мозга. Катионные белки Катионные белки образуются в гранулоцитах (главным образом — в нейтрофилах) и хранятся в их гранулах. Катионные белки несут на поверхности белковой мицеллы значительный положительный заряд (отсюда их название — катионные белки). Эффекты катионных белков • Высокая неспецифическая бактерицидная активность. Благодаря положительному заряду, катионные белки легко контактируют с отрицательно заряженной внешней мембраной микробов. Это расстраивает трансмембранные процессы, в связи с чем структура оболочки микроорганизмов нарушается, повышается её проницаемость, резистентность микроба резко снижается. При наличии в окружающей среде гидролитических белков, активных форм кислорода, свободных радикалов микробная клетка быстро лизируется. • Повышение проницаемости стенок микрососудов (катионные белки действуют как сигнал для выброса гистамина). • Стимуляция эмиграции лейкоцитов. • Стимуляция контакта нейтрофилов и макрофагов с микробами и другими объектами фагоцитоза. Фибронектины Фибронектины синтезируются многими клетками, в том числе мононуклеарными фагоцитами, фибробластами и тучными клетками. Эффекты • Опсонизация объектов фагоцитоза. • Фиксация объекта фагоцитоза на поверхности фагоцитов. • Продукты гидролиза фибронектинов обладают высокой хемотаксической активностью. Ферменты В очаге воспаления обнаруживаются ферменты всех основных групп (гидролазы, трансферазы, лиазы, синтетазы, оксидоредуктазы и другие). Эти ферменты участвуют в формировании всех компонентов воспаления: альтерации, сосудистых реакций, экссудации, фагоцитоза, пролиферации. Источники ферментов • Эндогенные: высвобождение ферментов из собственных клеток повреждённой ткани и лейкоцитов организма. • Экзогенные: ферменты микроорганизмов, грибов, паразитов, клеток трансплантата, т.е. генетически чужеродные клеточные агенты. Биологическая роль ферментов в очаге воспаления • Регуляторы метаболизма (киназы, дегидрогеназы, АТФазы, ДНКполимеразы и другие). • «Генераторы» медиаторов воспаления (кининогеназы, аминопептидазы, C3конвертаза, гистидиндекарбоксилаза, тирозин гидроксилаза). • Регуляторы проницаемости клеточных мембран (протеазы, липазы, фосфолипазы, лизоцим). • Инициаторы повышения проницаемости стенок сосудов микроциркуляторного русла (гиалуронидаза, эластаза, коллагеназа). • «Санитары», обеспечивающие разрушение собственных (погибших и повреждённых), а также чужеродных клеток (микробов, паразитов, опухолей, трансплантата, вируссодержащих клеток) путём экзо или эндоцитоза (фагоцитоза). • «Строители», участвующие в реакциях синтеза органических соединений, клеточных и неклеточных структур (РНК и ДНКсинтетазы, лигазы, гликогенсинтетазы, полимеразы, синтетазы холестерина и ВЖК, аминоацилсинтетазы и другие). ОКСИД АЗОТА Оксид азота (эндотелием освобождаемый фактор вазодилатации) — важный медиатор воспаления (см. статью «Фактор» в «Справочник терминов» на компакт-диске). ЛИПИДНЫЕ МЕДИАТОРЫ ВОСПАЛЕНИЯ Липидными медиаторами воспаления называют производные арахидоновой кислоты — простагландины, тромбоксаны и лейкотриены, обладающие вазо- и бронхоактивными свойствами. Из мембранных фосфолипидов образуется также фактор активации тромбоцитов (PAF) — наиболее сильный спазмоген. К этой же группе относят продукты перекисного окисления липидов — липопероксиды. Арахидоновая и линоленовая кислоты входят в состав фосфолипидов клеточных мембран, откуда и освобождаются под влиянием фосфолипаз. Дальнейшие превращения этих кислот происходят либо по циклооксигеназному, либо по липооксигеназному пути (рис. 5–10). 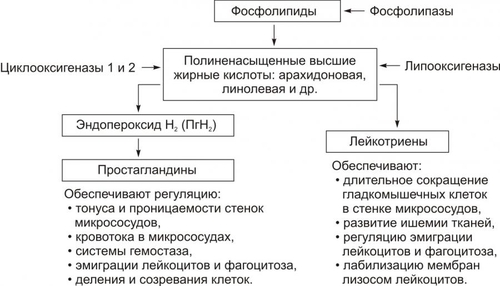 Рис. 5–10. Образование и эффекты простагландинов и лейкотриенов. Лейкотриены образуются по липооксигеназному пути. Эйкозаноиды (например, ПгF2 Циклооксигеназы • На первом этапе из арахидоновой кислоты под влиянием циклооксигеназ формируется эндопероксид H2 (ПгH2), а в результате дальнейших реакций и другие эйкозаноиды. • Циклооксигеназа 1 — фермент конститутивного синтеза, постоянно экспрессируемый в тромбоцитах, эндотелии, желудке, почке и других органах. • Циклооксигеназа 2 — индуцибельный фермент, экспрессию которого в очаге воспаления запускают провоспалительные цитокины (например, ИЛ1 Простагландины |
