Патфиз ч.2. Патфиз ч. Гл. 11 Нарушения водного обмена Гл. 12 Нарушения ионного обмена
 Скачать 7.84 Mb. Скачать 7.84 Mb.
|
|
Условные обозначения: AFP ОПУХОЛЕВАЯ ПРОГРЕССИЯ Изменения в геноме, приводящие к трансформации нормальной клетки в опухолевую — лишь первый этап на пути дальнейшей модификации генома. В генетической программе клетки, ставшей опухолевой, постоянно происходят изменения, в основе которых лежат мутации. • Фенотипически это проявляется изменением биохимических, морфологических, электрофизиологических и функциональных признаков опухоли. • Изменения различных свойств клеток бластомы происходят независимо друг от друга, поскольку мутации каждого отдельного гена автономны. • Сроки изменений свойств разных клеток бластомы сильно варьируют. В связи с этим признаки их появляются и изменяются без какойлибо закономерной хронологии. • При опухолевой прогрессии создаются клоны клеток с самой различной комбинацией признаков (феномен клональной селекции бластомы). В связи с этим разные субклоны клеток одного новообразования могут весьма существенно отличаться друг от друга. • Модификации в геноме опухолевой клетки наследуются, т.е. передаются дочерним клеткам. Указанные выше отклонения генотипа и фенотипа клеток бластомы были описаны американским патологом Л. Фулдсом (1969) и названы феноменом опухолевой прогрессии. Опухолевая прогрессия — генетически закреплённое, наследуемое опухолевой клеткой и необратимое изменение одного или нескольких ее свойств. Высокая и постоянная изменчивость разных свойств опухолей, с одной стороны, делает их гетерогенными, а с другой — способствует их адаптации к меняющимся условиям — недостатку кислорода, субстратов обмена веществ, а в ряде случаев — к ЛС. Последнее называют ускользанием опухоли от лечения. Это требует постоянной коррекции схемы лечения пациентов, а нередко — смены ЛС. В целом процесс опухолевой прогрессии, способствуя высокой приспособляемости новообразований, создаёт условия для нарастания степени их атипизма и, следовательно — их злокачественности (рис. 17–9). 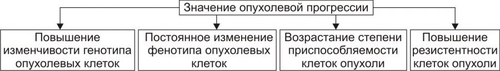 Рис. 17–9. Значение опухолевой прогрессии. ВЗАИМООТНОШЕНИЯ ОПУХОЛИ И ОРГАНИЗМА Возникновение и развитие опухоли в организме не является абсолютно автономным процессом. Сам факт трансформации нормальной клетки в опухолевую и дальнейший её рост — реакция организма на действие различных факторов внешней и внутренней cреды: канцерогенов химической, биологической и физической природы. Взаимодействие опухоли и организма осуществляется при участии всех физиологических систем — нервной, эндокринной, ИБН, кровообращения и других. Воздействие организма на новообразование может осуществляться через изменение кровоснабжения и иннервации новообразования и окружающих его тканей, действия на него БАВ (гормонов, медиаторов, цитокинов и других), факторов системы ИБН (Ig, лимфоцитов, мононуклеарных фагоцитов, гуморальных факторов системы неспецифической защиты организма) и других. Результат взаимодействия опухоли и организма может быть различным. • Гибель бластомных клеток.Это наблюдается наиболее часто. В организме среди большого числа постоянно образующихся различных клеток–мутантов имеются и опухолевые. Однако они, как правило, сразу же обнаруживаются и уничтожаются при участии факторов системы ИБН. • Латентное, «дремлющее» состояние опухолевых клеток.Они делятся, образуя сравнительно небольшой клон бластомных клеток, не имеющих стромы. Трофика их обеспечивается за счёт диффузии веществ, содержащихся в межклеточной жидкости. Как правило, при этом не наблюдается признаков инвазии клеток бластомы в окружающую нормальную ткань. Такую форму опухолевого роста обозначают как неинвазивную, или «рак на месте» — cancer in situ. Подобное состояние может наблюдаться в течение ряда лет. Оно может завершиться либо гибелью клеток бластомы (при активации факторов системы ИБН), либо интенсификацией её роста — приобретением способности к инвазии в окружающие ткани, метастазированию и другим (при снижении эффективности факторов системы ИБН). • Прогрессирующее формирование новообразованияс нарастанием степени его атипизма. При этом условно можно выделить две разновидности воздействия опухоли на организм: местное и общее. † Местные эффекты новообразования характеризуется следующими феноменами: ‡ инвазивным ростом, сочетающимся со сдавлением и деструкцией окружающей нормальной ткани, нарушением микрогемо и лимфоциркуляции, развитием недостаточности ткани или органа; ‡ образованием и выделением в межклеточную жидкость метаболитов, в том числе обладающих свойствами БАВ (гормонов, факторов роста, ферментов, иммунодепрессантов и др.), способных вызвать дисфункцию органов; ‡ подавлением активности местных факторов системы ИБН — фагоцитирующих клеток, лимфоцитов, лизоцима, ИФН и других, что способствует прогрессии опухолевого роста, а также развитию воспаления. † Системное влияние новообразований проявляется развитием ряда общих неспецифических синдромов. Их называют паранеопластическими. К наиболее клинически значимым паранеопластическим синдромам относятся кахексия и иммунопатологические состояния. КАХЕКСИЯ Кахексия у онкологических больных характеризуется общей слабостью и значительным похуданием. Причины • Поглощение опухолевыми клетками субстратов метаболизма и пластических процессов, что существенно расстраивает обмен веществ в организме в целом. • Интоксикация организма продуктами распада опухоли и окружающих её тканей. • Избыточное образование макрофагами и моноцитами организма фактора некроза опухоли • Снижение аппетита, что связывают с опухолевой интоксикацией организма и психической депрессией пациентов. • Болевой синдром (при распаде опухоли, сдавлении ею окружающих тканей или прорастании в них). • Кровотечение из распадающейся ткани новообразования или аррозированных стенок сосудов при инфильтрации их опухолью. • Нарушения питания, пищеварения и всасывания веществ в желудке и/или кишечнике при развитии в них опухолей или их метастазов. ИММУНОПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ У онкологических больных часто развиваются различные инфекции вследствие наличия у них своеобразного синдрома приобретённого иммунодефицита. Причины • Антигенная перегрузка иммунной системы различными белками, образующимися при распаде опухолей. • Иммуносупрессивное действие избытка глюкокортикоидов, обнаруженного при росте опухолей (что связывают с развитием стрессорного состояния). • Повышение активности Tсупрессоров при росте некоторых опухолей (например, гепатом). • Дефицит субстратов, необходимых для пролиферации и дифференцировки иммуноцитов. Описаны и другие иммунопатологические состояния: аллергические реакции, болезни иммунной аутоагрессии, патологическая толерантность. Другие паранеопластические синдромы • Психоневрологические синдромы (психозы, слабоумие, невропатии, нейротрофические расстройства). • Эндокринопатии. Являютсярезультатом нарушения продукции, инкреции и эффектов гормонов, выделяемых как гормональноактивными опухолями так и непоражёнными бластомой эндокринными железами. •Тромбогеморрагические синдромы. •Анемии. Подробное описание этих и других паранеопластических синдромов приводятся в соответствующих разделах учебника. СТАДИИ РАКА Определение стадии новообразования базируется на оценке его размера, наличии либо отсутствии метастазов в регионарных и/или отдалённых лимфатических узлов, органах и тканях. ЗНАЧЕНИЕ ОПРЕДЕЛЕНИЯ СТАДИИ ОПУХОЛЕВОГО РОСТА • Оценка прогноза. Стадия опухоли играет существенную роль при оценке прогноза. Все используемые в настоящее время классификации опухолей указывают на благоприятный прогноз в 1-й стадии заболевания. В последующих стадиях прогноз прогрессирующе ухудшается. • Выбор оптимального лечения. Распределение всех солидных опухолей по стадиям основано, главным образом, на анатомическом размере новообразования. Определение стадии болезни играет решающую роль в выборе последовательности местного, регионарного и системного подходов к лечению, а также при составлении плана комбинированной терапии. • Классификация. Определение стадии обеспечивает единую систему классификации опухолей, что облегчает анализ данных об опухолевом росте, а также необходимо для выбора адекватного лечения, формулирования прогноза, для представления результатов оценки опухолевого роста в стандартизованной форме. ПРОТИВООПУХОЛЕВАЯ ЗАЩИТА ОРГАНИЗМА Воздействие на организм канцерогенных агентов, активация онкогенов и даже образование опухолевой клетки далеко не всегда приводят к формированию опухоли. Это возможно лишь при наличии важного условия — снижения эффективности механизмов противоопухолевой защиты, обеспечивающих антибластомную резистентность организма. Антибластомная резистентность — свойство организма препятствовать проникновению канцерогенных агентов в клетку, её ядро и/или их действию на геном; обнаруживать и устранять онкогены или подавлять их экспрессию; обнаруживать и разрушать опухолевые клетки, тормозить их рост. Выделяют антиканцерогенные, антимутационные и антицеллюлярные механизмы противоопухолевой защиты (рис. 17–10).  Рис. 17–10. Механизмы противоопухолевой защиты организма. АНТИКАНЦЕРОГЕННЫЕ МЕХАНИЗМЫ Антиканцерогенные механизмы обеспечивают торможение и/или блокаду проникновения канцерогенов в клетку, её ядро, действие их на геном и инактивацию и элиминацию бластомогенных агентов из клетки и организма. • Механизмы, препятствующие действию химических канцерогенных факторов † Физикохимическая фиксация (например, глюкуронизация, сульфатирование) и удаление из организма (с мочой, экскрементами, слюной, жёлчью, потом). † Поглощение канцерогенов в процессе фагоцитоза, сочетающееся с их инактивацией и разрушением. † Инактивация бластомогенных агентов как гаптенов при помощи АТ и T-лимфоцитов с последующей их деструкцией и элиминаций из организма. † Конкурентная блокада неканцерогенными метаболитами клеточных рецепторов, с которыми способны взаимодействовать истинные бластомогенные вещества. † Разрушение и/или инактивация канцерогенов в клетках и биологических жидкостях в процессе их окисления, восстановления, деметилирования, глюкуронизации, сульфатирования. † Ингибирование («гашение») свободных радикалов и гидроперекисей органических и неорганических соединений ферментативными и неферментными факторами антиоксидантной защиты. • Механизмы, препятствующие действию онкогенных вирусов † Инактивация вирусов Ig, образуемыми плазматическими клетками под влиянием антигенных вирусных белков. Ig взаимодействуют с вирусом и препятствуют его контакту с рецепторами мембран клеток. Это предотвращает проникновение нуклеиновой кислоты вируса в ядро клетки (трансфекцию) и её опухолевую трансформацию. † Ингибирование ИФН — белками, тормозящими или блокирующими процесс внутриклеточной репликации вирусов. † Обнаружение и разрушение вируссодержащих клеток организма неспецифическими цитолитическими клетками. Такой способностью обладают естественные киллеры, цитотоксические T-лимфоциты, мононуклеарные фагоциты. • Механизмы, препятствующие действию канцерогенов физической природы † Улавливание и/или инактивация свободных радикалов кислорода, липидов, других органических и неорганических веществ. Такими свойствами обладают: ‡ СОД, катализирующая реакцию взаимодействия радикалов O2 при участии H+ с образованием H2O2. ‡ Неферментные «гасители» радикалов, например токоферолы, соединения глутатиона. † Разрушение перекисей и гидроперекисей различных веществ (кислорода, липидов, белков). К эндогенным антиперекисным агентам относятся каталазы, глутатионпероксидазы, глутатионредуктаза. Если антиканцерогенные механизмы оказались неэффективными, то причинные факторы активируют онкогены. АНТИМУТАЦИОННЫЕ МЕХАНИЗМЫ Антимутационные механизмы обеспечивают обнаружение, устранение или подавление активности онкогенов. Реализуются антимутационные механизмы при участии онкосупрессоров («антионкогенов») и систем репарации ДНК. При недостаточности антимутационных механизмов и активации онкогенов клетка приобретает опухолевый генотип и характерные для него фенотипические признаки. Это служит сигналом для включения антицеллюлярных механизмов противоопухолевой защиты. АНТИЦЕЛЛЮЛЯРНЫЕ МЕХАНИЗМЫ Антицеллюлярные механизмы обеспечивают обнаружение и разрушение генотипически и фенотипически чужеродных для организма опухолевых клеток или торможения их роста. Различают неиммунные (неспецифические) и иммунные (специфические) антицеллюлярные механизмы. • Неиммунные механизмы Эти механизмы осуществляют надзор за сохранением нормального (индивидуального и однородного) клеточного состава организма. Реализуют эти механизмы как клетки, так и гуморальные факторы. † Канцеролитические клетки: фагоциты, естественные киллеры, цитотоксические T–лимфоциты. † ФНО ‡ усилению образования активных форм кислорода макрофагами и нейтрофилами, находящимися в ткани новообразования; ‡ включению программы апоптоза; ‡ активации процесса тромбообразования в микрососудах опухоли, развитию в связи с этим ишемии и некроза ее ткани; ‡ активации секреции лейкоцитами цитокинов с высоким канцеролитическим эффектом (например, ИЛ и ИФН). † Вещества со свойствами аллогенного торможения и деструкции генетически чужеродных клеток. Такими веществами являются специфические для каждого типа клеток метаболиты, а также некоторые цитокины. Воздействие их на единичные опухолевые клетки обусловливают нарушение метаболизма в них, функции и, в конце концов, гибель их. † Факторы контактного торможения, подавляющие перемещение и пролиферацию опухолевых клеток. † Указанные (а также некоторые другие) неспецифические антицеллюлярные механизмы противоопухолевой защиты имеют важное значение. Однако они недостаточно эффективны. Многие опухолевые клетки способны ускользать от их действия. В связи с этим важное значение в системе противоопухолевой защиты принадлежат специфическим факторам. • Иммунные механизмы Эти механизмы реализуются через клеточное и гуморальное реакции иммунитета. † Цитотоксические T-лимфоциты, стимулированные опухолевыми Аг. Они оказывают цитолитический эффект двояко: ‡ при непосредственном контакте с опухолевой клеткой; ‡ опосредованно (дистантно) путём выделения в биологические жидкости организма различных цитотоксических агентов. † Специфические АТ, вырабатываемые плазматическими клетками в связи с появлением в организме опухолевых Аг. Цитотоксический эффект противоопухолевых АТ эффективен в основном в отношение отдельных бластомных клеток (например лейкозных). Это объясняется возможностью контакта антигенных детерминант опухолевой клетки и молекулами АТ. Клетки, находящиеся в составе опухолевого узла, мало доступны для Ig. Вместе с тем антицеллюлярные механизмы противоопухолевой защиты не всегда эффективны. Причины: † Канцерогенные агенты, вызывая опухоли, одновременно существенно подавляют и активность факторов антибластомной защиты. † Новообразование обусловливает развитие патологической толерантности к нему. Это достигается путём: ‡ потенцирования состояния иммунодепрессии † экранирования антигенных детерминант бластомы † блокады рецепторов киллеров свободными (отделившимися от опухолевых клеток) антигенными структурами, а также некоторыми другими путями. † В опухолевых клетках антигенные детерминанты часто мало или недоступны для контакта с Ig и специфическими Tкиллерами. † Аг опухолей могут распознаваться клетками иммунной системы как «свои» и поэтому не подвергаются уничтожению. Примером могут служить обнаруживаемые в некоторых опухолях эмбриональные белки, к которым имеется физиологическая толерантность. † Клетки новообразования способны менять свой антигенный профиль. В основе этого лежит высокая степень опухолевой прогрессии, обусловленная постоянно происходящими мутациями различных генов клеток бластомы. ПРИНЦИПЫ ПРОФИЛАКТИКИ И ТЕРАПИИ ПРОФИЛАКТИКА ОПУХОЛЕЙ Цель профилактики новообразований: • предупредить действие на клеточный геном клеток канцерогенов, • значительно снизить их бластомогенное действие и предотвратить тем самым возникновение опухолевой клетки. Для достижения этой цели проводят различные мероприятия. • Снижение содержания или устранениев окружающей человека среде канцерогенных агентов. Достигается с помощью различных методов, например, совершенствованием технологических промышленных, сельскохозяйственных и бытовых процессов, сопровождающихся образованием канцерогенных агентов или применением веществ, потенциально способных вызвать опухоли. Для этого же предпринимают меры по удалению, изоляции, инактивации и разрушению канцерогенных агентов, способных вызвать новообразования, в воздухе, воде, продуктах питания, косметических средствах. • Индивидуальную защиту организма,особенно на производстве (например, с помощью специальной одежды, респираторов, дистанционных манипуляторов и др). • Повышение общей и противоопухолевой устойчивости организма. В значительной степени это достигается путём реализации здорового образа жизни, подразумевающего отказ от курения и злоупотребления алкоголем, систематизированные занятия физкультурой и спортом, упорядоченное питание. Указанные и многие другие меры способствуют поддержанию высокой активности специфических и неспецифических факторов системы ИБН. • Своевременное (максимально раннее) обнаружение и ликвидацию так называемых предопухолевых состояний. К ним относятся очаги избыточной клеточной пролиферации; гипертрофии и гиперплазии тканей при эндокринопатиях (например, в молочных железах, матке, предстательной железе). Названные и другие изменения могут быть выявлены при систематизированных и тщательно проводимых массовых профилактических осмотрах и исследованиях, особенно у пожилых людей, а также у пациентов, страдающих нарушением функций эндокринных желёз, иммунопатологическими расстройствами, имеющих профессиональные вредности и у других подобных групп населения. ПРИНЦИПЫ ЛЕЧЕНИЯ ОПУХОЛЕЙ ОБЩИЕ ПОДХОДЫ • Дифференцированность. Лечение опухолей может быть радикальным и паллиативным. † Радикальное лечение направлено на ликвидацию опухоли и предполагает возможность полного выздоровления либо длительной ремиссии. † Паллиативное лечение применяют при невозможности проведения радикальной терапии. Лечение приводит к увеличению продолжительности жизни и уменьшению страданий. • Комплексность. Программа лечения включает сочетание хирургического, лучевого лечения, химиотерапию и (в некоторых случаях) использование модификаторов биологического ответа (иммуномодуляторов). Комплексное лечение использует преимущества каждого метода лечения для компенсации недостатков других. • Индивидуальность. Лечение планируют специфики этиологии и патогенеза опухолевого процесса у конкретного пациента. Составление плана терапии и его выполнение облегчает координацию усилий патологоанатома, онколога, лучевого терапевта и других специалистов. Большинство онкологических больных лечат хирургически и с применением лучевой терапии, химиотерапии и иммунотерапии. Выбор метода лечения зависит от характера заболевания, стадии, гистологического типа опухоли, возраста больного, наличия сопутствующих заболеваний и цели лечения (излечение или паллиативное вмешательство). • Хирургическое вмешательство и лучевая терапия воздействует на первичную опухоль и регионарные лимфатические узлы. Ни тот, ни другой метод не влияет на области отдалённого распространения. • Химиотерапия и иммунотерапия — системные методы лечения, способны воздействовать на области отдалённого распространения. • Дополнительное лечение — системная терапия, применяемая после местного лечения (например, резекции) при высоком риске наличия микроскопического очага в лимфатических узлах или отдалённых органах. У значительной части таких больных развивается рецидив, цель дополнительного лечения — уничтожение этих удалённых и микроскопических очагов опухоли. Примеры † Рак молочной железы. Для местного лечения применяют хирургическое вмешательство (мастэктомия, тилэктомия) плюс облучение. Для определения состояния подмышечных лимфатических узлов применяют хирургическое вмешательство, послеоперационная химиотерапия необходима для уменьшения вероятности метастазирования опухоли у больных с поражёнными узлами. † Опухоль лёгких. Предоперационное облучение опухоли в ряде случаев уменьшает размер и делает её операбельной. † Саркома конечности. Для диагностики применяют инцизионную биопсию; для уменьшения размера опухоли — предоперационную лучевую терапию; для первоначального местного лечения — радикальную местную резекцию; для дальнейшего лечения необходимы послеоперационная лучевая терапия и химиотерапия. ХИРУРГИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ Хирургическое лечение основано на удалении опухоли. Для предотвращения диссеминирования опухолевых клеток при хирургическом вмешательстве все иссечения проводят в пределах здоровой ткани. Опухоли должны подвергаться минимальному воздействию с целью предотвращения распространения по сосудистой системе; сосудистую ножку опухоли перевязывают как можно раньше. Для предотвращения распространения по лимфатической системе применяют те же меры; кроме того, область дренирующих опухоль лимфатических узлов удаляют вместе с опухолью. • Лечебная резекция. Существует несколько типов лечебных резекций, различающихся в зависимости от размера опухоли и её природы. • Другие резекции † Удаление рецидива опухоли обычно осуществимо при локализованных низкозлокачественных рецидивах. † Уничтожение метастатических опухолей. † Паллиативное хирургическое вмешательство применяют для облегчения или предотвращения определённого симптома (без цели излечения). Например, удаление обтурирующего или кровоточащего рака толстой кишки у больного с метастазами в печени. † Частичное иссечение — удаление большей части опухоли. Применяют при опухолях, прорастающих жизненно важные структуры. Основание для такого подхода — остающееся меньшее количество опухолевых клеток более чувствительно к химио- или лучевой терапии. ЛУЧЕВАЯ ТЕРАПИЯ Примерно половине всех онкологических больных необходима лучевая терапия на каком-либо этапе заболевания. • Типы лучевой терапии † Радикальная. Лучевая терапия (как самостоятельная, так и в сочетании с химиотерапией и хирургическим вмешательством) может быть радикальной при некоторых формах рака. † Паллиативная. Лучевая терапия может носить паллиативный характер (например, при запущенном раке молочной железы, для купирования болей при метастазах в кости). • Лучевую терапию можно применять самостоятельно или в комбинации с химиотерапией или хирургическим лечением. ХИМИОТЕРАПИЯ Последние 30 лет терапию характеризуются возрастающим использованием цитотоксических фармакологических агентов. Сочетание химиотерапии с хирургической операцией и/или лучевым лечением увеличивает продолжительность жизни и частоту ремиссии при многих злокачественных новообразованиях. • Химиотерапевтические эффекты. Сама по себе химиотерапия не обеспечивает выздоровления в большинстве случаев злокачественных опухолей. Эффект от применения фармакологических препаратов почти всегда неполный, кратковременный, с минимальным увеличением выживаемости (или даже без изменения продолжительности жизни). • Комбинированная химиотерапия использует препараты, очень эффективные по отношению к некоторым типам опухолей. Сочетание химиопрепаратов включает эффекты разнообразных цитотоксических механизмов, что приводит к различным побочным эффектам. Если препараты обладают одними и теми же побочными эффектами, то дозу каждого препарата соответственно уменьшают. По сравнению с монотерапией каким-либо одним препаратом комбинированная химиотерапия повышает лечебный эффект. Одновременно с разрушением раковых клеток с помощью нескольких цитотоксических механизмов комбинированная химиотерапия может предотвращать или замедлить развитие лекарственной устойчивости. • Химиотерапевтические средства † Алкилирующие агенты. Применяют азотистые аналоги иприта (мехлорэтамин [эмбихин], циклофосфамид, ифосфамид, мелфалан, хлорамбуцил [хлорбутин], препараты нитрозомочевины (кармустин, ломустин, стрептозоцин), алкилсульфонаты (бусульфан или миелосан), этиленимины и метилмеламины (ТиоТЭФ [тиофосфамид], гексаметилмеламин), триазены (дакарбазин). † Алкалоиды барвинка розового (Vinca rosea L.) винбластин и винкристин (связываясь с микротрубочками, блокируют метафазу митоза). † Антибиотики (даунорубицин [дауномицин или рубомицин], доксорубицин, пликамицин [митрамицин], блеомицин, митоксантрон, митомицин). Подавляют митотический цикл и протеосинтез в опухолевых клетках. † Антиметаболиты (большинство препаратов действует на S-фазу митоза): метотрексат, 5-фторурацил, флоксуридин, меркаптопурин, цитарабин, тиогуанин, пентостатин. † Соединения платины (взаимодействуют с ДНК, образуя межцепочечные связи): цисплатин, карбоплатин. † Разные препараты ‡ Этопозид (VP-16-213) блокирует митозы в метафазе. ‡ Прокарбазин подавляет синтез ДНК, РНК, белка. МОДИФИКАТОРЫ БИОЛОГИЧЕСКОГО ОТВЕТА Биологическая активность этих веществ связана с их воздействием на иммунные и неиммунные механизмы защиты. • Интерфероны (обладают прямой антивирусной и антипролиферативной активностью). • ИЛ2 (способствует созреванию, пролиферации и функции Т- и В-клеток). • Левамизол, декарис (стимулирует фагоцитоз и хемотаксис фагоцитов). • Моноклональные АТ (их вырабатывают гибридомы, полученные путём слияния иммунных В-лимфоцитов и культуры клеток миеломы). Кратковременный эффект этих АТ наблюдают при лейкозе, меланоме и других злокачественных новообразованиях. • Факторы, влияющие на пролиферацию и дифференцировку клеток: † ИЛ1, ИЛ3, ИЛ6 (повреждают малодифференцированные незрелые клетки, в том числе — опухолевые). † Колониестимулирующий фактор гранулоцитов, колониестимулирующий фактор гранулоцитов и макрофагов, колониестимулирующий фактор макрофагов, а также эритропоэтин (активируют дифференцировку клеток).
|
