Патфиз ч.2. Патфиз ч. Гл. 11 Нарушения водного обмена Гл. 12 Нарушения ионного обмена
 Скачать 7.84 Mb. Скачать 7.84 Mb.
|
|
АТИПИЗМ ОПУХОЛЕВЫХ КЛЕТОК Общая обязательная черта трансформированных клеток — опухолевый атипизм. Он характеризуется качественными и количественными отличиями свойств опухоли от свойств аутологичной, нормальной ткани (из которой произошло новообразование), а также от других патологически измененных тканей (например, гипертрофированной, атрофированной, рубцовой). Опухолевый атипизм проявляется большим числом аномальных признаков, характеризующих рост, метаболизм, структуру и функции клеток новообразования. АТИПИЗМ РОСТА Атипизм клеточного роста характеризуется своеобразием пролиферации опухолевых клеток, расстройствами их дифференцировки, инвазивным ростом, метастазированием и рецидивированием (рис. 17–4). 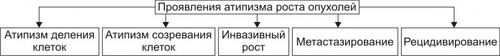 Рис. 17–4. Проявления атипизма роста опухолей. • Атипизм пролиферации В опухоли значительно увеличено количество делящихся клеток. Если в обновляющихся нормальных эпителиях число пролиферирующих клеток не превышает 5%, то в опухолях это значение составляет 40–60%, а в некоторых опухолях — 100%. Увеличение числа делящихся клеток ведёт к быстрому нарастанию массы опухоли или суммарного количества клеток (например, лейкозных) при гемобластозах. • Атипизм дифференцировки Заключается в частичном или полном подавлении процесса созревания (дифференцировки) опухолевых клеток. • Инвазивный рост Характеризуется проникновением клеток опухоли в окружающие нормальные ткани. Это сочетается с их деструкцией. Причины инвазивного роста представлены на рис. 17–5. 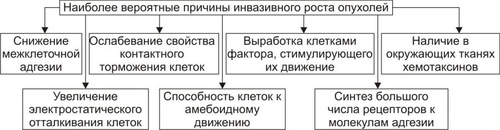 Рис. 17–5. Наиболее вероятные причины инвазивного роста опухолей. • Уменьшение (в 3–6 раз по сравнению с нормальной тканью) сил сцепления(адгезии) между клетками опухоли и отделением в связи с этим клеток от опухолевого узла. Это обусловлено: † Дефицитом в межклеточном пространстве и на поверхности опухолевых клеток молекул адгезии (например, кадгеринов, катенинов, ламинина, фибронектина, витронектина). † Повышенным гидролизом органических молекул межклеточного вещества ферментами, высвобождаемыми опухолевыми и другими клетками. • Увеличение отрицательного зарядавнешней поверхности опухолевых клеток в связи фиксацией на ней отрицательно заряженных радикалов и уменьшением содержания катионов (Ca2+, Na+ и др.). Это способствует электростатическому отталкиванию их друг от друга и отделению от опухолевого узла. • Появление у опухолевых клеток способности к амебоидному движению. Этому способствуют снижение поверхностного натяжения плазмолеммы и облегченный переход цитозоля из состояния геля в золь и наоборот. • Синтез клетками опухоли большого количества рецепторов к лигандам молекул адгезии, в том числе — к межклеточному фибронектину, ламинину базальных мембран и внеклеточного матрикса, коллагену, витронектину. Это способствует прикреплению клеток новообразования к неклеточным структурам и перемещению по их поверхности. Вышеназванные процессы обеспечивают как инвазивный рост опухоли, так и метастазирование ее (см. ниже). МЕТАБОЛИЧЕСКИЙ АТИПИЗМ Атипизм обмена веществ (метаболический, биохимический) заключается в существенном изменении всех видов обмена: нуклеиновых кислот, белков, углеводов, липидов, ионов, жидкости, витаминов. В связи с этим закономерно изменяются и физикохимические параметры опухолевых клеток и новообразования в целом. • Атипизм обмена нуклеиновых кислот В опухоли увеличен синтез ДНК и РНК. Причина Экспрессия онкогенов, а также, повидимому, и некоторых других генов опухолевой клетки. Экспрессии генов в клетках бластомы существенно облегчена благодаря: † уменьшению содержания в них гистонов и других ядерных белков, выполняющих роль супрессоров синтеза ДНК; † увеличению кинетической активности ДНК и РНКполимераз и других ферментов метаболизма нуклеиновых кислот. • Атипизм белкового обмена Проявления † Усиление включения аминокислот в реакции протеосинтеза (феномен «опухоль — ловушка азота»). † Интенсификация синтеза различных классов белков (структурных, ферментов, онкобелков и других) при одновременном уменьшении или прекращении синтеза ряда иных белков (например, гистонов). † Изменение антигенного профиля опухолей. Это обусловлено модификациями макромолекул белка. Нарушения метаболизма белка в новообразованиях, с одной стороны, обеспечивают реализацию большинства других проявлений их атипизма, лежащих в основе прогрессирующего опухолевого роста, а с другой — способствуют активации механизмов антибластомной защиты организма, обусловленной появлением у клеток опухоли Аг, не свойственных нормальным аутологичным клеткам. • Атипизм обмена углеводов Метаболизм углеводов в опухолях характеризуется рядом особенностей: † Активацией реакций транспорта и утилизации клетками бластомы глюкозы (феномен «опухоль — ловушка углеводов»). При этом выявляется три важных закономерности метаболизма глюкозы в опухолевых клетках. ‡ Возрастание в несколько раз включения глюкозы в реакции гликолиза. ‡ Устранение феномена торможения гликолитического окисления глюкозы в аэробных условиях (отрицательный эффект Пастера). Это обусловлено снижением активности цитоплазматической глицерофосфатдегидрогеназы при одновременной существенной активации лактатдегидрогеназы. В связи с этим в опухолевых клетках интенсивно накапливается молочная кислота. ‡ Отсутствие феномена активации потребления глюкозы в процессе тканевого дыхания при оксигенации опухолевых клеток, что свойственно нормальным. † Уменьшением относительной доли тканевого дыхания при ресинтезеАТФ. Если в норме тканевое дыхание обеспечивает этот процесс на 80–85%, то в опухолях — лишь на 10–50%. † Интенсификацией процесса прямого окисления углеводов в пентозофосфатном цикле. Причины † Увеличение содержания и/или активности ферментов гликолиза в цитозоле. † Повышение эффективности механизмов транспорта глюкозы в них. Последствия † Обеспечение энергией значительно интенсифицированных пластических процессов. † Существенное повышение устойчивости клеток новообразования к гипоксии и гипогликемии, а следовательно — увеличение их выживаемости. † Активация реакций пентозофосфатного цикла способствует синтезу пентоз, необходимых для построения нуклеиновых кислот. • Атипизм обмена липидов Он проявляется: † Значительным усилением утилизации ВЖК и холестерина (опухоль как «ловушка липидов»). † Активацией синтеза липидных структур клеток. † Интенсификацией процессов липопероксидации. Причины † Повышение в опухолевых клетках активности и/или содержания ферментов метаболизма липидов. † Подавление и/или истощение содержания в опухолях факторов антиоксидантной защиты. Изменение липидного метаболизма в новообразованиях связано с необходимостью энергетического и пластического обеспечения усиленных анаболических процессов, реакций синтеза структур интенсивно делящихся бластомных клеток. Небезынтересно, что указанные отклонения в опухолях нередко сочетаются с торможением развития атеросклеротических изменений в стенках сосудов у онкологических больных. • Атипизм обмена ионов и воды В новообразованиях наблюдается избыточное (в сравнении с нормальными аутологическими тканями) накопление ряда ионов и воды, а также изменение соотношения отдельных ионов как в цитозоле бластомных клеток, так и межклеточной жидкости. Например, в ткани ряда опухолей увеличивается [K+] и [Cu2+]. Наряду с этим отмечается уменьшение уровня кальция, а в некоторых бластомах — [Na+], магния, цинка и других. Причины † Дефекты структуры клеточных мембран. † Изменение активности и содержания ферментов транспорта ионов (например, снижение активности Na+,K+АТФазы, Ca2+АТФазы и др.). † Повышение осмотического давления в опухолевых клетках. † Разрушение клеток. Отклонения характера обмена ионов и воды в новообразованиях способствует реализации других видов атипизма: роста, функции и структуры. Это, в свою очередь, повышает приспособляемость опухоли. • Атипизм обмена витаминов Особенности обмена витаминов в опухолевой ткани изучены недостаточно. Проявления † Многие витамины интенсивно захватываются клетками бластомы. Полагают, что витамины в опухоли используются в качестве предшественников различных коферментов (как и в нормальных клетках), а также — субстратов обмена веществ и пластических процессов, обеспечивающих интенсивный рост и деление бластомных клеток. † Различные опухоли являются «ловушкой» жирорастворимого витамина E. Он обладает антиоксидантной активностью в связи с его способностью нейтрализовать свободнорадикальные агенты и способствовать стабилизации клеточных мембран. Повидимому, это является одним из механизмов повышения устойчивости опухолевых клеток к цитотоксическим воздействиям свободных радикалов. • Общие признаки обменного атипизма Помимо указанных выше особенностей отдельных направлений метаболизма, для новообразований в целом характерны некоторые общие проявления атипизма обмена веществ (рис. 17–6). К наиболее значимым среди них относят следующие: 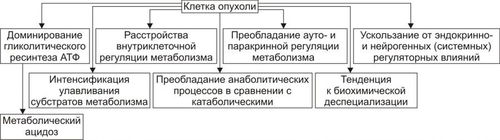 Рис. 17–6. Общие проявления метаболического атипизма в клетках опухоли. † Активное включение в метаболизм опухолей аминокислот, липидов, углеводов, ионов и других веществ (опухоль как «метаболическая ловушка»). Это обеспечивает значительно усиление (в связи с интенсивной пролиферацией бластомных клеток) пластических процессов необходимыми веществами и энергией. † Преобладание в новообразовании анаболических реакций над катаболическими. † Утрата специализации клеток новообразования по сравнению с нормальными — дифференцированными. Это связано с прекращением (или нарушением) синтеза в опухолевых клетках ряда важных для нормального метаболизма ферментов (например, глицерофосфатдегидрогеназы, что ведёт к доминированию гликолитического ресинтеза АТФ). † Снижение эффективности местной регуляции обмена веществ на основе механизма обратной связи. † «Ускользание» метаболизма новообразований от системных — нейрогенных и гормональных — регуляторных влияний. Последнее вызвано, в частности, существенными изменениями рецепторного и пострецепторного аппарата регуляции обмена в клетках бластомы. † Переход опухолевых клеток на более архаичные варианты механизмов регуляции: аутокринный (внутриклеточное управление метаболическими реакциями с помощью веществ, образуемых самой клеткой) и паракринный (управление с помощью веществ — цитокинов, образуемых соседними клетками). В целом указанные и другие проявления атипизма обмена веществ в опухоли создают условия для существенного повышения её «конкурентоспособности» и выживаемости в организме. АТИПИЗМ ФУНКЦИЙ Обычно функции клеток новообразования снижены и/или качественно изменены, реже — повышены. • Гипофункция Как правило, отдельные опухолевые клетки и новообразование в целом характеризуются пониженным функционированием. • Гиперфункция Нередко наблюдаются признаки гиперфункции как отдельных раковых клеток, так и опухоли в целом. Обычно речь идет о неадекватной потребностям организма продукции какихлибо веществ. Так, ряд гормональноактивных новообразований желёз внутренней секреции в избытке синтезируют гормоны. К таким опухолям относятся феохромоцитомы, кортикостеромы и альдостеромы (опухоли коркового вещества надпочечников), инсулома (опухоль из • Дисфункция В некоторых опухолях выявляются признаки, не свойственные для нормальных аутологичных тканей. Так, низкодифференцированные клетки карциномы желудка иногда начинают продуцировать коллаген, рака лёгкого — гормоны аденогипофиза или биогенные амины. Причина: экспрессия в опухолевых клетках генов, программирующих синтез белков, специфичных для клеток других, чем клетки опухоли, типов. Таким образом, атипизм функции опухолей обусловливает нарушение деятельности тканей и органов, которые они поражают, а также — расстройство жизнедеятельности организма–опухоленосителя. С учётом этого в онкологии сложилось представление об опухолевой болезни. МЕТАСТАЗИРОВАНИЕ Метастазирование — одно из фатальных проявлений атипизма опухолевого роста — перенос клеток бластомы на расстояние от основного (материнского) узла и развития опухоли того же гистологического строения в другой ткани или органе. ПУТИ МЕТАСТАЗИРОВАНИЯ • Лимфогенный (с током лимфы по лимфатическим сосудам). Это наиболее частый путь метастазирования опухолей, особенно карцином. Даже при небольшом размере новообразования возможен перенос отдельных его клеток по лимфатическим сосудам и фиксация их в регионарных и отдалённых лимфоузлах. • Гематогенный (с током крови по кровеносным сосудам). Этим путём чаще метастазируют клетки сарком. • Тканевой или имплантационный. Метастазирование таким путём осуществляется при соприкосновении опухолевой клетки с поверхностью нормальной ткани или органа (например, при контакте рака желудка с поверхностью брюшины или рака лёгкого с плеврой); при имплантации бластомных клеток, находящихся в жидкостях организма, например, брюшной, плевральной полости, в ликворе и др., на поверхность органов, соответственно брюшной и грудной полости, спинного и головного мозга. • Нередко опухоли метастазируют по нескольким путям одновременно или последовательно. ЭТАПЫ МЕТАСТАЗИРОВАНИЯ Этапы лимфо и гематогенного метастазирования приведены на рис. 17–7.  Рис. 17–7. Этапы лимфо и гематогенного путей метастазирования опухолей. • Отделениезлокачественной клетки от опухоли и еёинвазия в стенку лимфатического или кровеносного сосуда (интравазация). • Эмболия — циркуляция в лимфатических и кровеносных сосудах опухолевой клетки с последующей её имплантацией на внутренней поверхности эндотелия стенки сосуда. Этот этап метастазирования осуществляется благодаря действию нескольких факторов: † Cнижению эффективности антицеллюлярных механизмов противоопухолевой защиты организма, † Экранированию Аг опухолевых клеток фибриновой плёнкой, образующейся на их поверхности, • Инвазия опухолевых клеток в стенку сосуда и далее — в окружающую ихткань (экстравазация). В последующем клетки пролиферируют и формируют ещё один опухолевый узел — метастаз. Метастазы нередко характеризуются органной избирательностью метастазирования (тропность). Так, клетки рака лёгкого чаще метастазируют в кости, печень, головной мозг; рака желудка — в яичники, ткани дна таза; рака молочной железы — в кости, лёгкие, печень. Подобную тропность метастазирования определяют факторы, перечисленные на рис. 17–8. 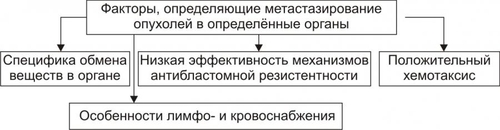 Рис. 17–8. Факторы, определяющие адресное метастазирование опухолей. РЕЦИДИВИРОВАНИЕ Рецидивирование — повторное развитие новообразования того же гистологического строения на прежнем месте после его удаления или деструкции. Причиной рецидивирования являются опухолевые клетки, оставшиеся в ткани при неполном удалении новообразования, либо в связи с предшествующей эксцизии инвазией отдельных клеток бластомы в окружающую нормальную ткань. Допускается также возможность внедрения в геном нормальной клетки в зоне роста новообразования содержащего онкогены участка ДНК из разрушившихся при хирургическом удалении или хемо- и лучевой терапии клеток бластомы. Повторное развитие опухоли нередко характеризуется ускоренным её ростом. Это является результатом, с одной стороны, повреждения местных тканей в ходе хирургического или иного вмешательства, а с другой — снижения эффективности факторов системы ИБН. ОПУХОЛЕВЫЕ МАРКЁРЫ Опухолевые маркёры — преимущественно нормальные дифференцировочные Аг гликопротеиновой или гликолипидной природы. Опухолеспецифических Аг в строгом смысле слова не существует. Однако число дифференцировочных Аг многократно увеличивается при росте опухоли. Поэтому определение их используют как дополнение к гистологической оценке новообразования, для выделения лиц с высоким риском возникновения злокачественных опухолей, контроля эффективности терапии и прогнозирования их рецидивирования. В тест-системах при помощи специфических моноклональных АТ оценивают концентрацию циркулирующих онкомаркёров в биологических жидкостях организма и их тканевую экспрессию in situ. При цитологической диагностике, особенно в случае опухолей из кроветворных клеток, широко используются дифференцировочные Аг (CD-маркёры), число которых превышает сто. Клеточно-специфичные маркёры. Многие опухолевые клетки сохраняют способность к экспрессии веществ, специфичных для их нормальных предшественников. Например, для аденокарциномы предстательной железы характерна высокая активность кислой фосфатазы простатического типа, а также экспрессия простатоспецифичного Аг. Эмбриональные и плодные («фетальные») Аг. Некоторые органные опухоли содержат вещества, в норме синтезирующиеся в онтогенезе. Например, гепатоцеллюлярная карцинома и герминомы секретируют Цитоплазматические промежуточные филаменты. Выявление маркёров цитоскелета, особенно при помощи моноклональных АТ к разным типам промежуточных филаментов — один из наиболее ценных и точных методов диагностики. Например, разные эпителиальные клетки продуцируют различные кератины. Это же свойство часто сохраняют карциномы. Саркомы экспрессируют виментин — маркёр клеток мезенхимного генеза. В карциномах АТ к виментину обнаруживаются только у соединительнотканных клеток и в клетках ткани стенки кровеносных сосудов. Дифференцировочные антигены (см. статью «Маркёры» в приложении «Справочник терминов» на компакт диске). Важное значение для диагностики первичного очага и последующей направленной терапии приобретает типирование (чаще иммунотипирование) клеток метастазов. Некоторые опухолевые иммуномаркёры приведены в табл. 17–1. Табл. 17–1. Некоторые иммуномаркёры опухолей
|
