Физика твердого тела (тексты лекций). Гомельский государственный университет имени Франциска Скорины С. А. Хахомов, А. В. Семченко, Ю. В. Никитюк физика твердого тела
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
Ионные кристаллыВ узлах кристаллической решетки ионных кристаллов находятся положительные катионы и отрицательные анионы. Силы взаимодействия между ними по своей природе являются электростатическими. Для того чтобы система была устойчивой, необходимо чтобы ближайшими соседями ионов одного знака были ионы противоположного знака. При разъединении кристалла на отдельные частицы мы получим систему разноименно заряженных ионов, не взаимодействующих между собой. Типичным представителем ионных кристаллов является NaCl, структура которого представлена на рисунке 4.2. Из рисунка 4.2, где черные кружки обозначают Na+, а белые - Сl-, видно, что центральный ион хлора имеет шесть ближайших соседей - ионов натрия. 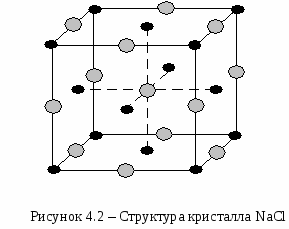 Кристаллическая структура хлористого натрия может быть представлена как совокупность двух кубических гранецентрированных решеток Браве, из ионов натрия и хлора и смещенных друг относительно друга на половину ребра куба. Число ионов противоположного знака, которое составляет ближайшее окружение данного иона в кристалле, называется координационным числом. Значение координационного числа определяется величиной отношения радиусов ионов противоположного знака: Чем ближе это отношение к единице, тем больше координационное число, что подтверждается данными, приведенными в таблице 4.1. Радиус аниона превосходит радиус катиона. Следовательно, кристаллическую решетку условно можно представить себе как систему плотно упакованных анионов, в пустотах между которыми расположены катионы. В зависимости от соотношения ионных радиусов изменяется координационное число, а значит и тип решетки. Таблица 4.1 - Зависимость координационного числа от радиусов ионов противоположного знака
Примеры: 1. 2. В зависимости от внешних условий радиусы катионов и анионов меняются по-разному. Вследствие этого отношение ионных радиусов может меняться в широких пределах, а это приводит к изменению типа решетки. Иллюстрацией определяющего значения соотношения ионных радиусов в «выборе» типа решетки ионного кристалла служит тот факт, что если под влиянием внешних воздействий (температура, давление) это соотношение существенно изменится, то изменится и кристаллическая структура данного ионного соединения. Способность одного и того же вещества кристаллизоваться в различных кристаллических структурах называется полиморфизмом. Явление полиморфизма очень широко распространено. В сравнительно небольшом интервале температур и давлений более половины химических элементов проявляют полиморфизм. Исследования кристаллической структуры элементов при высоких давлениях привели к обнаружению ранее неизвестных полиморфных превращений. Круг полиморфных веществ расширился настолько, что стало возможным высказать предположение, что в природе вообще не существует элементов, сохраняющих одну и ту же структуру в достаточно широком интервале температур и давлений. Несколько примеров полиморфизма ионных кристаллов приведено ниже. С повышением температуры радиус аниона увеличивается быстрее, чем радиус катиона, вследствие чего происходит увеличение разности размеров ионных радиусов. Поэтому некоторые кристаллы (например, хлористый цезий и хлористый рубидий) при повышении температуры изменяют свою кристаллическую структуру: из объемноцентрированной перестраиваются в примитивную кубическую решетку. Обратная перестройка наблюдается при увеличении давления, когда радиус аниона уменьшается быстрее, чем радиус катиона. При этом происходит сближение размеров ионных радиусов, которое может привести к переходу кристалла из примитивной кубической решетки в объемноцентрированную. Такого рода перестройка кристаллической структуры при повышении давления наблюдается у хлористого, бромистого и йодистого калия, бромистого и йодистого рубидия. Из описания ионных кристаллов можно сделать вывод, что внутри них нельзя обнаружить такие группировки частиц, которые соответствовали бы молекулам. Поясним этот вывод следующими рассуждениями. В кристалле поваренной соли каждый ион хлора окружен шестью ионами натрия и наоборот. Все шесть ближайших соседей какого-либо иона, являющихся ионами противоположного знака, одинаково удалены от рассматриваемого иона, поэтому в таком кристалле не представляется возможным выделить какую-либо пару ионов, более тесно связанных друг с другом, чем с другими соседями. Следовательно, в кристалле хлористого натрия не существует изолированной пары ионов, которую можно отождествить с молекулой NaCl. Правильнее считать весь монокристалл ионного соединения одной гигантской молекулой, в которой каждый ион испытывает значительное взаимодействие со стороны всех остальных ионов. При растворении в воде такой кристалл распадается на ионы, а при испарении - на молекулы. Можно сказать, что плавление ионных кристаллов также приводит к образованию ионов, так как расплавы ионных солей обладают хорошей электропроводностью, а это говорит о достаточно высокой степени диссоциации жидкости. Ионные кристаллы обладают малой электропроводностью при низких температурах, хорошей ионной проводимостью при высоких температурах и сильным инфракрасным поглощением. В ионных кристаллах одинаковой структуры силы взаимодействия между положительными и отрицательными ионами тем больше, чем больше их валентность и чем меньше сумма их радиусов. А чем больше сила взаимодействия между ионами, тем выше температура плавления кристалла и тем меньше его растворимость. |
