Физика твердого тела (тексты лекций). Гомельский государственный университет имени Франциска Скорины С. А. Хахомов, А. В. Семченко, Ю. В. Никитюк физика твердого тела
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
Атомные кристаллыВ узлах кристаллической решетки атомных кристаллов распложены нейтральные атомы. Силы взаимодействия между атомами в таких кристаллах называются обменными. Рассмотрим природу этих сил на примере молекулы водорода H2. Система из двух атомов водорода схематически изображена на рисунке 4.3. Протоны на схеме обозначены буквами а и b, a электроны - цифрами 1 и 2. Расстояния между элементами схемы обозначены буквой r. 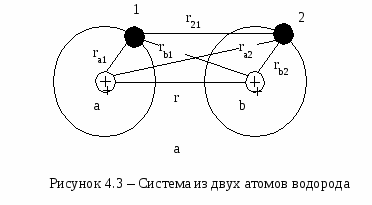 Плотность электронного облака, описывающего состояние электрона в атоме водорода, очень быстро падает с увеличением расстояния, поэтому при больших расстояниях между протонами атомы можно рассматривать как изолированные, а энергию системы, состоящей из двух удаленных атомов, можно считать равной 2Е0, где Е0- энергия изолированного атома в невозбужденном состоянии. По мере уменьшения расстояния rувеличивается степень перекрытия электронных облаков, т. е. увеличивается вероятность перехода электрона к «чужому» протону. Расчет показывает, что при r50 Обобществление электронов приводит к перераспределению электронной плотности в пространстве между ядрами атомов и вне ядер. Плотность электронного облака в пространстве между ядрами становится больше плотности, которая бы получилась при простом сложении отдельных плотностей. При этом в пространстве вне ядер оказывается, что суммарная плотность электронного облака будет меньше той, которая бы получилась при сложении плотностей электронных облаков отдельных атомов. Появление состояния с повышенной плотностью электронного облака в межъядерном пространстве вызывает уменьшение энергии системы и приводит к возникновению сил притяжения между ядрами. В основе возникновения такой связи лежит обменное взаимодействие или обменный эффект, обусловленный обменом атомов электронами и имеющий чисто квантовую природу. Силы такого взаимодействия называются обменными силами, а их энергия - обменной энергией. Обменное взаимодействие возникает и между другими тождественными частицами, например, между протонами или между нейтронами, когда они сближаются до расстояний, обеспечивающих существенное перекрытие волновых функций этих частиц, что имеет место в атомном ядре. Нужно отметить, что в зависимости от ориентации спинов обобществленных электронов обменное взаимодействие может проявляться не только в возникновении сил притяжения, но и в возникновении сил отталкивания между сближающимися атомами. Возникающая в результате обменного взаимодействия ковалентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака коллективизированных электронов. Это означает, что такая связь имеет направленный характер. Вследствие того, что ковалентная связь возникает посредством взаимодействия валентных электронов, кристаллы, в которых атомы связаны такой связью, иногда называют валентными. Представление о перекрывании электронных облаков соседних атомов и обменном направленном взаимодействии двух электронов с антипараллельными спинами составляют основу современной теории строения молекул. Эти представления дали простое объяснение загадочной способности химических сил к насыщению. Действительно, к молекуле водорода не может присоединиться еще один атом водорода, так как спин его электрона будет параллелен спину одного из электронов, входящих в молекулу водорода, и между ними возникнут силы отталкивания, препятствующие присоединению третьего атома. В атомных кристаллах тоже нельзя выделить отдельных группировок частиц, которые можно было бы назвать молекулами. Весь кристалл можно рассматривать как гигантскую молекулу с ковалентной связью. Однако при разрушении ковалентной связи, в отличии от ионной, никогда не возникает ионов. Ковалентная химическая связь очень прочна, поэтому атомные кристаллы отличаются высокой температурой плавления, большой твердостью и малой летучестью. |
