Издательский дом Питер
 Скачать 5.79 Mb. Скачать 5.79 Mb.
|
|
Время кровотечения Тромбоцитарный гемостаз зависит от двух переменных — количества тромбоцитов и их функции. В то время как определение количества тромбоцитов — простая процедура, оценка функции тромбоцитов — довольно сложная задача, к тому же на интерпретацию теста оказывают влияние различные сложные клинические переменные. Несмотря на гетерогенность возможных механизмов и клинических проявлений тромбоцитарной дисфункции, существует единственный широко применяемый клинический тест для определения функции этих клеток, а именно — время кровотечения (ВК). ВК соответствует времени между индуцированием небольшой стандартной поверхностной раны на предплечье и образованием стабильного тромбоцитарного тромба, о чем свидетельствует прекращение кровотечения. В модифицированном тесте используется лезвие (с пружиной), которым наносится на ладонной поверхности предплечья рана длиной 1 см и глубиной 1 мм, в то время как на плече манжеткой нагнетается давление до 40 мм рт. ст. Кровь промокают на краю раны фильтровальной бумагой каждые 30 с так, чтобы не задеть образующуюся в центре тромбоцитарную пробку. Это делают до тех пор, пока не остановится кровотечение. В норме ВК составляет 3-8 мин, при так называемом стандартном ВК — 2-7 мин. Несмотря на примитивность теста и связанный с ним дискомфорт, он является методом выбора в тех случаях, когда предполагают дисфункцию тромбоцитов. Правильно выполняемый ВК-тест покажет отклонение от нормы только в трех случаях: — при тромбоцитопении менее 100 000 клеток/мкл; — при качественной дисфункции тромбоцитов любого типа; — редко при аномалии микрососудов (например, амилоидозе). При нормальной функции тромбоцитов и при их количестве от 10х109/л до 100x109 /л ВК изменяется линейно в зависимости от количества тромбоцитов, согласно эмпирически полученной формуле: Тромбоциты _____________________________201 ВК (мин) = 30,5 — (количество тромбоцитов в мкл) /3850. При тромбоцитопениях, связанных с потреблением тромбоцитов (например, иммунная тромбоцитопения), ВК часто будет короче, чем величина, полученная этим уравнением, что объясняется избыточным содержанием фос-фолипидов в молодых и более крупных тромбоцитах при данном состоянии. И наоборот, в некоторых случаях продуктивной тромбоцитопении, когда нарушается созревание мегакариоцита и тромбоцита (например, миелодиспла-зия), ВК будет превышать расчетную величину. Прием одной таблетки аспирина удлиняет нормальное ВК до 8-10 мин. В то же время аспирин может непропорционально увеличивать ВК у пациентов со слабой качественной дисфункцией тромбоцитов и, таким образом, будет обнаруживать незначительные качественные нарушения. Так называемый тест толерантности к аспирину следует применять с большой осторожностью у пациентов с возможной кровоточивостью, поскольку аспирин усилит ее. Аспирин необратимо аце-тилирует циклооксигеназу тромбоцитов и поэтому влияет на тромбоциты на протяжении срока их жизни, приблизительно 8-10 дней. (Нестероидные противовоспалительные препараты связываются с этим ферментом обратимо и, таким образом, ингибируют функции тромбоцитов только в течение периода циркуляции.) Сложности использования ВК: — исследование представляет собой хирургическую «миниоперацию» и должно быть выполнено хорошо подготовленным сотрудником; — исследование может быть достаточно длительным (до 30 мин), его сложно применять интраоперационно, у детей и т. д.; — исследование сложно применять при затруднении доступа к предплечью (внутривенные инфузии, повязки, раны и др.) Исследование агрегации тромбоцитов Количественное исследование агрегации тромбоцитов позволяет дифференцировать отдельные группы их качественных нарушений. Это теоретически простой лабораторный тест, в котором конгломерация одиночных тромбоцитов в группы или агрегаты большего размера определяется количественно по степени пропускания света через тромбоцитсодержащую плазму. Тромбоци-тарный агрегометр состоит из небольшой прозрачной кюветы, содержащей концентрированные тромбоциты пациента (стандартная концентрация), через которые пропускается свет от калиброванного источника, поступающий в фотоэлемент. Фотоэлектрический элемент связан с регистрирующим устройством, измеряющим пропускание света (или оптическую плотность) с учетом времени. Если тромбоциты представляют собой суспензию одиночных клеток (т. е. до агрегации), то пропускание света минимально. С увеличением агрегации плазма, содержащая тромбоциты, становится все светлее, а пропускание света возрастает. Представить это явление визуально можно, сравнивая различную прозрачность жидких суспензий, содержащих или большое 202 ___________________________Глава 5. Физиология крови количество мелких частиц глины, или ту же массу глины, консолидированную только в несколько кусочков. Агрегация тромбоцитов invitroможет инициироваться путем добавления различных экзогенных веществ в агрегометрическую кювету, чаще всего это АДФ, адреналин, коллаген, тромбин, арахидоновая кислота и ристоцетин. АДФ, адреналин и тромбин обладают уникальной способностью вызывать агрегацию тромбоцитов самостоятельно, без обязательной дегрануляции клеток и экзоцитоза. Поэтому при низких концентрациях эти вещества будут стимулировать только обратимую первичную волну агрегации. При несколько более высоких концентрациях АДФ, адреналина и тромбина тромбоциты полностью активируются, и выделение гранулярного содержимого наряду с синтезом тромбоксана А2 приводит к несколько отсроченной, но усиленной вторичной волне агрегации тромбоцитов. При еще больших концентрациях первичная волна агрегации погружается во вторичную волну и можно видеть только одну полную волну агрегации. Хотя коллаген связывается с гликопротеином 1а тромбоцитарной мембраны, он при этом не вызывает агрегацию тромбоцитов. Однако спустя некоторое время коллаген индуцирует полную агрегацию тромбоцитов в результате их внутренней активации. Способность арахидоновой кислоты стимулировать агрегацию зависит от функционирования фермента циклооксигеназы в ходе синтеза простагландинов. Синтез тромбоксана А2 из арахидоновой кислоты приводит к полной активации тромбоцитов, экзоцитозу и агрегации. Уникальность ристоцетина состоит в том, что агрегация тромбоцитов под его воздействием не требует метаболизма. Фактически вызываемая ристоцетином агрегация может достигаться с помощью тромбоцитов, фиксированных в формалине. Полагают, что ристоцетин обеспечивает агрегацию путем ассоциации с ГП 1(3 тромбоцитарной мембраны, активируя эту молекулу для связывания фактора Виллебранда. Поэтому в присутствии ристоцетина ФВ соединяет тромбоциты в большие агрегаты. Если тромбоциты жизнеспособны, индуцирование ристоцетином также приводит к активации клеток и выделению эндогенных гранул. В отсутствие фактора Виллебранда активации не происходит. 5.5. Свертывание крови 5.5.1. Нормальный гемостаз Гемостатический процесс начинается с травмы или разрыва сосуда, а заканчивается образованием тромбоцито-фибриновой сетки (гемостатическая пробка). Она служит механическим затвором, предотвращающим дальней- Свертывание крови_________________________________203 шую кровопотерю, и плацдармом для восстановления тканей. Функция ге-мостатического механизма включает взаимодействие между стенкой сосуда, тромбоцитами, коагуляционными белками крови и фибринолитической системой. Нарушения гемостаза ведут к серьезным клиническим последствиям. Дисбаланс в одном направлении может привести к чрезмерному кровотечению, дисбаланс в другом направлении — к образованию тромба. Сосудистый эндотелий Структурная и функциональная целостность сосудистой стенки зависят от свойств ее клеточных компонентов и от состава и организации внеклеточного матрикса, который синтезируют клетки. Также трофическое влияние на эндотелий оказывают тромбоциты. Наиболее активную роль в гемостазе среди составляющих компоненты сосудистой стенки играет эндотелий, хотя в реакции на травму участвуют и субэндотелий, средняя, а также наружная оболочки сосуда. Монослой эндотелиальных клеток (ЭК) выстилает соединительнотканную мембрану и составляет первый защитный барьер против различных процессов, включая гемостаз и тромбоз. Продукты эндотелиальной клетки представлены в табл. 26. Продуцируемые ЭК белки имеют большое значение для межклеточного взаимодействия и образования диффузного барьера, который предотвращает попадание крови из внутрисосудистого пространства во внесосудистое. Кроме того, ЭК выполняют разные физиологические функции, включая регулирование реактивности тромбоцитов, контроль за направленной миграцией лейкоцитов, регулирование активности фактора роста, регулирование текучести крови. ЭК также продуцируют вещества, которые секретируются в просвет сосуда и способствуют текучести крови. Прежде всего нормальный эндотелий действует как мощная антикоагу-лянтная поверхность, которая не активирует белки свертывания крови и не привлекает к себе ее клеточные компоненты. Но после стимуляции или травмы эндотелий трансформируется в мощную прокоагулянтную поверхность. Это происходит за счет синтеза, выделения или приобретения многих прокоагу-лянтных веществ, включая тканевый фактор (ТФ), фактор Виллебранда (ФВ), фактор V, ингибиторы активатора плазминогена (ИАП-1 и ИАП-2), интерлейкин-1 (ИЛ-1), фактор некроза ткани (ФНТ), эндотелин-1 (вазокон-стриктор) (см. табл. 26). Незамедлительной реакцией сосудистого эндотелия на травму является вазоконстрикция. Эта преходящая реакция, длительностью менее 60 с, приводит к снижению скорости кровотока, что улучшает взаимодействие между тромбоцитами, факторами свертывания крови и местом травмы. Вазоконстрикция в ответ на небольшую травму может остановить кровотечение, но при обширном повреждении только снижает кровопотерю, чтобы предотвратить обескровливание. 204 Глава 5. Физиология крови Таблица 26 Продукты эндотелиальной клетки, секретируемые в субэндотелиальную зону и в просвет сосуда
Тромбоциты Обнажение субэндотелиальных структур в результате повреждения ЭК приводит к изменению формы тромбоцитов и к их адгезии. Адгезия тромбоцитов опосредована ФВ, который обеспечивает мостиковую связь между гли-копротеином мембраны тромбоцита Ib и обнаженными коллагеновыми структурами на месте травмы. Коллаген (типы I, II, III) субэндотелия и образующийся локально тромбин заставляют прилипшие тромбоциты секретировать содержимое гранул. Коллаген и тромбин также стимулируют активность фосфолипазы мембраны тромбоцита, освобождая арахидоновую кислоту (АК) фосфолипидов мембраны тромбоцита. АК посредством тромбоцитарной цик-лооксигеназы превращается в простагландины Н2 и G2 (ПГН2 и ПГО2). Последние под воздействием тромбоцитарной тромбоксансинтетазы превращаются в тромбоксан А2 (ТхА2) и другие гидроксижирные кислоты. Внутриклеточный ТхА2 сокращает тубулярную систему тромбоцитов, за счет чего гранулы продвигаются к центру клетки и быстрее освобождаются. ТхА2 совместно с Свертывание крови___________________________________205 выделяемой тромбоцитами АДФ способствует агрегации циркулирующих тромбоцитов и закрытию участка поражения тромбоцитарной «пробкой». На периферии этой пробки происходит дезагрегация тромбоцитов из-за выделения антиагрегантов, таких как простациклин (ПГI2), окись азота (NO), аденозиндифосфатазы (АДФ-азы) и других ферментов, образуемых интак-тными соседними энд отел нал ьными клетками. Такой первичной тромбоцитарной пробки достаточно для того чтобы начался гемостаз и остановилось кровотечение в первую минуту, но сама по себе она не может поддерживать гемостаз. Свертывание крови Постоянная гемостатическая пробка формируется при образовании тромбина посредством активации свертывания крови. Тромбин играет важную роль в возникновении, увеличении и локализации гемостатической пробки. Он вызывает необратимую агрегацию тромбоцитов и отложение фибрина на тромбоцитарных агрегатах, образующихся в месте сосудистой травмы. Фиб-рино-тромбоцитарная сеточка образует структурный барьер, предотвращающий дальнейшее вытекание крови из сосуда, и инициирует процесс репарации ткани. Система свертывания крови (рис. 20) — ряд взаимосвязанных реакций с участием протеолитических ферментов. На каждой стадии этой системы биологической амплификации профермент (предшественник фермента, зимоген) превращается в соответствующую сериновую протеазу, которая катализирует трансформацию следующего фермента в сериновую протеазу. Сериновые протеазы гидролизуют пептидные связи в активном центре, основу которого составляет аминокислота серии. Тринадцать этих белков (факторы свертывания крови) составляют систему свертывания крови (табл. 27). Амплификация системы свертывания крови, возникающая локально, является мощным механизмом, необходимым для образования тромбина. Так, одна молекула активированного фактора XII может генерировать 1 млн молекул тромбина. Основная функция тромбина — превращать фибриноген в фибрин. Фибрин удерживает агрегаты тромбоцитов в месте сосудистой травмы и изменяет нестабильную тромбоцитарную пробку (первичную) в стабильную постоянную гемостатическую. Некоторые общие характеристики факторов свертывания крови представлены в табл. 28. Активность факторов I-XIII можно измерить в плазме. Плазма приготавливается путем добавления связывающего кальций вещества (например, цитрата натрия) в цельную кровь. Когда кровь в пробирке свертывается в отсутствие хелатирующего агента или антикоагулянта, образуется сыворотка. Сыворотка не содержит фибриногена, ФII, ФV и ФVIII, поскольку эти факторы утилизуются в процессе образования сгустка. Когда ФV и ФVIII активируются незначительным количеством тромбина в пробирке или invivo, 206 Глава 5. Физиология крови 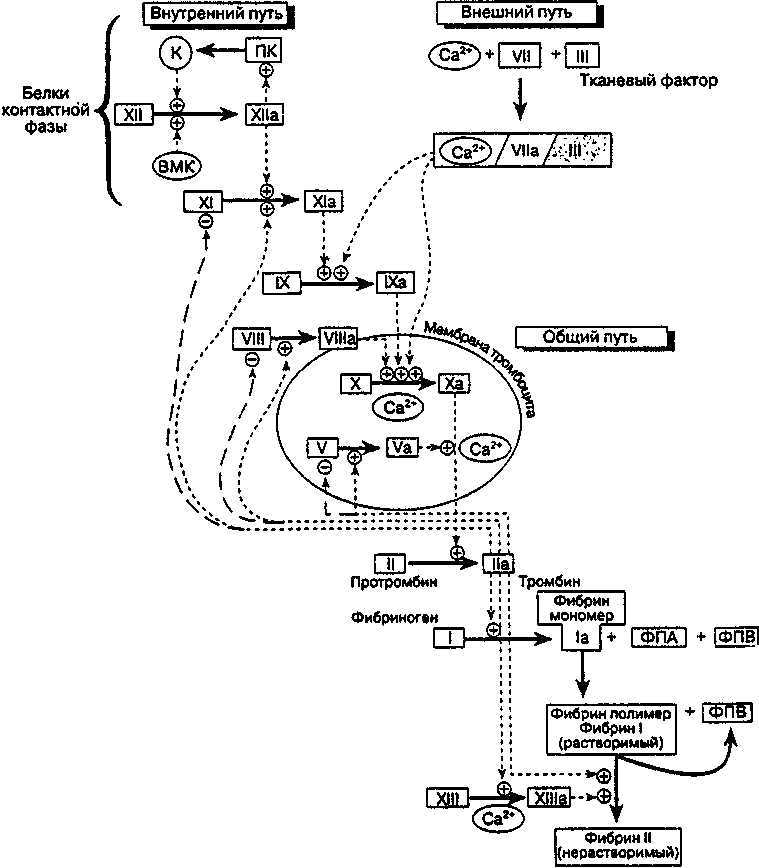 Рис. 20. Активация системы свертывания крови. Стрелки из мелкого пунктира и знаки «+» — активация свертывания; стрелки из крупного пунктира и знаки «-» — ингибирование свертывания. ВМК — высокомолекулярный кининоген; ФПА — фибринопептид А; ФПВ — фибринопептид В; ПК — прекалликреин; К — калликреин. Таблица 27 Факторы свертывания крови, фибринолиза и их ингибиторы [Зубаиров Д. М., 1999]
Продолжение табл. 27
Продолжение табл. 27
Окончание табл. 27
211 Свертывание крови Таблица 28 Некоторые общие характеристики факторов свертывания крови
Примечание. ПК — прекалликреин; ВМК — высокомолекулярный кининоген. их активность быстро исчезает, в связи с чем ФУ и Ф¥Ш называются лабильными факторами свертывания. Активация свертывания крови invivoмодулируется рядом регулятор-ных механизмов, которые ограничивают реакции местом травмы и предотвращают массивный внутрисосудистый тромбоз. К регулирующим факторам относят: — кровоток и гемодилюцию; — клиренс, осуществляемый печенью и РЭС; — протеолитическое действие тромбина (механизм обратной связи); — ингибиторы сериновых протеаз: антитромбин III (AT-III), гепарино-вый кофактор II (ГК-II), протеин С (ПС), протеин S (ПS), протеаза нексин-1 (ПН-1), С1-ингибитор, а,-антитрипсин (а,-АТ); — ингибитор пути тканевого фактора (гомолог апротинина); — фибринолитическая система плазмы (плазминоген, плазмин, активаторы и ингибиторы плазминогена); — клеточная фибринолитическая система (протеазы лейкоцитов, ЭК, тромбоцитов, а также фагоцитоз фибрина и разрушенных клеток). |
