конспект лекций по физхимии. Конспект лекций по дисциплине Химия тема 1 основые понятия и законы химии. Основные законы химии. Закон сохранение массы
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
ТЕМА: ЭЛЕКТРОЛИЗ РАСТВОРОВ СОЛЕЙ. Электролизом называют окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. В растворах электролитов, помимо катионов и анионов присутствуют молекулы воды, которые в ряде случаев участвуют в процессе электролиза. Последовательность разряда катионов. При электролизе водных растворов катионы металлов разряжаются в порядке обратном расположению этих металлов в ряду напряжений. При электролизе водных растворов ионы натрия, калия, бария, кальция, магния, алюминия не разряжаются, вместо них восстанавливаются молекулы воды. Последовательность разряда анионов. J–; Br–; S2-; Cl–; OH–; SO42-; F– УПРАЖНЕНИЯ: 1. Составить уравнение реакции электролиза раствора иодида калия 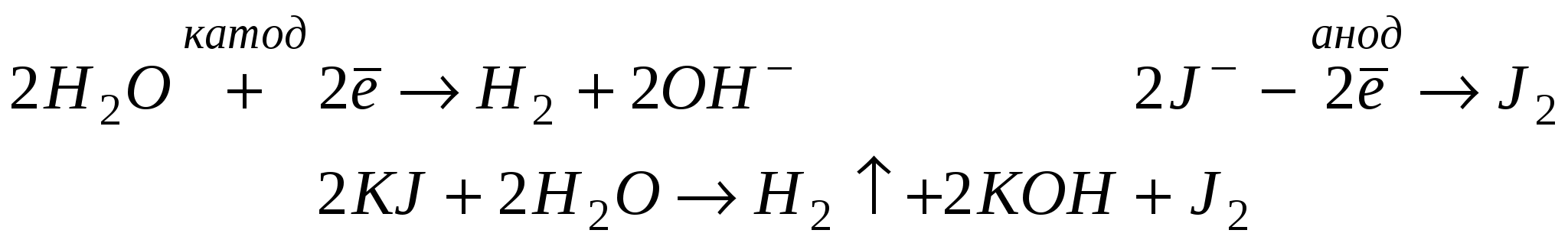 2. Составить уравнение реакции электролиза раствора сульфата меди. 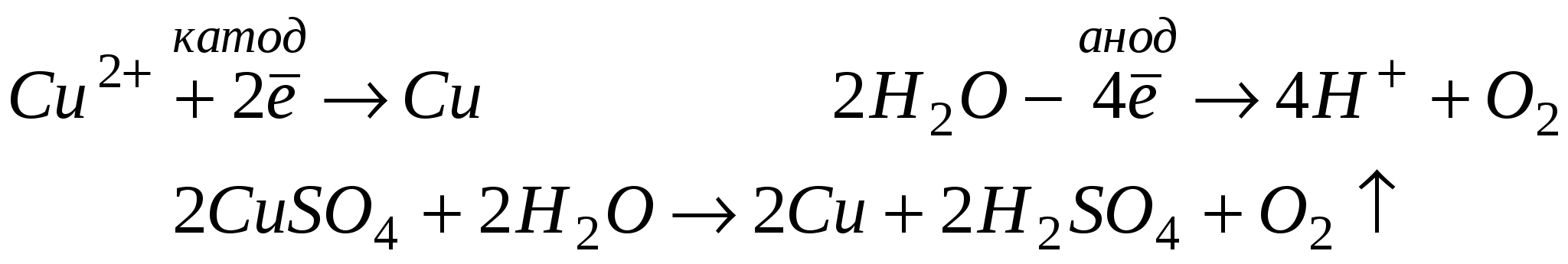 ИТОГОВЫЙ ТЕСТ ЗА 1 СЕМЕСТР Вариант №1 1. Сложные вещества, состоящие из атомов водорода и кислотного остатка, называются:
2. Основания могут реагировать:
3. При взаимодействии алюминия с соляной кислотой образуется (2 балла)
4. Сокращенное ионное уравнение Mg2++ 2OH- → Mg(OH)2 соответствует взаимодействию (2 балла)
5. Электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, называется: а) атом в) протон б) молекула г) нейтрон 6. В главных подгруппах металлические свойства элементов:
7. Сокращенная электронная конфигурация …3р64s2 соответствует атому: а) калия б) кальция в) скандия г) меди 8. Химическая связь между атомами, возникающая путем обобществления электронов с образованием общих электронных пар, называется:
9. В аммиаке (NН3) связь: а) ковалентная неполярная в) ковалентная полярная б) металлическая г) ионная 10 Уменьшение концентрации реагирующих веществ: а) не влияет на скорость реакции б) увеличивает скорость реакции в) уменьшает скорость реакции 11. В ходе химической реакции энергия:
13. Определите реакцию среды в растворе фосфата натрия.
14.Фенолфталеином можно распознать
15.В уравнении реакции Fe2O3 + H2 → Fe + H2O коэффициент перед формулой восстановителя равен: (2 балла)
16. Для приготовления 5%-ного раствора необходимо 2 г сахара растворить в воде, масса которой равна (2 балла)
17. Масса 2,8 л сернистого газа SO2 (2 балла)
18. Какой объем водорода выделиться при взаимодействии 32,5 г цинка с соляной кислотой? (2 балла)
Вариант №2 1. Сложные вещества, состоящие из двух элементов, один из которых – кислород, называются: а) оксидами; в) основаниями; б) кислотами; г) солями 2. Кислоты могут взаимодействовать
3. При взаимодействии гидроксида натрия с азотной кислотой образуется (2 балла)
4. Реакция ионного обмена идет до конца в результате выделения газа при взаимодействии: (2 балла) а) Cu(OH)2 и H2SO4 в) KOH и H2SO4 б) K2CO3 и HCl г) Na2CO3 и CaCl2 5. Положительно заряженная частица называется:
6. На внешнем энергетическом уровне атома серы находится электронов: а) 6 б) 2 в) 4 г) 8 7. Сокращенная электронная конфигурация …3d54s2 соответствует атому: а) кальция б) марганца в) железа г) брома 8. В периодах неметаллические свойства элементов:
9. Связь в металлах и сплавах, обусловленная взаимодействием относительно свободных электронов с катионами в узлах кристаллической решетки, называется а) металлическая в) водородная б) ионная г) ковалентная 10. Какая химическая связь наименее прочная: а) металлическая в) ионная б) водородная г) ковалентная 11. В нитриде калия (К3N) связь: а) ковалентная неполярная в) металлическая б) ковалентная полярная г) ионная 12. Увеличение температуры проведения реакции: а) не влияет на скорость реакции б) увеличивает скорость реакции в) уменьшает скорость реакции 13. Метилоранж меняет цвет на красный в растворе:
14. Определите реакцию среды в растворе нитрата железа (3)
15. В уравнении реакции СH4 + O2→ СО2 + H2O коэффициент перед формулой окислителя равен: (2 балла) а) 1 б) 3 в) 2 г) 4 16. Массовая доля серы в оксиде серы SO2 равна (2 балла)
17. Какова молярная концентрация раствора в 100 мл которого содержится 11,2 г КОН? (2 балла)
18. Какая масса меди выделится при взаимодействии 27 г хлорида меди с цинком? (2 балла)
Вариант №3 1. Сложные вещества, состоящие из атомов металла и кислотных остатков
2. Сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп, называются: а) оксидами; в) основаниями; б) кислотами; г) солями 3. При взаимодействии гидроксида натрия с серной кислотой образуется (2 балла)
4. Сокращенное ионное уравнение Са2++ SO42- → СаSO4 соответствует взаимодействию (2 балла)
5. Электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, называется: а) молекула в) протон б) атом г) нейтрон 6. Отрицательно заряженная частица называется:
7. Сокращенная электронная конфигурация …3d14s2 соответствует атому: а) калия б) кальция в) скандия г) меди 8. В периодах металлические свойства элементов:
9. Максимальное число электронов, которые могут поместиться на 4 электронном уровне: а) 32 б) 18 в) 8 г) 2 10. Связь, образовавшаяся между катионами и анионами за счет их электростатического притяжения, называется: а) металлическая в) водородная б) ионная г) ковалентная 11. Химическая связь в молекуле F2: а) ионная в) ковалентная полярная б) металлическая г) ковалентная неполярная 12. При увеличении температуры на 100С скорость реакции увеличивается в:
13. Определить реакцию среды в растворе карбоната натрия
14. Метилоранж меняет цвет на желтый в растворе:
15. В уравнении реакции KMnO4 + KOH + Na2SO3 → K2MnO4 + Na2SO4 + H2O коэффициент перед формулой окислителя (2 балла) а) 1 б) 3 в) 2 г) 4 16. Массовая доля вещества в растворе, приготовленного из 120 г воды и 40 г соли, равна (2 балла)
17. Какой объем занимают при н.у. 14 г азота? (2 балла)
18. Какой объем углекислого газа образуется при горении 32 г метана СН4?(2 балла)
Вариант №4 1. Сложные вещества, состоящие из двух элементов, один из которых – кислород, называются:
2. Сложные вещества, состоящие из атомов водорода и кислотного остатка, называются:
3. Формулы веществ «X» и «Y» в уравнении реакции Fe(OН)2 + HCl → Х + Y (2 балла)
4. Сокращенное ионное уравнение 2Н++ СO32- → Н2О + СО2 соответствует взаимодействию (2 балла)
5. Электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, называется:
6. В главных подгруппах неметаллические свойства элементов:
7. Максимальное число электронов, которые могут поместиться на 3 электронном уровне: а) 8 б) 18 в) 2 г) 32 8. Сокращенная электронная конфигурация …3s2 3р5 соответствует атому: а) фосфора б) серы в) хлора г) брома 9. Химическую связь между атомами водорода одной молекулы и атомами электроотрицательных элементов (фтором, кислородом, азотом) другой молекулы называют: а) металлическая в) водородная б) ионная г) ковалентная 10. Химическая связь в молекуле H2S:
11. Ионную кристаллическую решетку имеет:
12. Сместить химическое равновесие в реакции можно:
14. Фенолфталеин меняет цвет на малиновый в растворе
15. В уравнении реакции K2Cr2O7 + H2SO4 + Na2SO3 → Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O коэффициент перед формулой восстановителя (2 балла) а) 1 б) 3 в) 2 г) 4 16. Массовая доля углерода в карбонате кальция СаСО3 равна (2 балла)
17. Какова молярная концентрация раствора в 50 мл которого содержится 19,6 г Н2SО4?(2 балла)
18. Какая масса гидроксида железа (2) выделится при взаимодействии FeCl2 с 28 г КОН?(2 балла)
ЛАБОРАТОРНАЯ РАБОТА № 1. Приготовление растворов с заданной концентрацией. Оборудование: стакан (150-200 мл), мерный цилиндр, стеклянная палочка, аналитические весы. Реактивы: вода, сахар, хлорид натрия. Вам предстоит выполнить один из вариантов задания таблицы:
Опыт 1. Приготовление раствора №1. Рассчитайте массу вещества и воды, необходимые для приготовления раствора №1. С помощью весов отмерьте необходимое количество твердого вещества и перенесите его в стакан. Рассчитайте объем воды, необходимый для приготовления раствора (плотность воды 1 г/мл). Мерным цилиндром отмерьте вычисленный объем воды и прилейте его к веществу в стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде. Опыт 2. Приготовление раствора №2. Рассчитайте объем воды, который необходимо добавить к раствору №1 для приготовления раствора №2. Мерным цилиндром отмерьте вычисленный объем воды и прилейте его к раствору №1. Определите массу полученного раствора №2. Опыт 3. Приготовление раствора №3. Рассчитайте массу вещества, которую необходимо добавить к раствору №2 для приготовления раствора №3. С помощью весов отмерьте необходимое количество твердого вещества и добавьте его к раствору №2. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде. Определите массу полученного раствора №3. ЛАБОРАТОРНАЯ РАБОТА № 2. Реакции ионного обмена. Оборудование и реактивы: штатив с пробирками, метилоранж, фенолфталеин, мел, растворы соляной и азотной кислот, гидроксидов натрия и калия, растворы карбоната натрия, хлорида кальция, хлорида железа (3). Опыт 1. Реакций с образованием газа. Подействуйте соляной кислотой на раствор карбоната натрия и на кусочек мела. Опишите результаты опытов. Составьте уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме. Опыт 2. Реакции с образованием осадков. Смешайте растворы хлорида кальция и карбоната натрия, хлорида железа (3) и гидроксида натрия. Опишите результаты опытов. Составьте уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме. Опыт 3. Реакций с образованием слабых электролитов. Проделайте в присутствии индикаторов реакции между: а) соляной кислотой и гидроксидом калия; б) азотной кислотой и гидроксидом натрия; Опишите результаты опытов. Составьте уравнения реакций в молекулярной, полной и такой и сокращенной ионной форме. Упражнения: Составьте уравнения реакций в молекулярной и ионной форме между: а) сульфидом натрия и хлоридом цинка; б) нитратом свинца и иодидом натрия; в) фосфатом калия и хлоридом кальция; г) гидроксидом алюминия и серной кислотой; д) оксидом железа (3) и азотной кислотой ЛАБОРАТОРНАЯ РАБОТА №3 Изучение свойств кислот и щелочей. Часть I. Изучение свойств кислот. Оборудование и реактивы: штатив с пробирками, зажим, водяная баня, медная спираль, цинк, кнопки, оксид меди, растворы серной и соляной кислот, гидроксидов натрия и калия, метилоранж, фенолфталеин, растворы хлорида бария, карбоната натрия, хлорида железа (3), сульфата меди. Опыт 1. Взаимодействие кислот с металлами. Подействуйте раствором кислоты на кусочки железа, цинка, и меди. Опишите результаты опытов, составьте уравнения возможных реакций. Опыт 2. Взаимодействие кислот с оксидами металлов. Подействуйте раствором кислоты на оксид меди, если реакция идет медленно смесь немного нагрейте. Опишите результаты опыта, составьте уравнение реакции. Опыт 3. Взаимодействие кислот с основаниями. В присутствии метилоранжа проведите реакцию между кислотой и щелочью. Опишите результаты опыта, составьте уравнение реакции. Опыт 4. Взаимодействие кислот с солями. Подействуйте раствором серной кислоты на растворы хлорида бария и карбоната натрия. Составьте уравнения реакций. Часть 2. Изучение свойств щелочей. Опыт 1. Взаимодействие щелочей с кислотами. В присутствии фенолфталеина подействуйте на раствор щелочи раствором кислоты. Опишите результаты опыта, составьте уравнения реакции. Опыт 2. Взаимодействие щелочей с солями. Подействуйте раствором щелочи на растворы сульфата меди и хлорида железа (3). Опишите результаты опытов, составьте уравнения реакций. ЛАБОРАТОРНАЯ РАБОТА № 4. Гидролиз солей. Гидролиз - обменное взаимодействие солей с водой. Гидролизу подвергаются соли, содержащие ионы слабого электролита. В гидролизе участвует только ион слабого электролита. Гидролиз идет в сторону образования слабого электролита и останавливается обычно на первой стадии. Полному гидролизу подвергаются соли, образованные слабым основанием и слабой кислотой. Оборудование и реактивы: штатив с пробирками, фенолфталеин, метилоранж, растворы сульфита, сульфида и силиката натрия, растворы хлоридов цинка, алюминия и железа (3), растворы карбоната натрия и сульфата хрома (3). Опыт 1. Гидролиз солей, образованных сильным основанием и слабой кислотой. В три пробирки налейте растворы сульфита, сульфида и силиката натрия. Добавьте 2-3 капли фенолфталеина, опишите наблюдения. Составьте уравнения реакций гидролиза в молекулярной и ионной форме, укажите реакцию среды. Опыт 2 . Гидролиз солей, образованных слабым основанием и сильной кислотой. В три пробирки налейте растворы хлоридов алюминия, цинка и железа (3). Добавьте 2-3 капли раствора метилоранжа, опишите наблюдения. Составьте уравнения реакций гидролиза в молекулярной и ионной форме, укажите реакцию среды. Опыт 3. Гидролиз солей, образованных слабым основанием и слабой кислотой. В две пробирки налейте растворы: а) хлорида алюминия и карбоната натрия; б) сульфата хрома (3) и карбоната натрия. Опишите результаты опытов, составьте уравнения реакций. ЛАБОРАТОРНАЯ РАБОТА № 5. Генетическая связь между классами неорганических соединений. Оборудование: штатив с пробирками, зажим, водяная баня. Реактивы: железные опилки, оксид меди, цинк, растворы соляной, серной и азотной кислот, растворы гидроксидов натрия и калия, растворы хлорида бария, хлорида цинка, сульфата меди, алюминий. Используя имеющиеся реактивы, осуществите следующие превращения: Задание 1. железо → хлорид железа (2) → гидроксид железа (2) → сульфат железа (2) → сульфат бария. Задание 2. 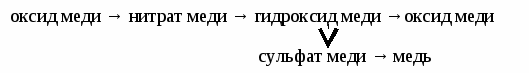 Задание 3. цинк → хлорид цинка → гидроксид цинка → цинкат натрия. Опишите результаты опытов, составьте уравнения реакций. ЛАБОРАТОРНАЯ РАБОТА № 6. Окислительно-восстановительные реакции Оборудование: штатив с пробирками. Реактивы: дихромат калия, перманганат калия, серная кислота, сульфит натрия, гидроксид калия. Опыт 1. В пробирку налейте последовательно (по 0,5 мл) следующие растворы: дихромат калия, серную кислоту, сульфит натрия. Опишите происходящие изменения, расставьте коэффициенты, укажите окислитель и восстановитель. K2Cr2O7 + H2SO4 + Na2SO3 → Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O Опыт 2. В пробирку налейте последовательно (по 0,5 мл) следующие растворы: перманганат калия, гидроксид, калия, сульфит натрия. Опишите происходящие изменения, расставьте коэффициента, укажите окислитель и восстановитель. KMnO4 + KOH + Na2SO3 → KMnO4 + Na2SO4 + H2O Опыт 3 В пробирку налейте последовательно (по 0,5 мл) следующие растворы: перманганат калия, серную кислоту, сульфит натрия. Опишите происходящие изменения, расставьте коэффициенты, укажите окислитель и восстановитель. KMnO4 + H2SO4 + Na2SO3 → MnSO4 + K2SO4 + Na2SO4+H2O РАЗДЕЛ 2 «ОРГАНИЧЕСКАЯ ХИМИЯ» | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
