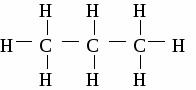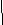конспект лекций по физхимии. Конспект лекций по дисциплине Химия тема 1 основые понятия и законы химии. Основные законы химии. Закон сохранение массы
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
ТЕМА 1: ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ. 1. Предмет органической химии. К органическим веществам относят соединения углерода с другими элементами, за исключением оксидов углерода, угольной кислоты и ее солей. Ученым известно более 18 млн. органических веществ, в то время как неорганических около 100 тыс. Многообразие органических соединений объясняется способностью атомов углерода образовывать цепи, прямые и разветвленные, а также замкнутые циклы. Кроме того, они могут образовывать между собой двойные и тройные связи. Органическая химия - химия углеводородов и их производных, то есть продуктов, образующихся при замене атомов водорода другими атомами или группами атомов. Формулы в органической химии.
2. Теория химического строения органических соединений А.М. Бутлерова. Химическое строение - определенная последовательность соединения атомов в молекулах веществ. Основные положения теории химического строения. 1. Атомы в молекулах соединены друг с другом согласно их валентности, причем углерод в органических веществах всегда четырехвалентен, а его атомы способны соединяться в цепи линейного, разветвленного и замкнутого строения. Свойства органических веществ определяются не только их качественным и количественные составом, но и порядком связи в молекуле, то есть химическим строением. Атомы в молекулах органических веществ оказывают друг на друга взаимное влияние, от которого зависят свойства вещества в целом. 3. Изомерия органических соединений. Изомеры – вещества, имеющие одинаковый состав молекул, но различное химическое строение и, обладающие поэтому разными свойствами. 1. Изомерия углеродного скелета. Упражнение: составить формулы пяти изомеров вещества, имеющего состав С6Н14. 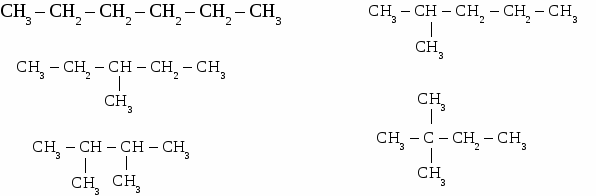 ТЕМА 2: ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. (Парафины. Алканы). Предельными или насыщенными углеводородами называют углеводороды с незамкнутыми углеродными цепями, в молекулах которых все атомы связаны одинарными связями. МЕТАН. 1. Электронное и пространственное строение молекулы метана. Атом углерода имеет электронную формулу 1s2 2s2 2р2, на внешнем энергетическом уровне находится четыре электрона. В невозбужденном состоянии у атома углерода два неспаренных электрона. При переходе в возбужденное состояние один s-электрон переходит на вакантную р-орбиталь, атом углерода становится четырехвалентным.
При образований молекулы метана и молекул других предельных углеводородов происходит гибридизация электронных орбиталей. Одна s- и три р-орбитали взаимодействуют между собой, образуя четыре новые, совершенно равноценные орбитали. Такой процесс называется sp3 - гибридизацией. Гибридизация - процесс выравнивания электронных орбиталей по форме и энергии. В результате взаимного отталкивания гибридные орбитали занимают в пространстве самое выгодное положение, поэтому угол между их осями равен 109°28 и они направлены по вершинам правильного тетраэдра. Таким образом молекула метана в пространстве представляет собой тетраэдр. 2 Физические свойства метана. Метан в природе. Метан - газ без цвета, вкуса и запаха, легче воздуха, нерастворим в воде. Входит в состав природного газа (до 95%), встречается в каменноугольных шахтах, где представляет большую опасность. 3. Химические свойства метана. 3.1 горение СН4 + 2О2 → СО2 + 2Н2О 3.2 разложение при нагревании 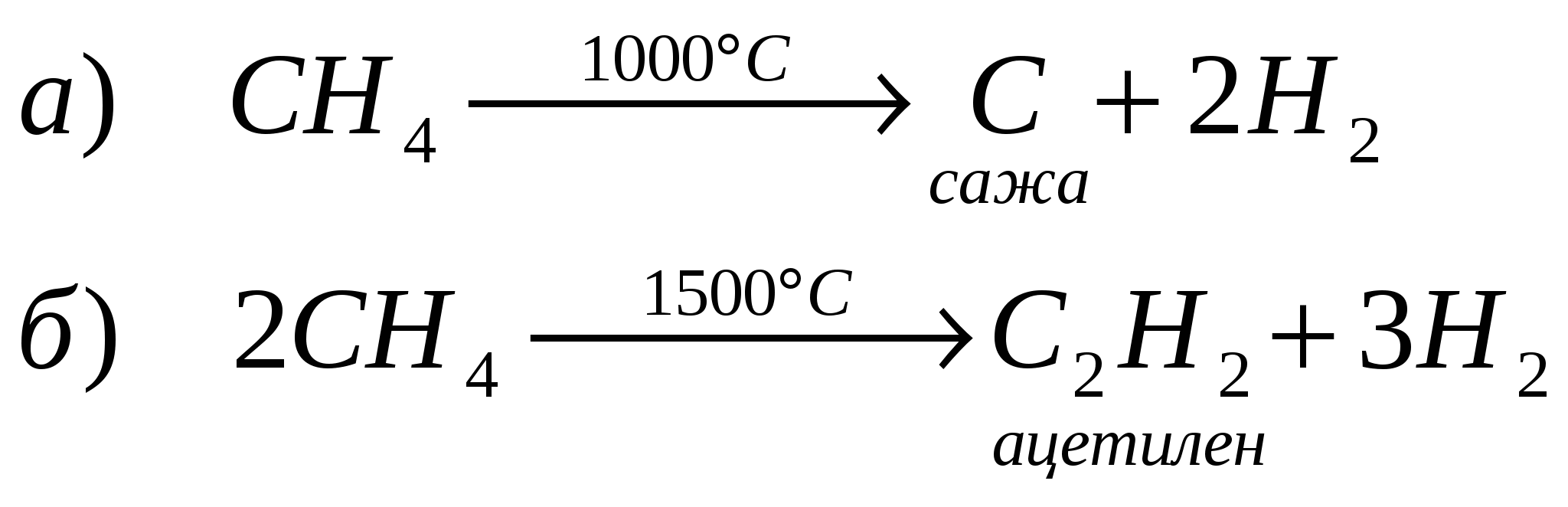 3.3 реакция замещения 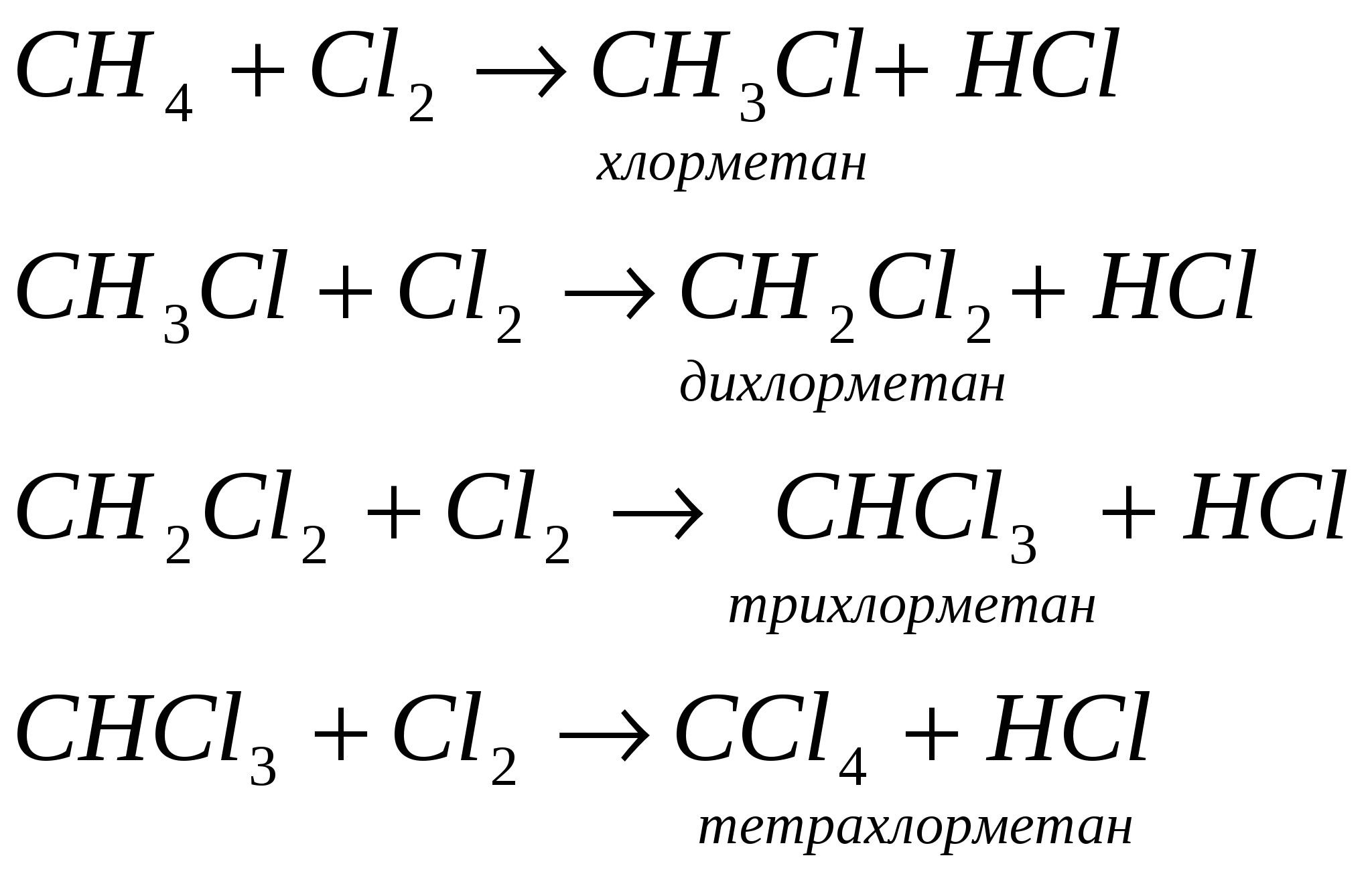 Механизм реакции замещения. 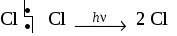 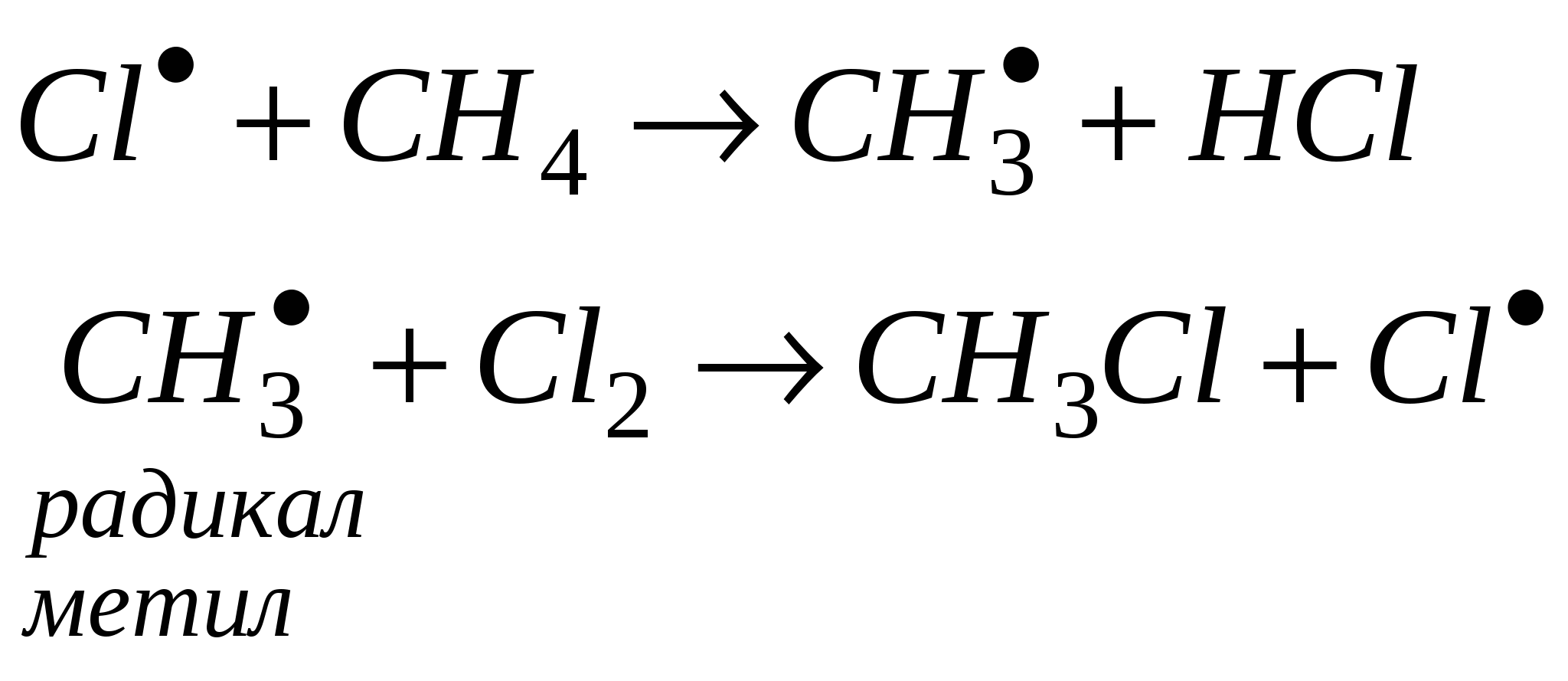 Реакция замещения идет по свободно-радикальному механизму. Частицы, имеющие неспаренные электроны, и обладающие поэтому неиспользованными валентностями, называются свободными радикалами. 5. Получение метана в лаборатории. 6. Применение метана. Метан используется как топливо и сырье в химической промышленности. Гомологический ряд предельных углеводородов. Гомологическим рядом называют рядсоединений, расположенных по возрастанию их относительных молекулярных масс, сходных по строению и свойствам и обличающихся друг от друга на одну или несколько групп – СН2 – (на гомологическую разность).
СnH2n+2 общая формула предельных углеводородов. Физические свойства алканов. При нормальных условиях первые четыре члена гомологического ряда алканов - газы. Алканы от С5Н12 до С17Н36 - бесцветные жидкости, а начиная от С18Н38 - твердые вещества. Номенклатура предельных углеводородов, В настоящее время для построения названий органических веществ наиболее широко используют международную номенклатуру ИЮПАК. В соответствии с требованиями ИЮПАК при названии алканов следует руководствоваться определенными правилами. Выбирают в молекуле самую длинную цепочку углеродных атомов. Нумеруют цепочку с того конца, к которому ближе разветвление молекулы. Перечисляют все заместители основной цепи в порядке возрастания сложности, указав номера углеводных атомов, паи которых они стоят. Если одинаковых заместителей несколько, перед их названиями ставят приставки ди-, три-, тетра- и т.д. согласно греческим числительным. Все цифры друг от друга отделяют запятыми, буквы от цифр - дефисом. Если при одном углеродном атоме имеется не один, а два заместителя, его цифру повторяют в названии дважды. Вконце названия записывают название того углеводорода, цепь которого взята за основу (пронумерована). УПРАЖНЕНИЕ Составить формулы пяти изомеров гексана и назвать их используя номенклатуру ИЮПАК. 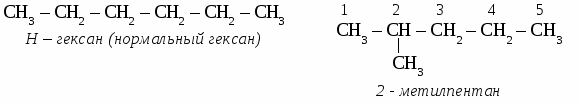 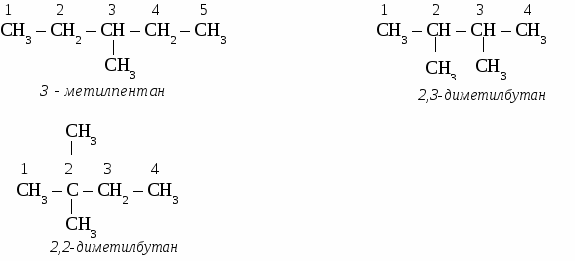 Строение молекул алканов. Молекулы предельных углеводородов имеют зигзагообразное строение. Угол между направлениями углерод - углеродных равен 109° 28. В молекулах алканов возможно относительно свободное вращение атомов вокруг связи С—С.  Химические свойства алканов. Для предельных углеводородов характерна реакция замещения с галогенами: Fe2; Cl2; Br2; J2. Все предельные углеводороды горят с образованием углекислого газа и воды и разлагаются без доступа воздуха на составляющие элементы. Упражнение. Составить уравнения реакций хлорирования пропана (4 стадии), назвать продукты реакций. 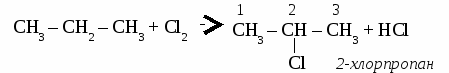  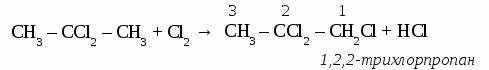 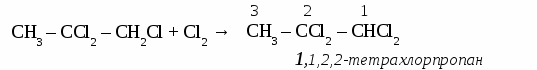 Циклоалканы. Σ = 180° (п – 2) формула для расчета величины угла в правильном  Получение предельных углеводородов. 1. Реакция Вюрца. CH3Cl + 2Na + CH3Cl → CH3 – CH3 + 2NaCl 2. Переработка нефти и попутных нефтяных газов. ТЕСТ ПО ТЕМЕ «АЛКАНЫ» Вариант №1 1. Диметилпропан относится к классу углеводородов, общая формула которого а) CnH2n+2 в) CnH2n -2 б) CnH2n г) CnH2n+1 2. Гомологом этана является а) С2Н4 в) СН3- CH2 - CH2 - СН3 б) С3Н4 г) С6Н12 3. Какой вид изомерии характерен для алканов: а) положения двойной связи в) углеродного скелета б) пространственная г) гомологических рядов 4. Угол связи в молекулах алканов составляет а)109028 б)1200 в) 1800 г) 10405 5. В уравнении полного сгорания пентана коэффициент перед формулой кислорода равен а) 5 б) 8 в) 6 г) 9 6. Пропан взаимодействует с: а) Br2 в) HCl б) H2 г) NaOH (р-р). 7. Газообразные алканы – это: а) СН4, С4Н10, С10Н22 в) С6Н14, С5Н12, С5Н10 б) С3Н8, С2Н6, С4Н10 г) С7Н16, С6Н14, С10Н22. 8. Реакция 2СН3I + 2Na = 2NaI + C2Н6 носит имя: а) Зинина; в).Вюрца; б) Бутлерова; г) Менделеева. 9. Установите соответствие между формулой вещества и его названием: Структурная формула Название вещества СН3 | 1) 2 – метилпентан а) СН3 –C – СН3 2) пентан | 3) бутан СН3 4) 2,2 - диметилпропан б) СН3 – СН2 – СН2 – СН3 5) гептан в) СН3 – (СH2)5 – СН3 6) гексан г) СН3 – СН – СН2 – СН2 – СН3 | СН3 10. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
Вариант №2 1. Атом углерода в органических соединениях имеет валентность: а) 2 б) 3 в) 4 г) 2 и 4 2. Гомологом пентана является: а) С6Н12 в) С7H16 б) С6Н6 г) С7Н14 3. Изомерами являются а) 2,2 –диметилпропан и пентан в) гексан и 2-метилбутан б) 3-этилгексан и 3-этилпентан г) пропан и пропен 3. Атомы углерода в алканах находятся в состоянии: а) sр-гибридизации; в) sр3-гибридизации; б) pр-гибридизации; г) sр2-гибридизации; 4. Молекулы предельных углеводородов нормального строения имеют цепочку атомов углерода: а) линейного строения; б) зигзагообразную с углом между связями 90°; в) зигзагообразную с углом между связями 109°28 5. Тип связи в молекулах алканов: а) ионная в) ковалентная неполярная б) металлическая г) ковалентная полярная 6 . В уравнении полного сгорания этана коэффициент перед формулой кислорода равен а) 7 б) 8 в) 6 г) 9 7. Формула тетрахлорметана: а) ССl4; б) СНСl3; в) СН2Сl2; г) СН3Сl. 8. Укажите углеводород, являющийся основным компонентом природного газа а) бутан 9 Установите соответствие между формулой вещества и его названием: Структурная формула Название вещества
10. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
Вариант №3 1. Алкан, молекула которого содержит 6 атомов углерода, имеет формулу: а) C6H14 б) C6H10 в) C6H12 г) C6H6 2. Вещества одинакового состава, но различного строения и с различными свойствами называют: а) радикалами в) изомерами б) гомологами г) аналогами 3. Гомологами являются: а) циклобутан и бутан в) гексен и декан б) бутан и пентан г) 2-метилпентан и гексан 4. Радикал бутил имеет состав: а) –C4H7 в) –C4H9 б) C4H10 г) C4H6 5. Изомером 3,4-диметилгексана является: а) 4,4,5-триметилгексан в) 4,4-диметилгептан б) 2,2,3-триметилпентан г) 2-метил,3-этилгексан 6. Валентный угол в алканах равен: а) 109°28'; б) 180°; в) 90°; г) 270°. 7 . В уравнении полного сгорания пентана коэффициент перед формулой кислорода равен а) 10 б) 9 в) 8 г) 7 8. Реакции замещения соответствует уравнение: а) С3Н6 + Н2O → С3Н7ОН; б) С2Н6 + Вг2 → С2Н5Вr + НВr; в) С2Н2 + 2Н2 → С2Н6; г) 2С4Н6 + 11O2 → 8СO2 + 6Н2O. 9. Установите соответствие между формулой вещества и его названием: а) СН3 – СН2 – СН2 – СН – СН – СН3 1) 2,3,4, - триметилгексан | | 2) 2,3 - диметилгексан СН3 СН3 3) 2,3 - диметилпентан б) СН3 – СН2 – СН2 – СН2 – СН3 4) 2,3 - диметилбутан в) СН3 – СН2 – СН – СН – СН – СН3 5) пентан | | | 6) гексан СН3 СН3 СН3 г) СН3 – СН – СН – СН3 | | СН3 СН3 10. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
Вариант №4 1. Алканам соответствует общая формула а) СņН2ņ в) СņН2ņ-6 б) СņН2ņ+2 г) СņН2ņ-2 2. Изомерами являются а) метан и этан в) 2,2-диметилбутан и 2,2-диметилпентан б) метилпропан и бутан г) 2,3-диметилгексан и 4-метилгексан 3. Молекула метана имеет строение: а) октаэдрическое; в) тетраэдрическое; б) плоскостное; г) гексагональное. 4. Каждый последующий представитель гомологического ряда органических соединений отличается от предыдущего на гомологическую разность, равную: а) СН; б) СН3; в) СН4; г) СН2. 5. Формула С2Н5 соответствует: а) радикалу этилу; в) пентану; б) этану; г) радикалу пропилу; 6. Коэффициент перед формулой кислорода в уравнении реакции горения бутана равен: а) 10 б) 11 в) 8 г) 9 7. Взаимодействие метана с хлором – это реакция: а) разложения; в) обмена; б) соединения; г) замещения. 8. Укажите формулу алкана, являющегося жидкостью при обычных условиях. а) C4H10 б) C16H34 в) C7H16 г) CH4 9. Установите соответствие между формулой вещества и его названием:
10. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||