конспект лекций по физхимии. Конспект лекций по дисциплине Химия тема 1 основые понятия и законы химии. Основные законы химии. Закон сохранение массы
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
ТЕМА 15: ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ. Предельными одноосновными карбоновыми кислотами называют органические соединения, содержащие карбоксильную группу – СООН, связанную с углеводородным радикалом. R – СООН – общая -формула одноосновных карбоновых кислот Гомологический ряд одноосновных карбоновых кислот.
Физические свойства. Молекулы карбоновых кислот подобно спиртам могут образовывать водородные связи друг с другом и с молекулами воды. С возрастанием молекулярной массы растворимость карбоновых кислот в воде падает. Высшие кислоты в воде практически нерастворимы. Кислоты с число атомов углерода в молекуле от 1 до 9 при комнатной температуре-жидкости с неприятным, раздражающим запахом. Высшие карбоновые кислоты запаха не имеют. Химические свойства.
а) диссоциация 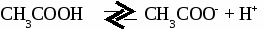 б)с металлами 2СН3СООН + Mg → (CH3COO)2Mg + H2 в) с основными оксидами 2СН3СООН + MgO → (CH3COO)2Mg + H2O г) с основаниями СН3СООН + NaOH → CH3COONa + H2O д) с солями 2СН3СООН + CaCO3 → (CH3COO)2Ca + H2O + CO2
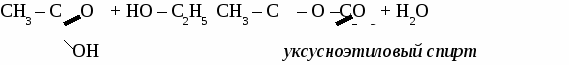
СН3 – СООН + Cl2 → Cl – CH2 – COOH + HCl хлоруксусная кислота Получение и применение уксусной кислоты.
С2Н5ОН + О2 → СН3СООН + H2O
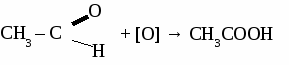 3. Окисление бутана. 2С4Н10 + 5О2 → 4СН3СООН + 2H2O Основная часть получаемой уксусной кислоты используется для производства искусственных волокон и пластмасс на основе целлюлозы, для производства красителей, ядохимикатов. ВЫСШИЕ КАРБОНОВЫЕ КИСЛОТЫ С15Н31СООН – пальмитиновая кислота С17Н35СООН – стеариновая кислота С17Н33СООН – олеиновая кислота С17Н31СООН – линолевая кислота Высшие карбоновые кислоты вступают в те же реакции, что и другие кислоты. Соли высших карбоновых кислот называются мылами. Мыла. Мыла - соли высших карбоновых кислот. 1. Моющие мыла. С17Н35СООNa – твердое мыло С17Н35СООK –жидкое мыло Мыла проявляют свойства солей, то есть реагируют с кислотами, щелочами и растворами других солей, а также подвергаются гидролизу. 2C17H35COONa + BaCl2 → (C17H35COO)2Ba↓ + 2NaCl 2C17H35COO- + 2Na+ + Ba2+ + 2Cl- → (C17H35COO)2Ba↓ + 2Na+ + 2Cl- 2C17H35COO- + Ba2+ → (C17H35COO)2Ba↓ C17H35COONa + H2O → C17H35COOH↓ + NaOH C17H35COO- + Na+ + H2O → C17H35COOH↓ + Na+ + OH- C17H35COO- + H2O → C17H35COOH↓ + OH- 2. Немоющиемыла. (C17H35COO)2Сa, (C17H35COO)3Al Немоющие мыла используются для изготовления консистентных смазок (солидол) и для получения напалма. СЛОЖНЫЕ ЭФИРЫ. Производные карбоновых кислот, в которых атомы водорода карбоксильной группы замещены на углеводородные радикалы, называют сложными эфирами. Общая формула сложных эфиров 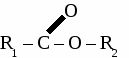 Физические свойства. Сложные эфиры низших карбоновых кислот представляют собой летучие жидкости, многие из которых обладают приятным фруктовым или цветочным запахом. Они практически нерастворимы в воде. Получение сложных эфиров. В основе получения сложных эфиров лежит реакция этерификации между карбоновой кислотой и спиртом. Реакция катализируется сильными кислотами. 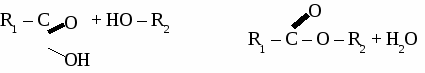 Химические свойства.
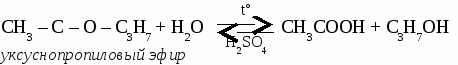
2CH3 – CО – O – СH3 + 7О2 → 6СО2 + 6 H2O уксуснометиловый эфир ЖИРЫ Жирами называют сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот. 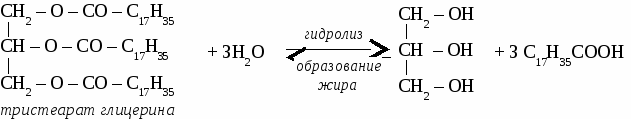 1. Животные жиры. Животные жиры обычно твердые вещества (исключение - рыбий жир). Животные жиры используются в пищу и для получения твердого мыл. 2. Растительные жиры (масла). Растительные жиры обычно жидкие (исключение - пальмовое масло). Растительные жиры используются в пищу, для получения маргарина, для получения олифы. Упражнение. Составьте уравнения реакций по схеме: 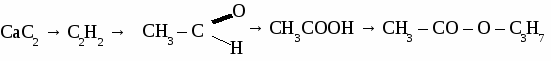 Задача №1. При окислении 70 кг метанола получили 50 кг формальдегида. Определите выход формальдегида в %от теоретически возможного. Задача №2. При взаимодействии 50 г раствора уксусной кислоты с карбонатом магния образовалось 3,6 л углекислого газа. Определите процентную концентрацию исходного раствора кислоты. Задача №3. При гидратации этилена получили 115 кг этанола, что составляет 70 %от теоретически возможного выхода. Вычислить объем этилена, введенного в реакцию. Самостоятельная работа на тему «КАРБОНОВЫЕ КИСЛОТЫ» Вариант 1. 1. Составьте уравнения реакций по схеме: 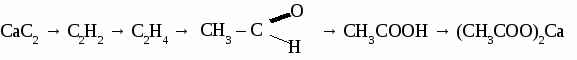
Вариант 2. 1. Составьте уравнения реакций по схеме: 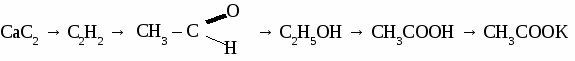
Вариант 3. 1. Составьте уравнения реакций по схеме: 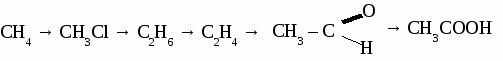
Вариант 4. 1. Составьте уравнения реакций по схеме: 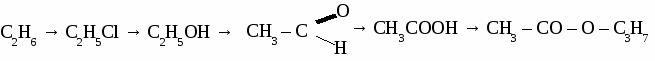
Вариант 5. 1. Составьте уравнения реакций по схеме: 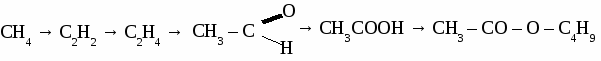
Вариант 6. 1. Составьте уравнения реакций по схеме: 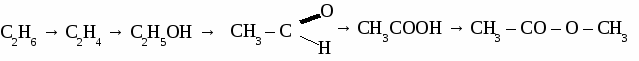
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА». Вариант 1.
а) пропандиол-1,3 б) 2-метилбутанол-2 в) 3-этилпентанол-2 2. Составьте уравнения реакций по схеме: 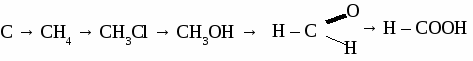 3. Составьте уравнения реакций: а) «серебряного зеркала» для уксусного альдегида, б) нитрования глицерина, в) взаимодействия метанола и пропионовой кислоты Вариант 2. 1. Составьте формулы по названиям: а) 2-метилпропанол-2 б) 2,3-диметилпентанол-3 в) 3-метилбутаналь 2. Составьте уравнения реакций по схеме: С2Н6 → С2Н4 → С2Н5ОН → С2Н5Cl → С2Н5OH → СН3COOH 3.Составьте уравнение реакции: а) получения диэтилового эфира из этанола, б) нитрования фенола, в) качественной реакции на глицерин. Вариант 3. 1. Составите формулы по названиям: а) 2,4,4-триметилпентанол-2 б)гександиол-2, 4 в) 4-метилпентаналь 2. Составьте уравнения реакций по схеме: 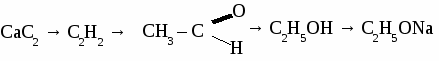 3. Составьте уравнение реакции: а) получения фенола из хлорбензола, б) взаимодействия уксусной кислоты и метанола, в) взаимодействия этиленгликоля и натрия. Вариант 4. 1. Составьте формулы по названиям: а) 2-метилпропандиол-1,3 б) 2,2-диметилбутанол-1 в) бутандиол-1,4 2. Составьте уравнение реакций по схеме: 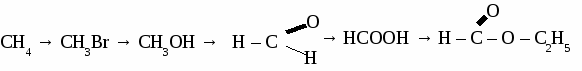 3. Составьте уравнение реакции: а) получения пропилового эфира уксусной кислоты, б) бромирования фенола, в) «серебряного зеркала» для формальдегида. ТЕМА 17: УГЛЕВОДЫ.
ГЛЮКОЗА 1. Физические свойства. Твердое, белое f кристаллическое вещество, вкус сладкий, растворима в воде. 2. Строение молекулы. 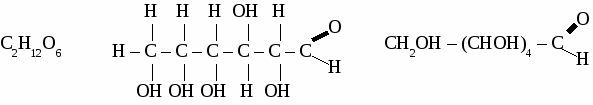 Глюкоза - альдегидоспирт. 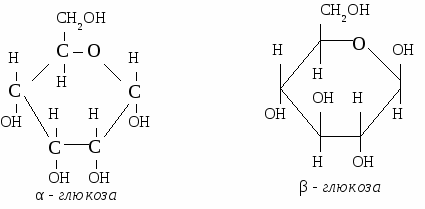 3. Химические свойства. 3.1 Глюкоза как многоатомный спирт реагирует без нагревания с гидроксидом меди, при этом образуется темно-синий раствор глюконата меди. 3.2 Реакции по альдегидной группе. а) реакция «серебряного зеркала» 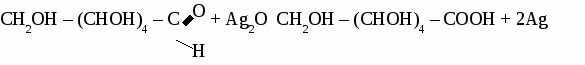 б) с гидроксидом меди 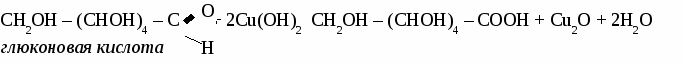
а) спиртовое С6Н12О6 → 2С2Н5ОН + 2СО2↑ б)молочнокислое 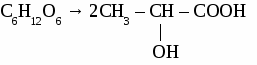 в) маслянокислое С6Н12О6 → С3Н7СООН + 2СО2↑ + 2Н2↑ 3.4 Полное окисление глюкозы. С6Н12О6 + 6О2 → 2СО2 + 6Н2О 4. Получение и применение глюкозы. (С6Н10О5)n + nН2О → nС6Н12О6 крахмал Глюкоза используется в медицине, для получения этанола, при изготовлении зеркал. ФРУКТОЗА. Фруктоза является изомером глюкозы. 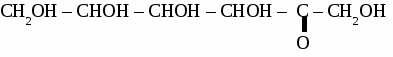 Фруктоза - кетоноспирт. Вместе с глюкозой входит в состав меда, имеет более сладкий вкус, чем глюкоза. Задача. Сколько литров раствора этанола (плотность 0,79) с массовой долей С2Н5OH 95 %получится при спиртовом брожении 36 кг глюкозы? САХАРОЗА. Физические свойства. Сахароза - твердое, белое, кристаллическое вещество, растворима в воде, вкус сладкий. Сахароза в природе. Сахароза входит в состав сока многих растении. Например, в соке сахарного тростника ее 14-16 %, а в соке сахарной свеклы 16-21 %. Химические свойства. 1. Гидролиз. С12Н22О11 + Н2О глюкоза фруктоза
С12Н22О11 + 2СА(ОН)2 → С12Н22О11 · 2СаО + Н2О сахарат кальция С12Н22О11 · 2СаО + 2СО2 → С12Н22О11 + 2 СаСО3↓ Применение сахарозы. Сахароза используется в кондитерском производстве и для получения, этилового спирта. Задача. Сколько тонн сахарной свеклы с массовой долей сахарозы 20 %будет подвергнуто гидролизу для получения глюкозы массой 1т? КРАХМАЛ. Крахмал - природный полимер, макромолекулы которого состоит из остатков α-глюкозы и имеют в основном разветвленное строение. Физические свойства. Крахмал - твердое, белое, аморфное вещество без вкуса и запаха. Крахмал нерастворим в холодной воде, в горячей воле образует коллоидный раствор (клейстер). Крахмал в природе. Крахмал является одним из продуктов фотосинтеза и поэтому широко распространена в природе. Зерна риса содержат до 86 %крахмала, пшеницы до 75 %, кукурузы - до 72 %. Вклубнях картофеля содержание крахмала достигает 24 %. Химические свойства. 1. Гидролиз (С6Н10О5)n + nН2О 2. Качественная реакция на крахмал. Реактивом на крахмал является раствор йода. Результат реакции - синее окрашивание. Применение крахмала. Крахмал является одним из важнейших компонентов пищи. Значительное количество крахмала перерабатывается на патоку, глюкозу, пищевой спирт, молочную кислоту. Крахмал используют в текстильной промышленности дляотделки тканей. Задача. Какую массу кукурузных зерен надо взять для получения спирта массой 115 кг, с массовой долей C2H5OH 96 %, если массовая доля крахмала в кукурузных зернах составляет 70 %? ЦЕЛЛЮЛОЗА (КЛЕТЧАТКА). Целлюлоза - природный полимер, макромолекулы которого состоят из остатков /3 -глюкозы и имеют линейное строение. Физические свойства. Целлюлоза - твердое, белое, аморфное вещество без вкуса и запаха. Она нерастворима в воде и органических растворителях, но растворима в аммиачном растворе сульфата меди. Химические свойства. 1. Гидролиз (С6Н10О5)n + nН2О 2. Образование сложных эфиров. [С6Н7О2(OH)3]n + 3nНNО3 тринитрат целлюлозы [С6Н7О2(OH)3]n + 3nСН3СООН → [С6Н7О2(OСОСН3)3]n + 3nН2О триацетат целлюлозы Целлюлоза в природе. Целлюлоза является основной частью стенок растений, Относительно чистой целлюлозой являются волокна хлопчатника. Древесина содержит от 40 до 50 %целлюлозы. Применение целлюлозы. Из целлюлозы изготавливают искусственные волокна, полимерные пленки, пластмассы, бездымный порох, бумагу. Образование крахмала и клетчатки в зеленых растениях. 6СО2 + 6Н2О nС6Н12О6 → (С6Н10О5)n + nН2О | ||||||||||||||||||||||||||||
