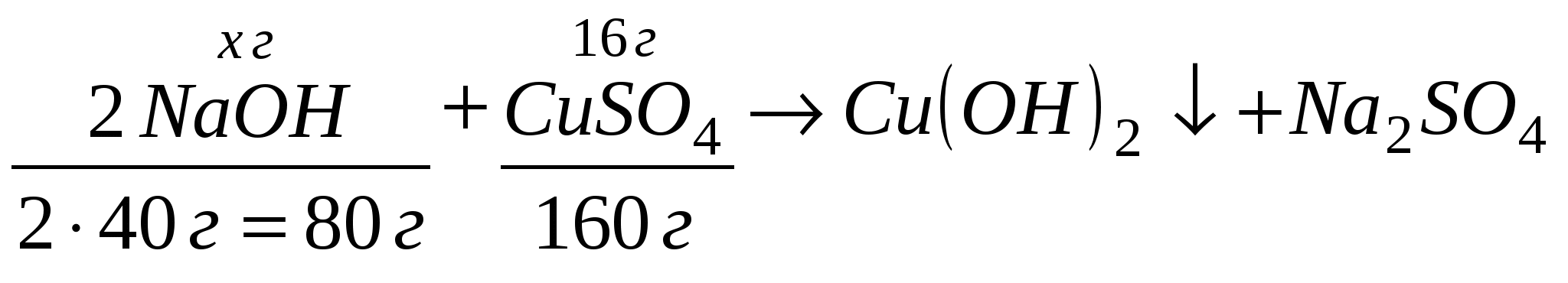|
|
конспект лекций по физхимии. Конспект лекций по дисциплине Химия тема 1 основые понятия и законы химии. Основные законы химии. Закон сохранение массы
ТЕМА: РАСЧЕТЫ ПО ФОРМУЛАМ И УРАВНЕНИЯМ.
Условные обозначения, названия и единицы измерения физических величин.
-
Ar
|
относительная атомная масса
|
|
а.е.м.
|
Мr
|
относительная молекулярная масса
|
|
а.е.м.
|
ν
|
количество вещества
|
|
моль
|
m
|
масса вещества
|
|
г, кг, т
|
М
|
молярная масса
|
|
г/моль
кг/моль
|
V
|
объем
|
|
л, м3
|
Vм
|
молярный объем
|
|
л/моль
м3/моль
|
Формулы для расчетов:

1 моль любого газа при нормальных условиях занимает объем 22,4 л.
Примеры решения задач:
Задача 1. Вычислите, сколько граммов магния содержится в карбонате магния массой 21 г.
-
Дано:
 = 21 г = 21 г
|
|
Решение:
1. 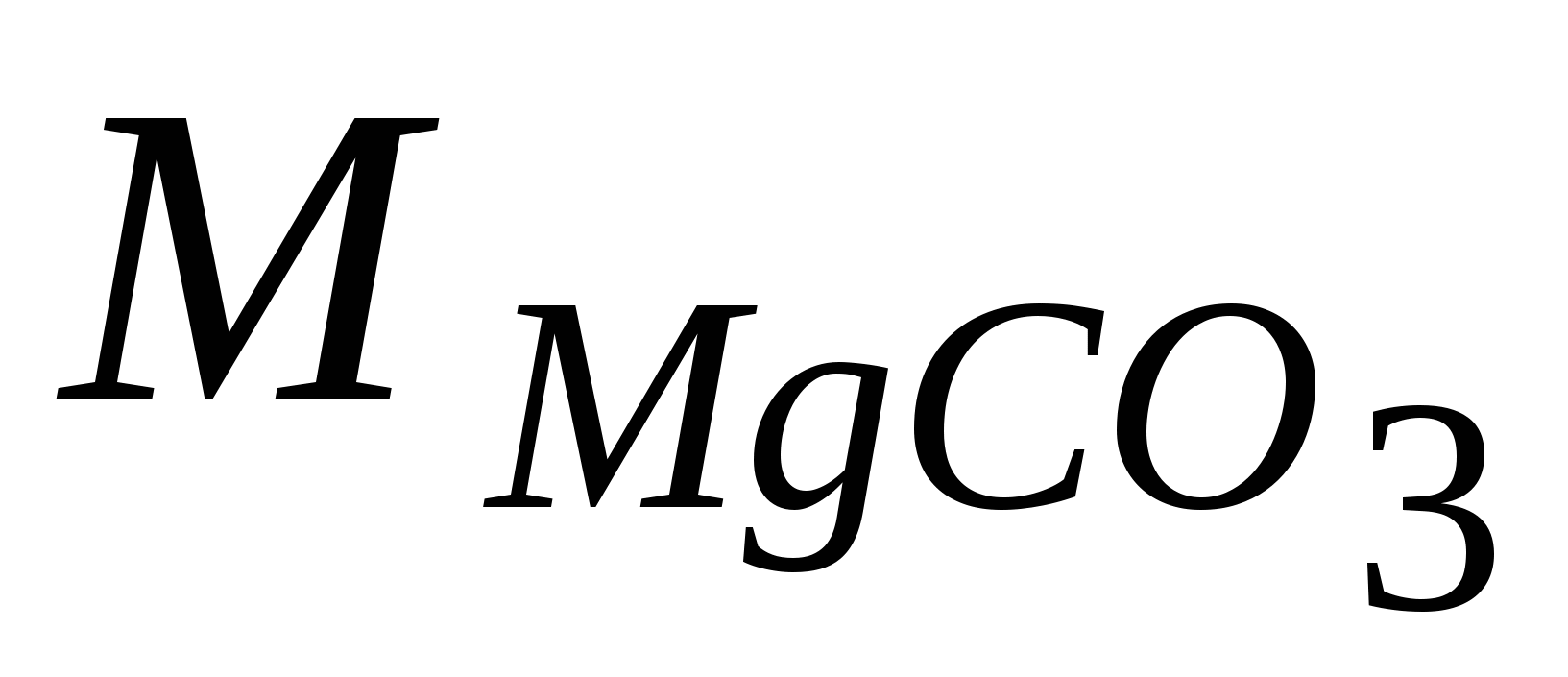 = 24 + 12 + 16·3 = 84 г/моль = 24 + 12 + 16·3 = 84 г/моль
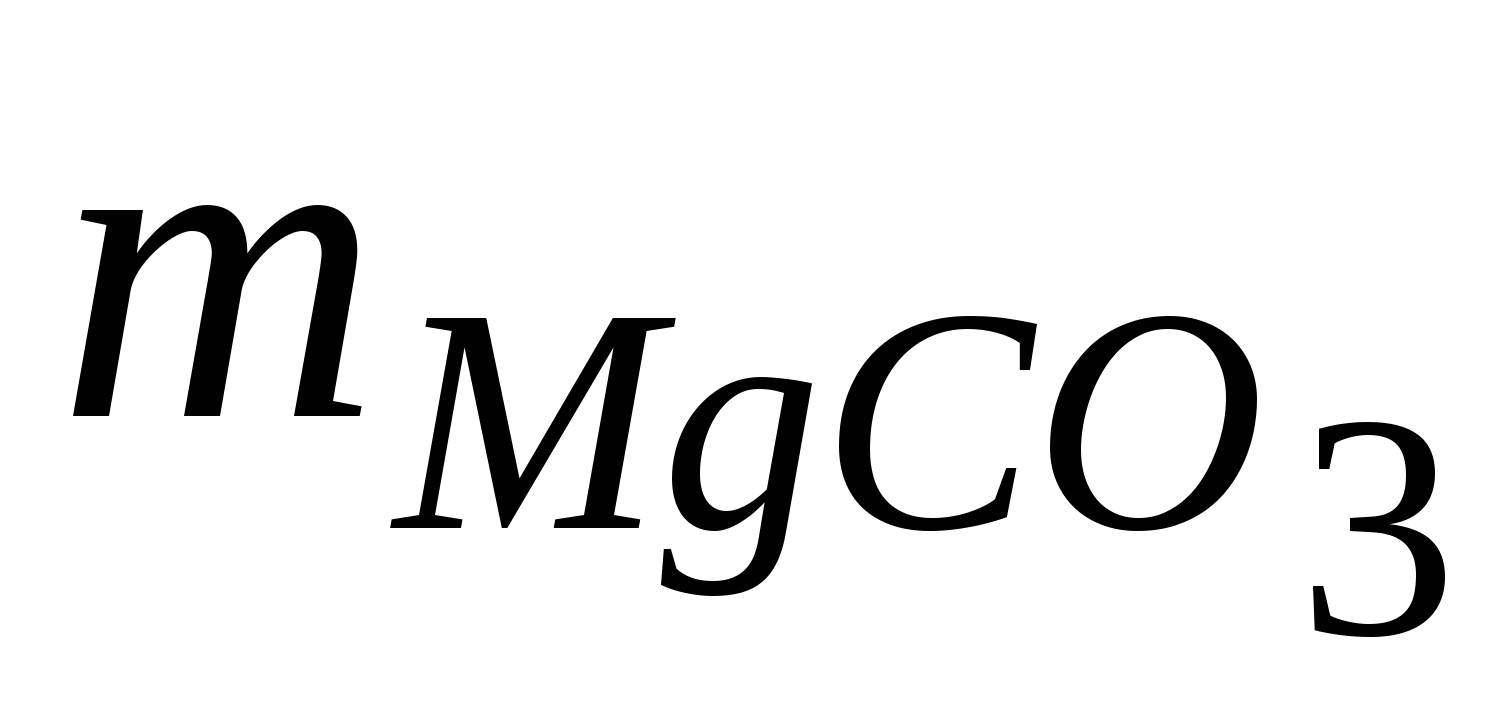 = 84 г/моль · 1 моль = 84 г = 84 г/моль · 1 моль = 84 г
2. 84 г MgCO3 – 24 г Mg
21 г MgCO3 – х г Mg
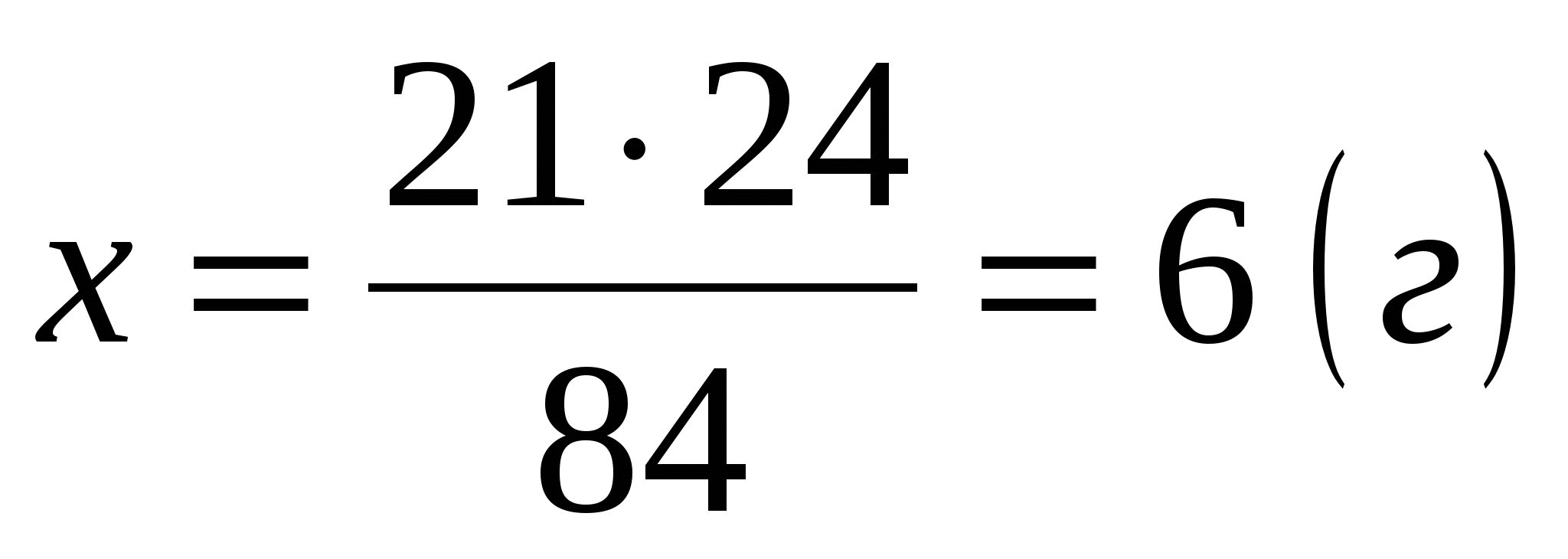
Ответ: mMg = 6 г.
|
mMg = ?
|
Задача 2: Вычислить массу 5,6 л кислорода.
-
Дано:
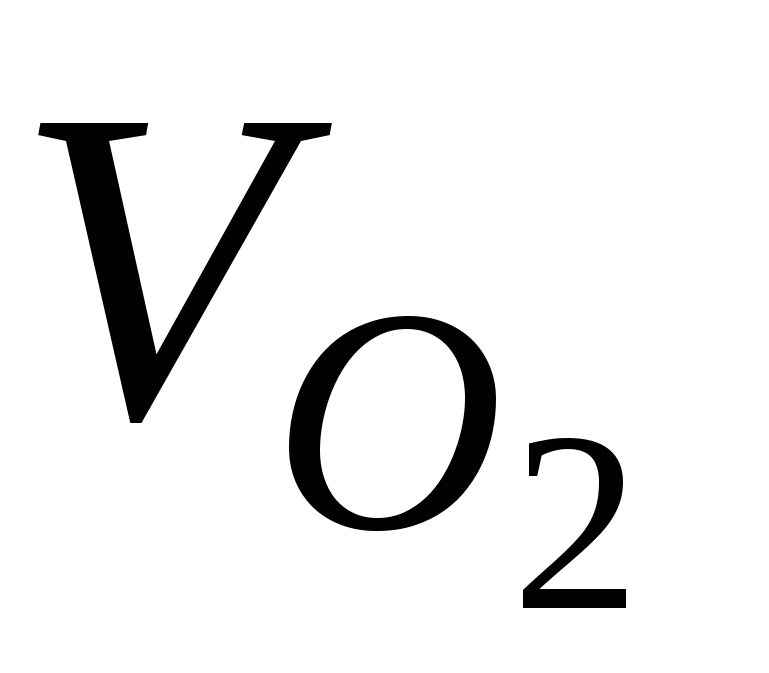 = 5,6 л = 5,6 л
|
|
Решение:
1.  = 16 · 2 = 32 г/моль = 16 · 2 = 32 г/моль
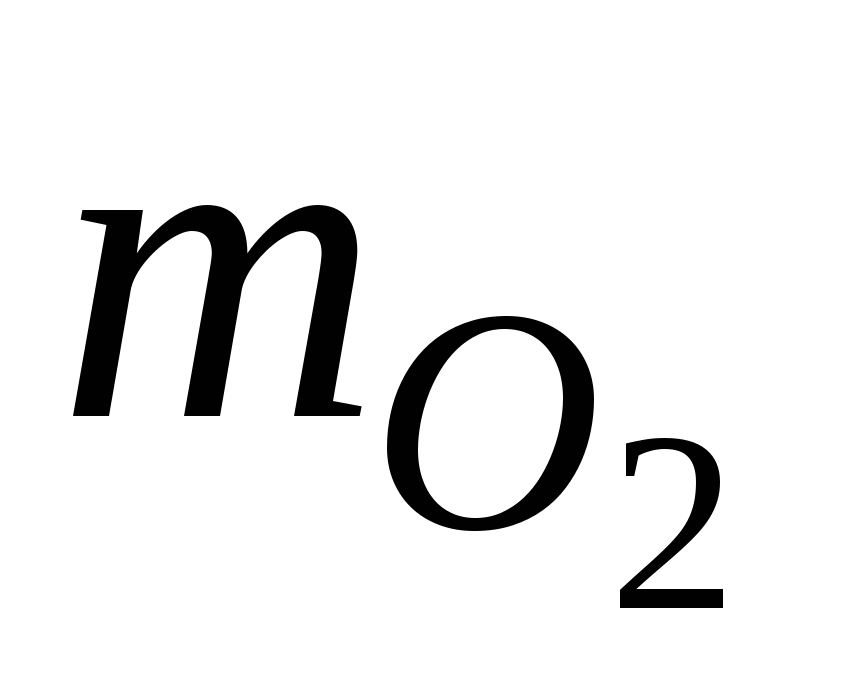 = 1 моль · 32 г/моль = 32 г = 1 моль · 32 г/моль = 32 г
2. 22,4 л O2 – 32 г
5,6 л О2 – х г

Ответ: 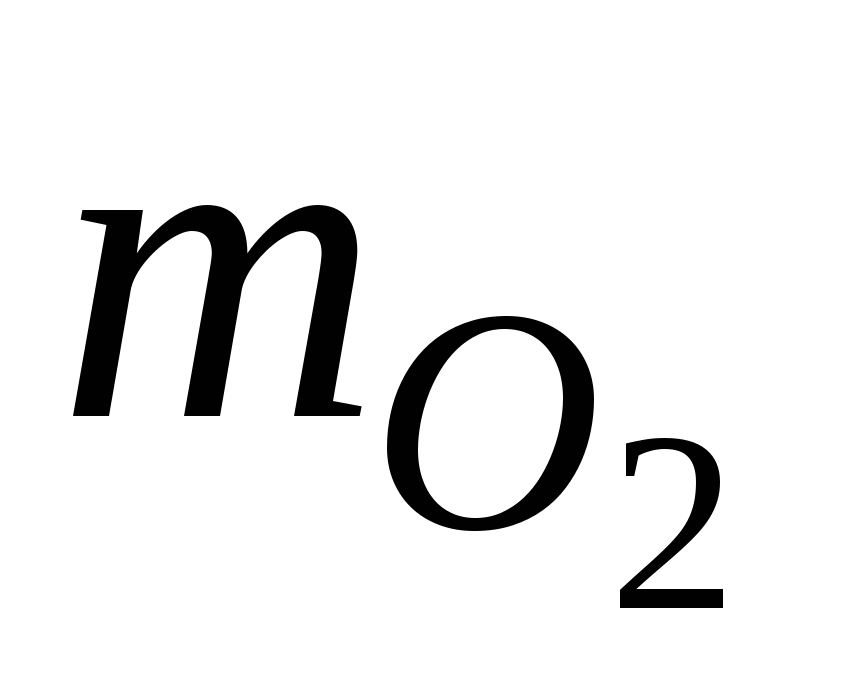 = 8 г. = 8 г.
|
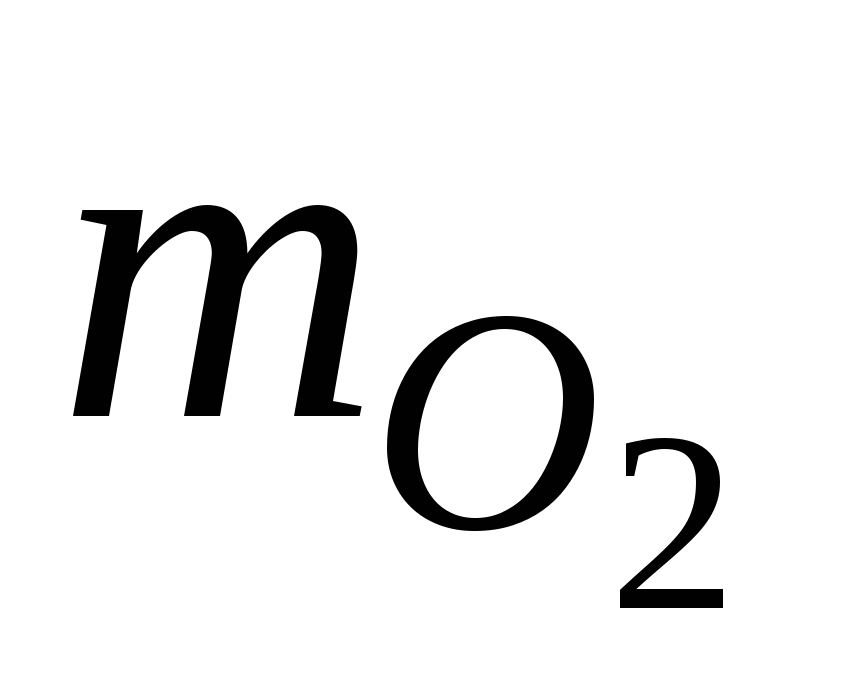 = ? = ?
|
Задача 3. Какой объем занимает при н.у. 5,5 г углекислого газа?
-
Дано:
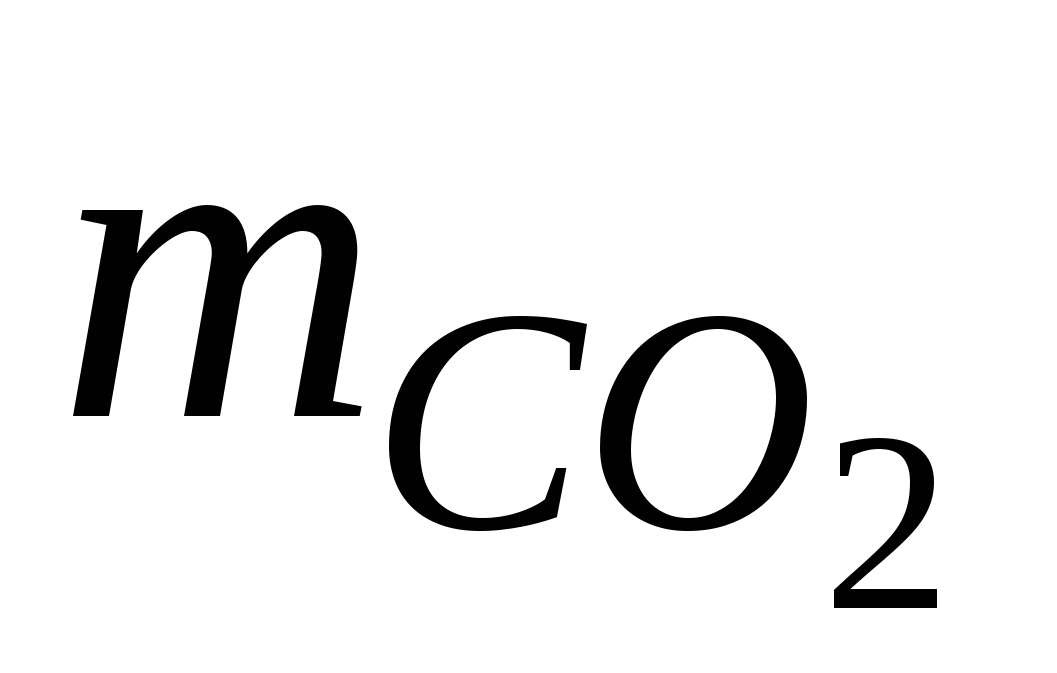 = 5,5 г = 5,5 г
|
|
Решение:
1. 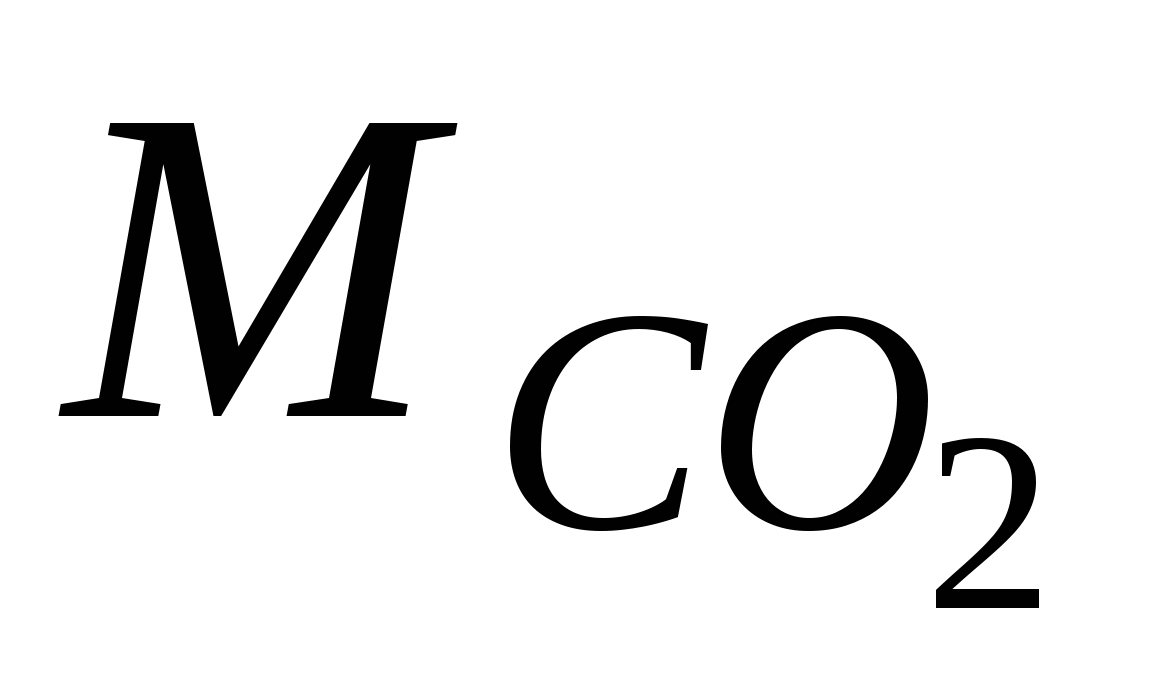 = 12 + 16 · 2 = 44 г/моль = 12 + 16 · 2 = 44 г/моль
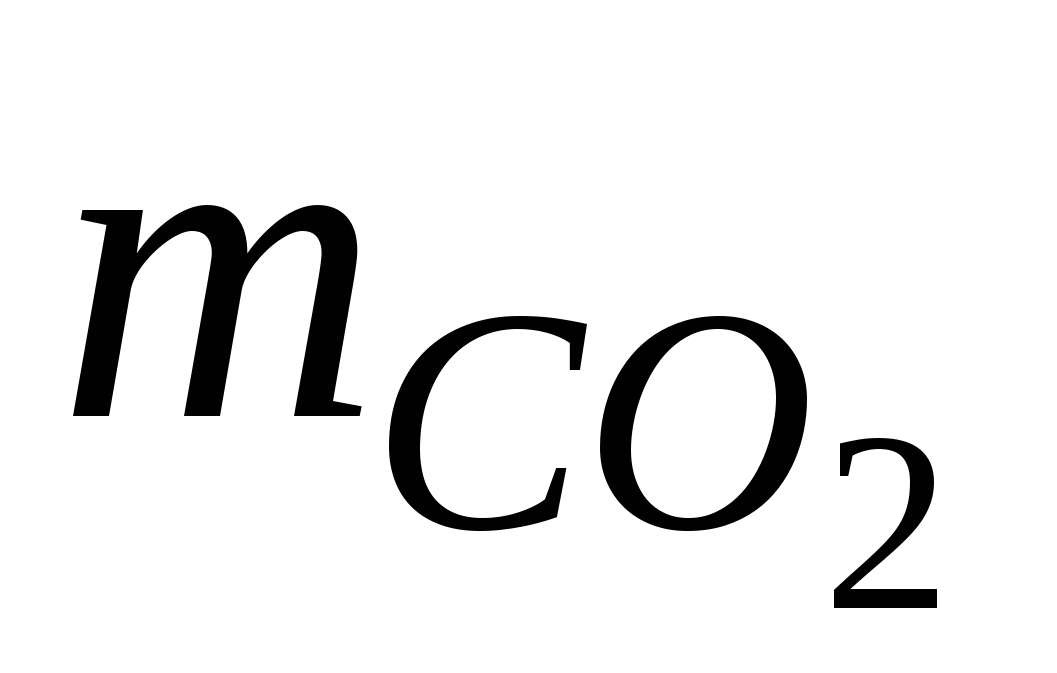 = 44 г = 44 г
2. 44 г СО2 – 22,4 л
5,5 г СО2 – х л

Ответ:  = 2,8 л. = 2,8 л.
|
 = ? = ?
|
Задача 4. Сколько литров кислорода, взятого при н.у., расходуется при сжигании алюминия массой 9 г?
-
Дано:
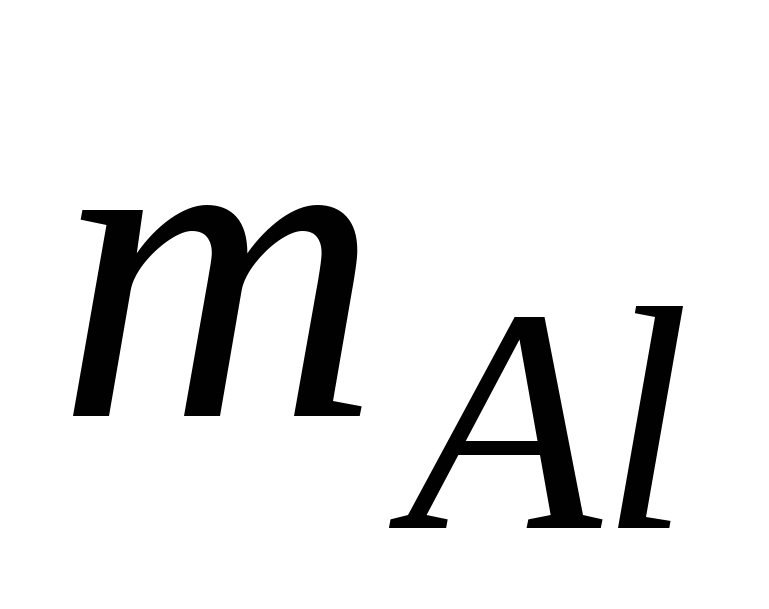 = 9 г = 9 г
|
|
Решение:

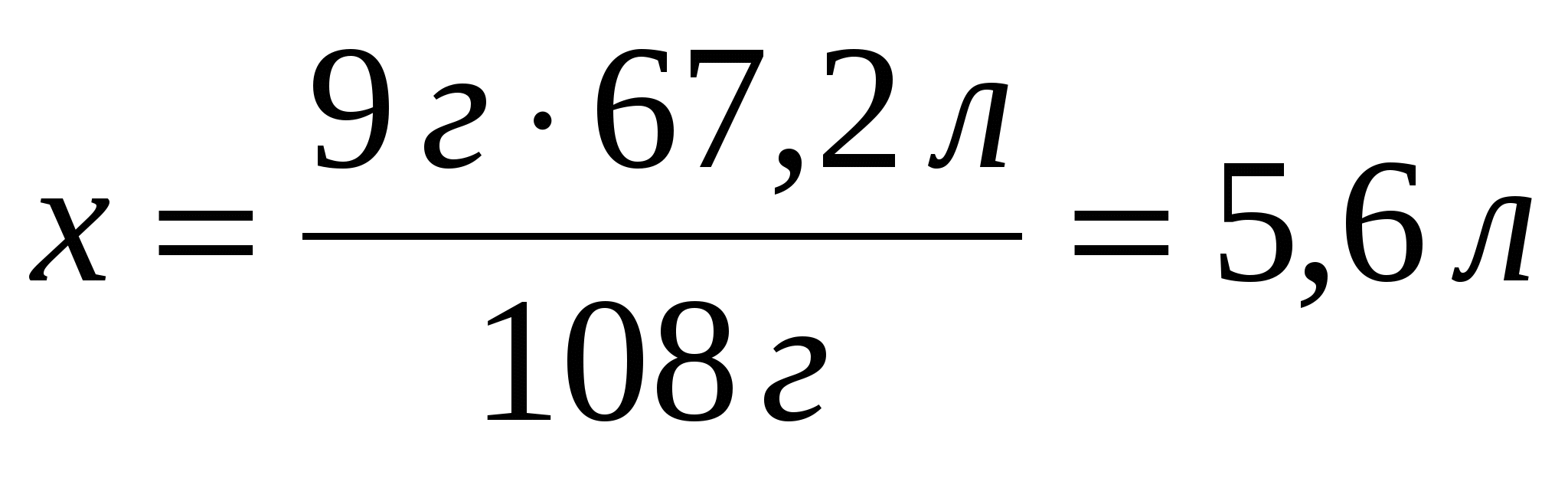
Ответ: 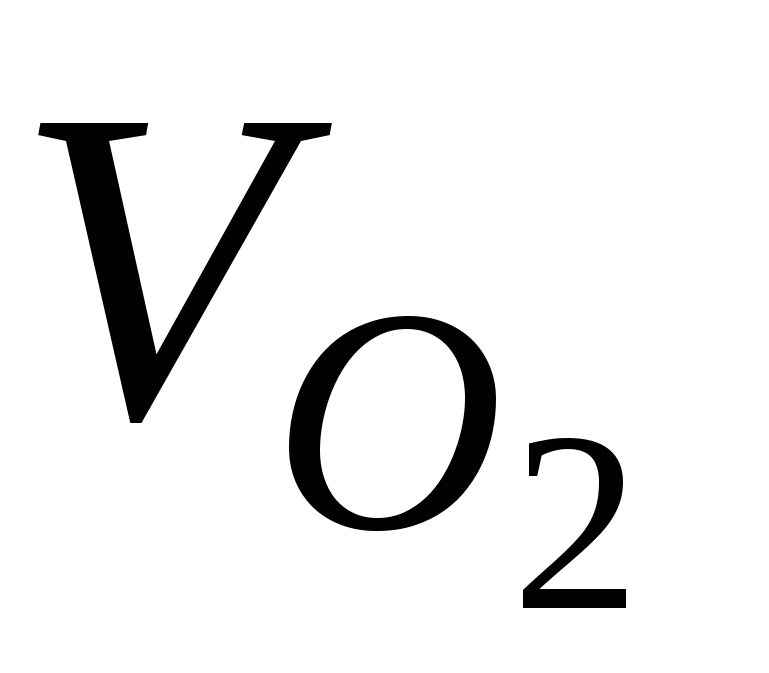 = 5,6 л. = 5,6 л.
|
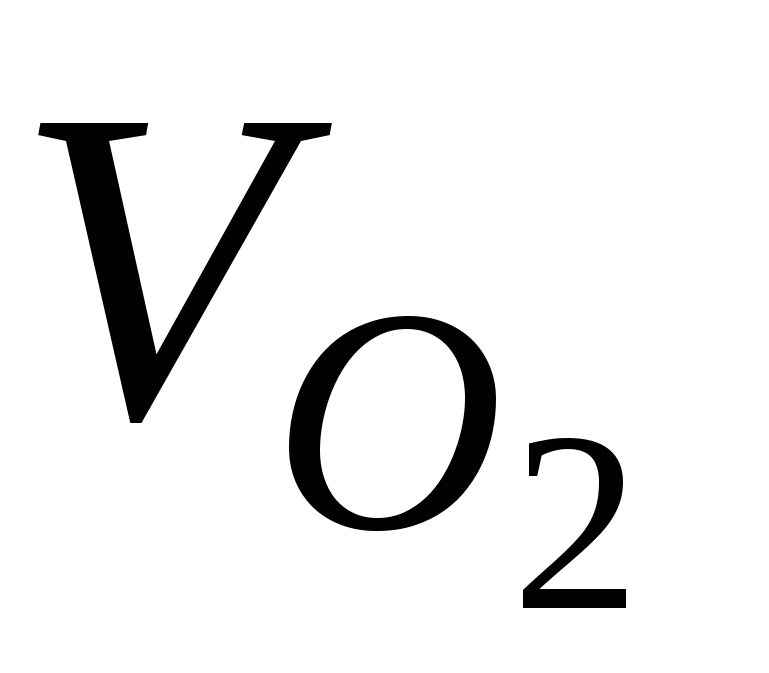 = ? = ?
|
Задача 5. Сколько граммов гидроксида натрия требуется для превращения 16 г сульфата меди (2) в гидроксид меди (2)?
-
Дано:
 = 16 г = 16 г
|
|
Решение:
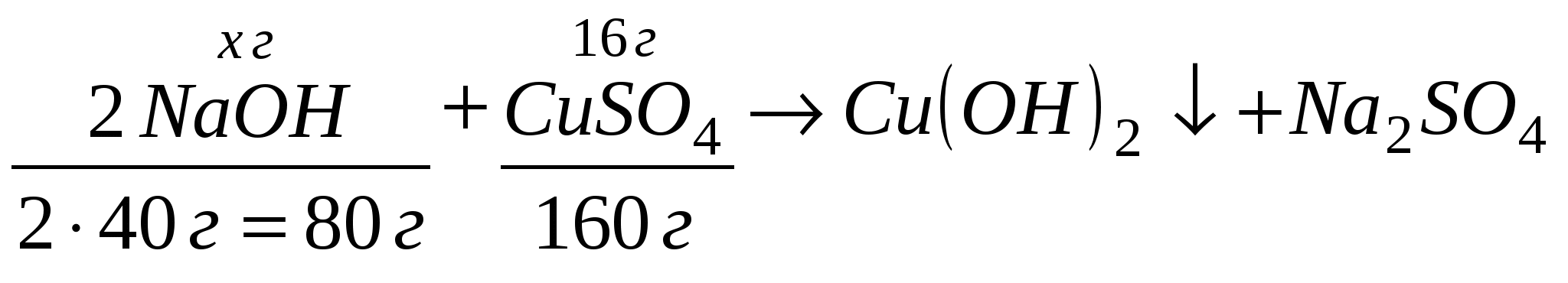

Ответ: 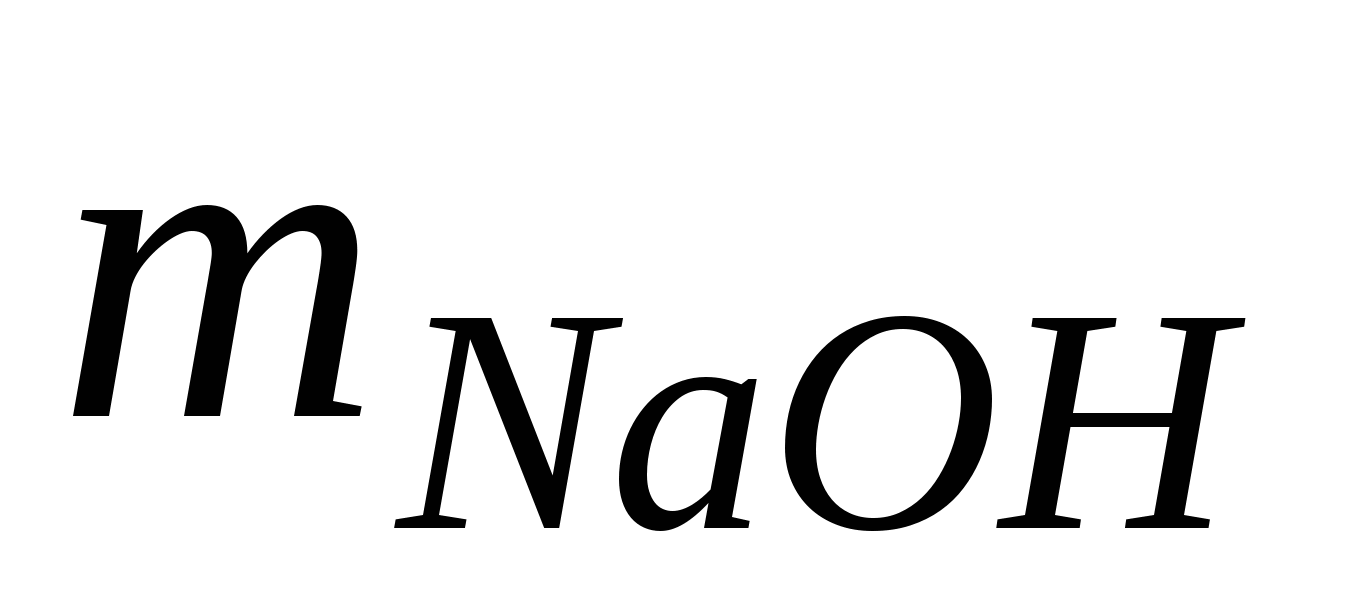 = 8 (г) = 8 (г)
|
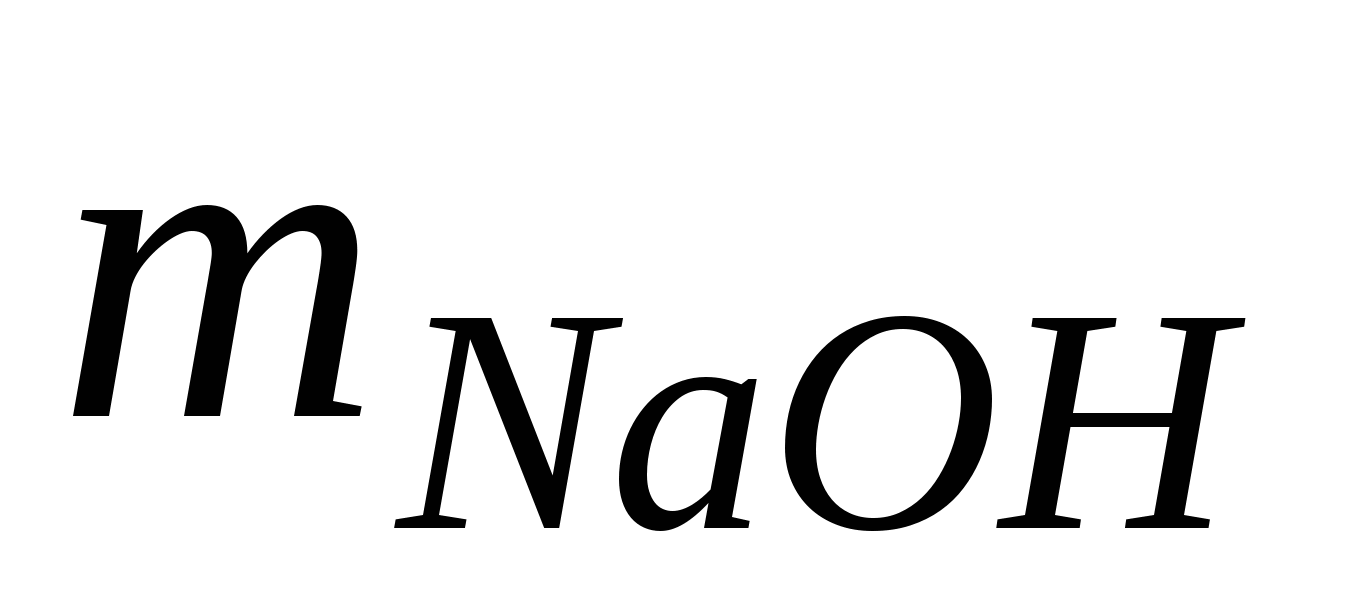 = ? = ?
|
Задача 6. К раствору, содержащему 5,5 г хлорида кальция, добавили раствор, содержащий 3,18 г карбоната натрия. Найдите массу выделившегося осадка.
-
Дано:
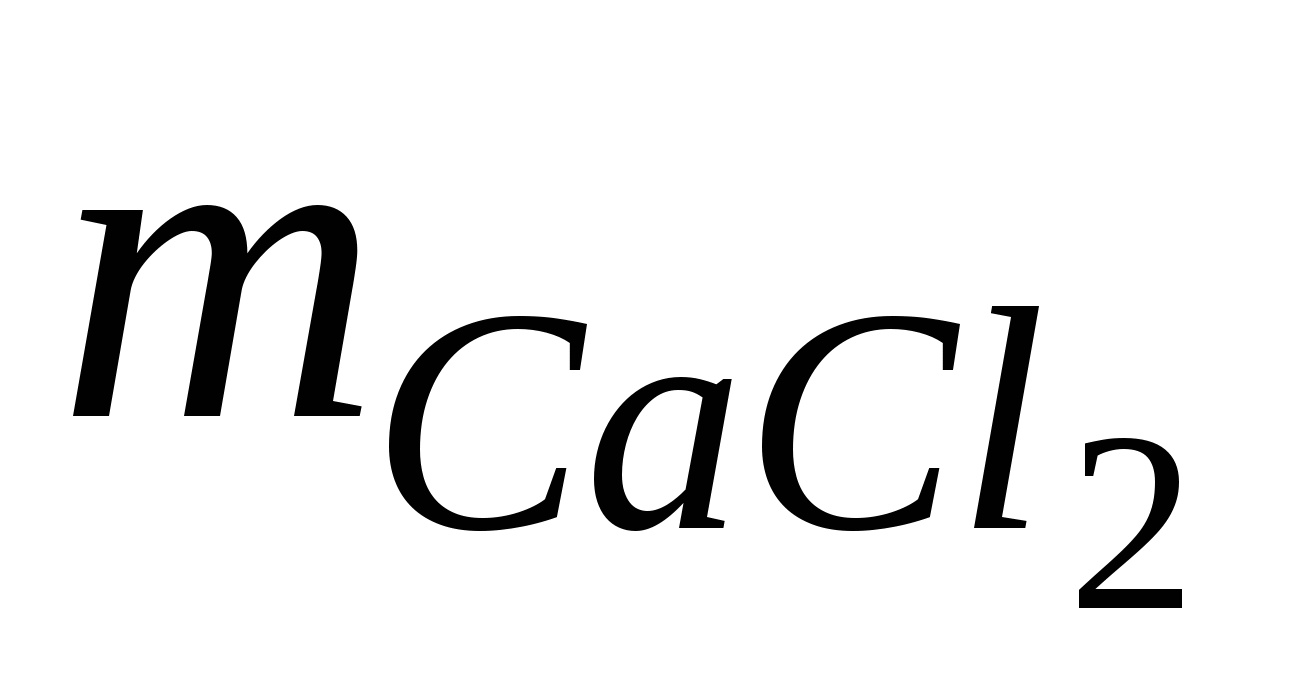 = 5,5 г = 5,5 г
 = 3,18 г = 3,18 г
|
|
Решение:


в избытке CaCl2. Расчет продукта реакции проводим по веществу, взятому в недостатке

Ответ: 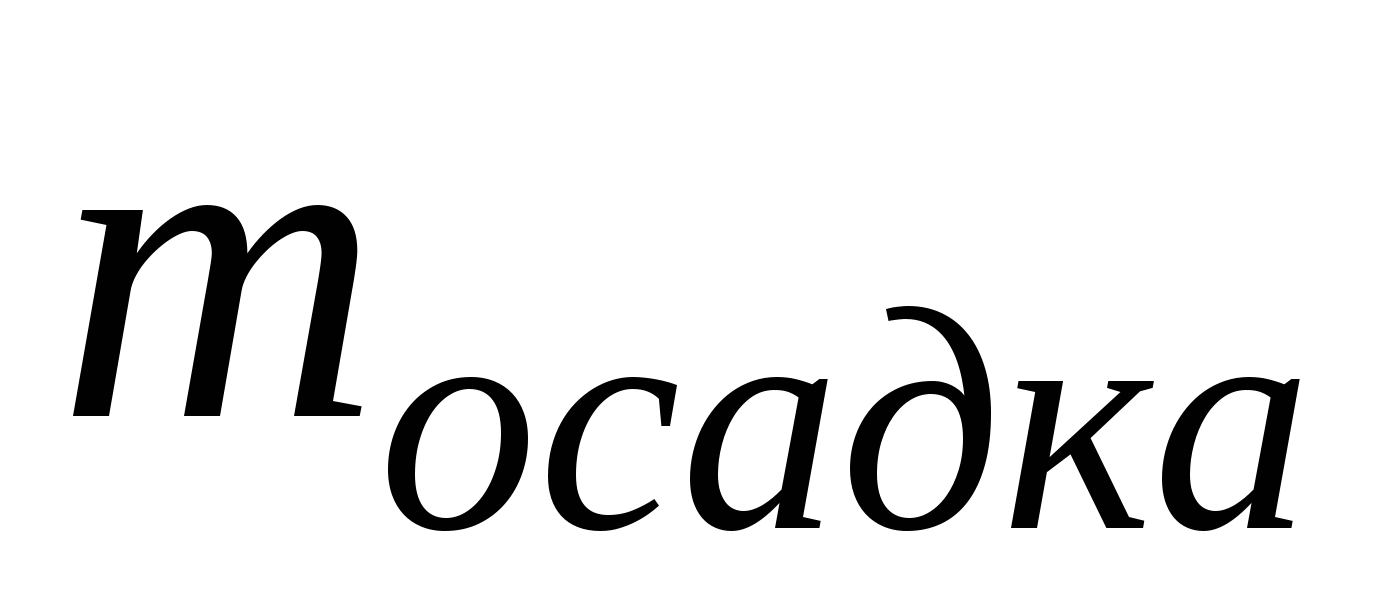 = 3 (г) = 3 (г)
|
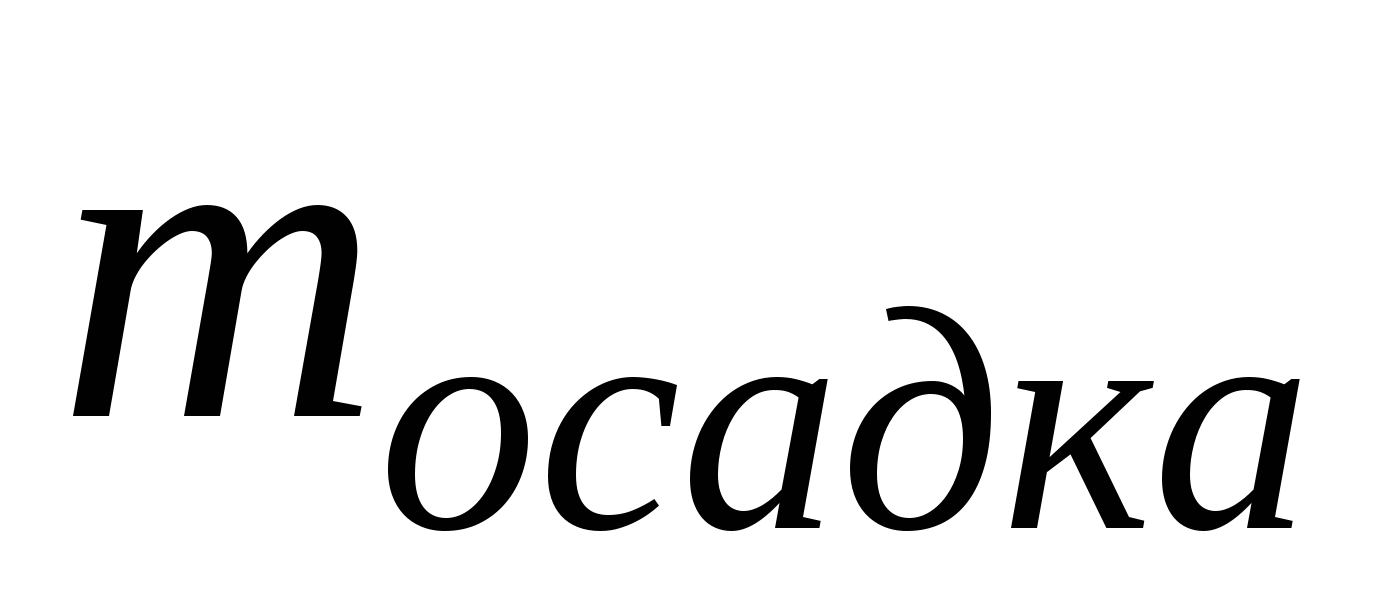 = ? = ?
|
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ТЕМЕ
«РАСЧЕТЫ ПО ФОРМУЛАМ И УРАВНЕНИЯМ»
Вариант 1.
Сколько меди содержится в 27 г хлорида меди?
Какой объем занимает при н.у. 2,2 г СО2?
Сколько литров водорода выделится при взаимодействии 13 г цинка с соляной кислотой?
Вариант 2.
Сколько азота содержится в 17 г нитрата натрия?
Какой объем занимают при н.у. 7 г азота?
Сколько граммов Fe2O3 образуется при окислении 8 г железа?
Вариант 3.
Сколько фосфора содержится в 8,2 г фосфата натрия?
Найдите массу 2,8 л SO2.
Сколько граммов Р2О5 образуется при сжигании 31 г фосфора?
Вариант 4.
Сколько граммов натрия содержится в 71 г сульфата натрия?
Найдите объем 8 г водорода.
Определите массу гидроксида железа (2), образовавшегося при взаимодействии FeCl2 с 24 г КОН.
|
|
|
 Скачать 1.45 Mb.
Скачать 1.45 Mb.