конспект лекций по физхимии. Конспект лекций по дисциплине Химия тема 1 основые понятия и законы химии. Основные законы химии. Закон сохранение массы
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
ТЕМА 18: АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. Нитросоединения. Нитросоединениями называют органические вещества, содержащие одну или несколько нитрогрупп (– NO2). Получение нитросоединений. Нитросоединения получают при нитровании органических веществ в присутствии или без участия серной кислоты. СН4 + HNO3 → CH3NO2 + H2O Химические свойства. При восстановлении нитросоединений образуются первичные амины. CH3NO2 + 3H2 → CH3NH2 + 2H2O АМИНЫ• Аминами называет органические производные аммиака, в котором один, два или все три атома водорода замещены на углеводородный радикал. Классификация и номенклатура аминов. 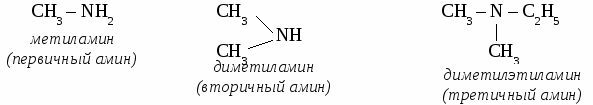 Физические свойства аминов. Метиламин, диметиламин, триметиламин и этиламин - газообразные вещества. Следующие представители гомологического ряда - жидкости, а высшие амины - твердые вещества. Газообразные и жидкие амины обладают запахом, напоминающим запах аммиака. Химические свойства аминов.
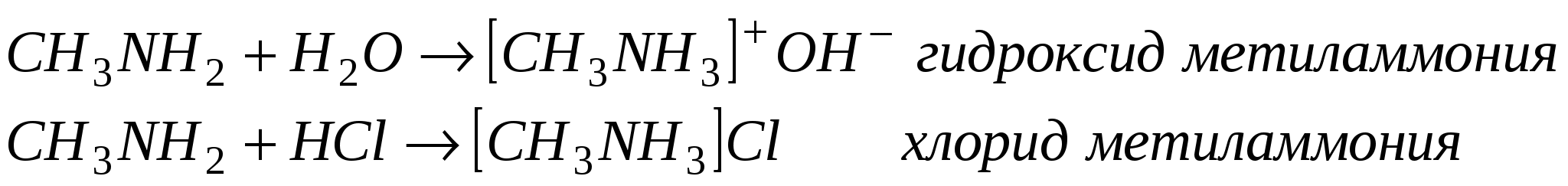
Получение аминов.
C2H5NO2 + 3H2 → C2H5NH2 + 2H2O
Применение аминов. Амины широко применяются в органическом синтезе. Они служат промежуточными продуктами синтеза лекарственных средств, синтетических волокон, пластмасс, стимуляторов роста растений. Упражнение. Составьте уравнения реакций по схеме:  Задача. При сгорании 3,75 г вещества образовалось 5,5 г СО2 и 4,5 г воды, а также 1,75 г азота. Плотность по воздуху 2,07. Определите молекулярную формулу вещества. АНИЛИН. Строение молекулы.  Физические свойства. Маслянистая жидкость, бесцветная, но быстро темнеющая на воздухе, в воде малорастворим, ядовит. Химические свойства. 1. Основные свойства. C6H5NH2 + H2O → [C6H5NH3]OH гидроксид фениламмония C6H5NH2 + HCl → [C6H5NH3]Cl хлорид фениламмония 2. Реакция замещения. 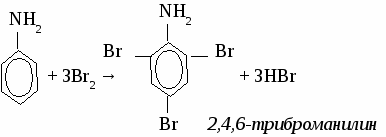 3. Горение. 4C6H5NH2 + 31О2 → 24СО2 + 14H2O + 2N2 Получение анилина. 1. Реакция Зинина. 2. Реакция Зайцева. Анилин используется для получения лекарств, красителей, взрывчатых веществ. ТЕМА 20 АМИНОКИСЛОТЫ. Аминокислотами называют органические соединения, а молекулах которых содержатся карбоксильная группа ( – СООH) и аминогруппа (– NH2) Строение и номенклатура аминокислот. 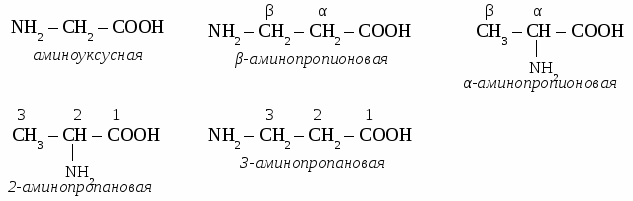 Физические свойства. Аминокислоты представляет собой белые, кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом. Химические свойства. 1. Амфотерные свойства аминокислот. NH2 – CH2 – COOH + NaOH → NH2 – CH2 – COONa + H2O NH2 – CH2 – COOH + HCl → [NH2 – CH2 – COOH]+Cl-
NH2 – CH2 – COOH + C2H5OH → NH2 – CH2 – CO – O – C2H5 + H2O
 Получение аминокислот. 1. Взаимодействие галогенпроизводных карбоновых кислот с аммиаком. Cl – CH2 – COOH + NH3 → NH2 – CH2 – COOH + HCl 2. Гидролиз белков. Применение аминокислот. Аминокислоты и их производные используют в качестве лекарств. Синтетические аминокислоты - сырье для производства полиамидных синтетических волокон и изделий из этих полимеров. БЕЛКИ. Белками называют природные полимеры, состоящие из большого числа остатков α-аминокислот, связанных между собой пептидными связями. Строение белка. Первичная структура - это последовательность аминокислот в полипептидной цепи. Вторичная структура - образование опирали. Третичная структура - конфигурация, которую приобретает в пространстве свернутая в спираль молекула белка. Физические свойства белков. Молекулы фибриллярных белков вытянуты в длину, это основной строительный материал сухожилий, мускульных и покровных тканей. Такие белки в воде не растворимы. Глобулярные белки свернуты в клубочки. Глобулярные белки растворимы в воде либо в растворах кислот или оснований. Химические свойства белков. 1. Денатурация. При нагревании, под действием сильных кислот или оснований, солей тяжелых металлов происходит необратимое осаждение (свертывание) белков. 2. Гидролиз. Под действием ферментов, а также водных растворов кислот или щелочей происходит разрушение первичной структуры белка в результате гидролиза пептидных связей. Гидролиз приводит к образованию пептидов и аминокислот. 3. Качественные реакции белков. а) биуретовая реакция - при действии на белки раствора солей меди (2) в щелочной среде возникает фиолетовое окрашивание. б) ксантопротеиновая реакция - при действии на белки концентрированной азотной кислоты образуется желтая окраска. Биологическое значение белков.
ИТОГОВЫЙ ТЕСТ ПО ОРГАНИЧЕСКОЙ ХИМИИ. Вариант 1. 1. Функциональной группой фенолов является: 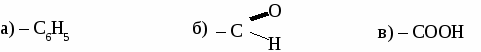 2. Общая формула предельного одноатомного спирта: а) СnH2n+2 , в) СnH2n+1OH б) CnHn-6 г) СnH2nO. 3.Основными реакциями, характерными для альдегидов являются: а) замещение альдегидной группы; б) окисление альдегидной группы в) присоединение по альдегидной группе; 4. Какая из реакций невозможна для карбоновых кислот? а) СН3СООН + Ag в) СН3СООН + Сu(ОН)2→ б)СН3СООН + Ag2О → г) СН3СООН + СН3ОН → 5. Качественная реакция на глицерин: а) появление осадка серебра, б) обесцвечивание бромной воды, в) образование глицерата меди (II) ярко-синего цвета, 6. Сложный эфир глицерина и олеиновой кислоты относится к: а) мылам в) синтетическим моющим средствам б) твердым жирам; г) жидким жирам (маслам); 7. Глюкоза реагирует со следующим веществом: а) СаСО3; б) NaOH в) Сu(ОН)2 8. Фенол проявляет свойства: а) оксидов; б) слабых оснований; в) слабых кислот 9. К альдегидам относится: а) этанол в) глицерин б) метаналь г) фенол 10 .Соединение, имеющее структурную формулу 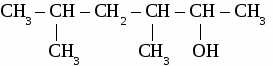 имеет название: а) 2,5-диметилгептанол-2; в) 3,5-диметилгексанол-2 б) 2,4-диметилгексанол-5; г) 2,4-диметилгексаналь 11. В результате реакции этерификации образуется: а) простой эфир в) спирт б) сложный эфир г) кислота 12. Формула пропановой кислоты: а) СН3 – СООН в) С3Н7 – СООН б) С2Н5 – СООН г) С2Н5 – СОН 13. Предельные одноатомные спирты являются изомерами: а) альдегидов в) простых эфиров б) кетонов г) сложных эфиров Вариант 2. 1.Функциональной группой альдегидов является: 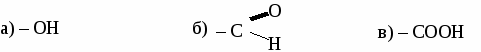 2. К многоатомным спиртам относится а) С6Н5ОН в) C2H5CHO б) CH2OH- CH2OH г) CH2COCH3 3. Для альдегидов характерна изомерия: а) цис- , транс-изомерия; б) изомерия углеродного скелета в) изомерия положения функциональной группы; 4. Какая из реакций невозможна для карбоновых кислот? а) НСООН + NaOH → в) НСООН + Cu → б) НСООН + СаСО3 → г) НСООН + СН3ОН → 5. Сложные эфиры образуется в результате реакции: а) этерификации б) гидролиза; в) гидратации; 6. Глицерин не реагирует с: а) Na; б) НNO3 в) СО2 7. Какое из веществ является реактивом на фенол? а) I2 (раствор); в) Ag2O (аммиачный раствор); б) FeCl3 г) Cu(OH)2; 8. Соединение, имеющее структурную формулу имеет название: а) 2,3-диметилпентанол-1; в) 2,3-диметилбутаналь б) 2,3-диметилпентаналь; г) 3,4-диметилпентаналь 9. Жиры - это сложные эфиры: а) глицерина и минеральных кислот в) этанола и минеральных кислот б)этанола и карбоновых кислот г) глицерина и высших карбоновых кислот 10. Формула уксусной кислоты: а) СН3 – СООН в) С3Н7 – СООН б) С2Н5 – СООН г) С2Н5 – СОН 11. Мыло представляет собой: а) натриевую соль уксусной кислоты б) сложный эфир глицерина в) натриевую соль высшей карбоновой кислоты г) сложный эфир высшей карбоновой кислоты 12. Фруктоза -это: а) кетоноспирт; б) многоатомный спирт; в) альдегидоспирт 13. Формула формалина: а) C6H50H б) HCOOH в) НСОН; Вариант 3. 1. Функциональной группой карбоновых кислот является: 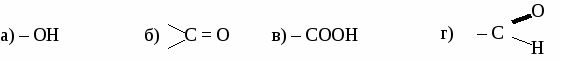 2. Изомерия положения функциональной группы характерна для: а) карбоновых кислот в) спиртов б) альдегидов г) сложных эфиров 3. Продукт взаимодействия этанола с уксусной кислотой относится к: а) углеводам б) простым эфирам; в) сложным эфирам; 4. С помощью какого реактива можно определить крахмал? а) I2 (раствор); в) Ag2O (аммиачный раствор); б) Cu(OH)2; г) FeCl3 5. К многоатомным спиртам относится: а) этанол в) фенол б) метаналь г) глицерин 6. Схема 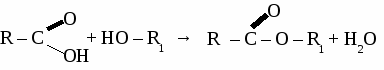 отражает суть реакции: отражает суть реакции:а) этерификации; б) дегидратации; в) гидролиза 7. Сложный эфир глицерина и стеариновой кислоты относится к: а) мылам в) синтетическим моющим средствам б) жидким жирам (маслам); г) твердым жирам; 8. С помощью каких веществ можно отличить глюкозу от фруктозы? a) Ag2O (аммиачный раствор); б) Сu(ОН)2 в) СН3СООН 9. Соединение, имеющее структурную формулу CH3-CH-CH2-CH-CH3 | | OH C2H5 а) 2-этилпентанол-5 в) 3-метилгексанол-5 б) 4-этилпентанол-2 г) 4-метилгексанол -2 10. Формула этаналя: а) С2Н5ОН в) С6Н5ОН б) СН3 – СООН г) СН3 – СОН 11. Сахароза -это: а) моносахарид; б) дисахарид в) полисахарид 12. Кетоны являются изомерами: а) альдегидов в) простых эфиров б) спиртов г) сложных эфиров 13. Уксусная кислота реагирует с: а) Na2CO3, в) НNO3 б) Cu, г) С2Н2. Вариант 4. 1. Функциональной группой спиртов является: a) –СООН б) – ОН в) – С6Н5 2. Карбоновые кислоты имеют следующие типы изомерии: а) изомерия углеродного скелета б) цис- , транс-изомерия; в) изомерия функциональной группы; 3. Из перечисленных соединений к сложным эфирам относится: 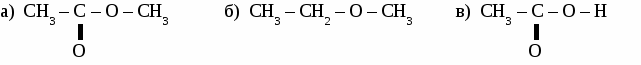 4. Продукт взаимодействия этанола с метанолом относится к: а) углеводам. б) сложным эфирам; в) простым эфирам; 5. В каком соединении атомы водорода не могут быть замещены на металл? а) пропанол; б) бутен-2; в) пропионовая кислота 6. Качественная реакция на альдегиды: а) появление осадка серебра б) обесцвечивание бромной воды, в) образование глицерата меди (II) ярко-синего цвета, 7. К многоатомным спиртам не относится: а) этиленгликоль; б) фенол; в) глицерин 8. Глюкоза-это: а) многоатомный спирт; б) аминоспирт; в) альдегидоспирт 9. Формула фенола: а) С6Н5ОН в) СН3 – СОН б) СН3 – СООН г) С2Н5ОН 10. Соединение, имеющее структурную формулу 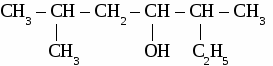 имеет название: а) 2,5-диметилгептанол-4; в) 3,5-диметилгексанол-4 б) 2-этил-5-метилгексанол-3; г) 2-этил-5-метилгексаналь 11. Какое из веществ является реактивом на глицерин? а) I2 (раствор); в) Ag2O (аммиачный раствор); б) Cu(OH)2; г) FeCl3 12. Какая из реакций невозможна: а) СH3COOH + Mg → в) СH3COOH + Na2O → б) СH3COOH + Ag → г) СH3COOH + СН3ОН → 13. Мыло представляет собой а) натриевую соль высшей карбоновой кислоты б) сложный эфир глицерина в) сложный эфир высшей карбоновой кислоты г) смесь высших карбоновых кислот ЛАБОРАТОРНАЯ РАБОТА № 7. ОБНАРУЖЕНИЕ УГЛЕРОДА И ВОДОРОДА В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ. ПОЛУЧЕНИЕ МЕТАНА. Оборудование: штатив с лапкой, пробирка с газоотводной трубкой, ложка для сжигания, спиртовка. Реактивы: мука, сахар, скипидар, оксид меди, известковая вода, уксуснокислый натрий, натронная известь. Опыт 1. Обнаружение углерода и водорода в органических веществах.
Опишите результаты опытов. 3. В пробирку насыпьте 2 г сахарного песка и 4 г оксида меди. Пробирку закройте пробкой с газоотводной трубкой, встряхните и закрепите в лапке штатива с небольшим наклоном в сторону пробки. Газоотводную трубку опустите в пробирку с известковой водой. Смесь сахара и оксида меди нагрейте. Опыт продолжайте до помутнения известковой воды. Опишите наблюдения, составьте уравнения реакций. Упражнения: 1. Какой газ вызвал помутнение известковой воды?
Опыт 2. Получение и свойства метана. В пробирку насыпьте 2-3 г уксуснокислого натрия и в три раза большее количество натронной извести (смесь гидроксида натрия и гашеной извести). Пробирку закройте пробкой с газоотводной трубкой, смесь встряхните. Газоотводную трубку опустите в стакан, наполненный водой. Смесь нагрейте, выделяющийся газ соберите в пробирку, наполненную водой. Если газа набралось достаточное количество - подожгите его. Составьте уравнения реакций. ЛАБОРАТОРНАЯ РАБОТА № 8. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. Оборудование: штатив с лапкой, пробирка с газоотводной трубкой, спиртовка, штатив с пробирками. Реактивы: смесь этилового спирта с концентрированной серной кислотой, раствор перманганата калил, бромная вода, карбид кальция. Опыт 1. Получение этилена и изучение его свойств. В пробирку насыпьте 1-2 г кварцевого песка, налейте 2-3 мл смеси этилового спирта с серной кислотой. Смесь нагрейте до кипения. Выделяющийся этилен пропустите последовательно в пробирки с раствором перманганата калия и бромной водой. Затем поверните газоотводную трубку отверстием вверх и подожгите выделяющийся газ. Зарисуйте прибор для получения этилена, опишите результаты опытов, напишите уравнения реакций. Опыт 2. Получение ацетилена и изучение его свойств. В пробирку положите 2-3 небольших кусочка карбида кальция, добавьте 3-4 мл воды. Быстро закройте пробирку пробкой с газоотводной трубкой. Пропустите выделяющийся газ в раствор перманганата калия и в бромную воду. Затем поверните газоотводную трубку отверстием вверх и подожгите выделяющийся газ. Опишите результаты опытов, напишите уравнения реакций. ЛАБОРАТОРНАЯ РАБОТА № 9. СВОЙСТВА СПИРТОВ И АЛЬДЕГИДОВ. Оборудование: штатив с пробирками, зажим, водяная баня. Реактивы: глицерин, растворы сульфата меди, гидроксида натрия, дихромата калия, серной кислоты, формалина, медная спираль, этиловый спирт, аммиачный раствор оксида серебра. Опыт 1. Растворение глицерина в воде и взаимодействие его с гидроксидом меди.
Опишите наблюдения, составьте уравнения реакций. Опыт 2. Окисление спирта в альдегид. 1. Окисление этилового спирта дихроматом калия. В пробирку налейте последовательно по 1 мл растворы дихромата калия, серной кислоты и этилового спирта. Смесь нагрейте на водяной бане до изменения окраски. Опишите результаты опыта, составьте уравнение реакции. 2. Окисление этилового спирта оксидом меди. В пробирку налейте 0,5 мл этанола. Нагрейте в пламени спиртовки медную спираль до образования черного налета оксида меди. Спираль быстро опустите в пробирку со спиртом. Опыт повторите несколько раз. Опишите наблюдения, составьте уравнения реакций. Опыт 3. Окисление альдегида. 1. Окисление аммиачным раствором оксида серебра (реакция «серебряного зеркала»). В пробирку, вымытую щелочью, налейте 0,5 мл аммиачного раствора оксида серебра и такой же объем формалина. Смесь нагрейте на водяной бане. Опишите наблюдения, составьте уравнение реакции. 2. Окисление гидроксидом меди. К 0,5 мл раствора сульфата меди добавьте 1 мл раствора гидроксида натрия и 1 мл формалина. Смесь нагрейте на водяной бане. Опишите наблюдения, составьте уравнения реакций. ЛАБОРАТОРНАЯ РАБОТА № 10 КАРБОНОВЫЕ КИСЛОТЫ. МЫЛА. Оборудование: штатив с пробирками, водяная баня, зажим. Реактивы: уксусная кислота (2н), магний, мел, раствор гидроксида натрия, хлорида кальция, уксуснокислого свинца, концентрированные уксусная и серная кислоты, этанол, фенолфталеин, растворы мыла и соляной кислоты. Опыт 1. Свойства уксусной кислоты. Подействуйте раствором уксусной кислоты на порошок магния, кусочек мела и, в присутствии индикатора, на раствор гидроксида натрия. Опишите наблюдения, запишите уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме. Опыт 2. Получение уксусноэтилового эфира. Налейте в пробирку 0,5 мл концентрированной уксусной кислоты и такой же объем этанола. Добавьте 0,5 мл концентрированной серной кислоты и нагрейте эту смесь на водяной бане (2 мин.). Вылейте смесь в стакан с насыщенным раствором поваренной соли. Убедитесь по запаху в наличии эфира. Составьте уравнение реакции. Опыт 3. Свойства мыла. В четыре пробирки налейте по 2 мл раствора мыла. 3 первую пробирку добавьте раствор фенолфталеина, во вторую - раствор хлорида кальция, в третью - раствор соляной кислоты, в четвертую - раствор уксуснокислого свинца. Опишите наблюдения, составьте уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме. ЛАБОРАТОРНАЯ РАБОТА № 11. СВОЙСТВА УГЛЕВОДОВ. Оборудование: штатив с пробирками, водяная баня, воронка, зажим, прибор для получения газов, фильтровальная бумага. Реактивы: растворы глюкозы, сахарозы, сульфата меди, гидроксида натрия, раствор йода, известковое молоко, крахмал. Опыт 1. Взаимодействие глюкозы с гидроксидом меди. В пробирку налейте 0,5 мл раствора сульфата меди, добавьте 1 мл раствора гидроксида натрия. К полученной смеси добавьте 2 мл раствора глюкозы и нагрейте на водяной бане. Опишите наблюдения, напишите уравнения реакций. Опыт 2. Взаимодействие сахарозы с гидроксидом кальция. К 2 мл раствора сахарозы добавьте при встряхивании такой же объем предварительно взмученного известкового молока. Через 3-5 минут профильтруйте смесь. Фильтрат разлейте в две пробирки. В одну порцию фильтрата пропустите углекислый газ, а другую нагрейте на водяной бане. Опишите наблюдения, напишите уравнения реакций. Опыт 3. Приготовление крахмального клейстера. Йодная проба. 0,5 г крахмала размешайте в холодной воде, полученную смесь влейте в пробирку с горячей водой, прокипятите. В пробирку с небольшим количеством остывшего крахмального клейстера добавьте несколько капель йодной воды. Пробирку нагрейте до исчезновения окраски, затем охладите. Опишите наблюдения. ЛАБОРАТОРНАЯ РАБОТА № 12. СВОЙСТВА БЕЛКОВ. Оборудование: штатив с пробирками, спиртовка, тигельные щипцы. Водяная баня. Реактивы: водный раствор белка, концентрированная азотная кислота, растворы гидроксида натрия, аммиака, сульфата меди, нитки х/б, синтетические, шерстяные, пшеничная мука. Опыт 1. Денатурация белка. Нагрейте в пробирке небольшое количество раствора яичного белка. Опишите результаты опыта. Опыт 2. Качественные реакции белков. а) ксантопротеиновая реакция Налейте в пробирку 1 мл раствора белка, добавьте 0,5 мл конц. азотной кислоты, нагрейте на водяной бане. Охладите смесь и добавьте к ней раствор аммиака. Опишите результаты опыта. б) биуретовая реакция Налейте в пробирку 1 мл раствора белка, добавьте такой же объем раствора гидроксида натрия и 0,5 мл раствора сульфата меди. Нагрейте содержимое пробирки на водяной бане. Опишите результаты опыта. в) определение серы в белках Держа тигельными щипцами, сожгите в пламени спиртовки несколько хлопчато-бумажных, шерстяных и синтетических нитей. Но характерному запаху «жженого рога» или «паленого пера» определяют наличие белка в шерстяных нитках. Опыт 3. Определение наличия белка в пищевых продуктах. Насыпьте в пробирку около 0,5 г муки, добавьте 0,5 мл конц. азотной кислоты, смесь нагрейте на водяной, бане. Какие признаки указывают на присутствие белка в муке? Тематика рефератов (докладов) и индивидуальных проектов
|
