конспект лекций по физхимии. Конспект лекций по дисциплине Химия тема 1 основые понятия и законы химии. Основные законы химии. Закон сохранение массы
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
Классификация оксидов.1. Несолеобразующие оксиды. Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и поэтому солей не образуют. Например: CO; NO; N2O 2. Солеобразующие оксиды. 2.1 Основные оксиды. Это оксиды, которым в качестве гидроксидов соответствуют основания. Например: Na2O NaOH; CaO Ca(OH)2. Как правило, основные оксиды - это оксиды металлов, но есть исключения: ZnO; Al2O3. 2.2 Кислотные оксиды. Это оксиды, которым соответствуют кислоты. например: SO3 H2SO4; P2O5 H3PO4. Как правило, кислотные оксиды - это оксиды неметаллов или металлов в высокой степени окисления. 2.3 Амфотерные оксиды. Это оксиды, которым соответствуют амфотерные гидроксиды, например: ZnОZn(ОН)2; Al2O3 Al(OH)3. Номенклатура оксидов. СО - оксид углерода (2) СО2- оксид углерода (4) Химические свойства оксидов. 1. Химические свойства основных оксидов. а) с водой, если образуется растворимый гидроксид. Na2O + H2O 2NaOH б) с кислотами CaO + 2HCl CaCl2 + H2O в) с кислотными оксидами СаО + CO2 CaCO3 УПРАЖНЕНИЯ:
2. Химические свойства кислотных оксидов. а) с водой СО2 + Н2О Н2СО3 б) со щелочами CO2 + 2NaOH Na2CO3 + H2O в) с основными оксидами. СО2 + Na2ONa2CO3 УПРАЖНЕНИЯ:
3. Химические свойства амфотерных оксидов. а) с кислотами ZnO + 2НNO3 → Zn(NO3)2 + Н2О б) со щелочами ZnO + 2NaOH → Na2ZnO2 + H2O ОСНОВАНИЯ. Основания - это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп. Номенклатура оснований. КОН - гидроксид калия Ва(ОН)2 - гидроксид бария Fe(OH)2 - гидроксид железа (2) Fe(OH)3 - гидроксид железа (3) Классификация оснований. 1. Растворимые основания (щелочи). Например: КОН, Ва(ОН)2 2. Нерастворимые основания. Например: Cu(OH)2, Мn(ОН)2. Химические свойства щелочей. 1. Взаимодейсвие с кислотами. 2NaOН + H2SO4 Na2SO4 + 2H2O 2. Взаимодействие с кислотными оксидами. 2NaOН + СО2 Na2СО3 + H2O 3. Взаимодействие с растворами солей. 2NaOН + CuSO4 Cu(OH)2↓ + Na2SO4 Химические свойства нерастворимых оснований. 1. Взаимодействие с кислотами. Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O 2. Разложение нерастворимых оснований. Cu(OH)2 Взаимодействие амфотерных гидроксидов со щелочами. H2ZnO2 + 2NaOH → Na2ZnO2 + 2H2O Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] УПРАЖНЕНИЯ:
КИСЛОТЫ. Кислоты - это сложные вещества, состоящие из атомов водорода и кислотного остатка. Классификация кислот. 1. Кислородсодержащие. H2SO4 - серная, H2SO3 - сернистая, HNO3 - азотная, Н3РО4 - фосфорная, Н2СО3 - угольная, Н2SiО3 -кремниевая. 2. Бескислородные. HF -фтороводородная, HCl - соляная, НBr - бромоводородная, НI - иодоводородная, H2S - сероводородная. Химические свойства кислот. 1. Взаимодействие растворов кислот с металлами (металл должен находиться в ряду напряжений левее водорода). 2HCl + Zn → ZnCl2 + H2↑ 2. Взаимодействие с оксидами металлов. 2HCl + MgO → MgCl2 + H2O 3. Взаимодействие с основаниями. 3НCl + Fe(OH)3 → FeCl3 + 3H2О 4. Взаимодействие с солями (если в результате реакции образуется осадок или газ). 2НСl + MgCO3 → MgCl2 + C02↑ + H2О УПРАЖНЕНИЯ:
СОЛИ. Соли - это сложные вещества, состоящие из атомов металла и кислотных остатков. Классификация солей. 1. Средние (продукт полного замещения атомов водорода в кислоте на металл), например: Na2CO3 2. Кислые (продукт неполного замещения атомов водорода в кислоте на металл), например: NaHCO3 3. Основные (продукт неполного замещения гидроксогрупп в основании на кислотный остаток), например: ZnOHCl. Номенклатура солей. (таблица на доске) Химические свойства солей. 1. Взаимодействие с кислотами (если в результате реакции образуется осадок или газ). К2СО3 + 2НСl → 2KCl + CO2↑ + H2O 2. Взаимодействие со щелочами (если в результате реакции образуется осадок). FeСl3 + 3NaОН → Fe(ОН)3↓ + 3NaCl 3. Взаимодействие с металлами (металл должен находиться в ряду напряжений левее металла, образующего соль). CuSО4 + Zn → ZnSO4 + Сu 4. Взаимодействие с другими солями (если в результате реакции образуется осадок). Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3 УПРАЖНЕНИЯ:
Генетическая связь между классами неорганических соединений. Составить уравнения реакций по схеме C → CO2 → CaCO3 → CaCl2 → Ca(NO3)2 → CaCO3 C + O2 → CO2 CO2 + CaO → CaCO3 CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl↓ Ca(NO3)2 + Na2CO3 → CaCO3↓ + 2NaNO3 УПРАЖНЕНИЯ: 1. C → CO2 → MgCO3 → MgO → Mg(NO3)2 → Mg(OH)2 2. Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3 3. Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu(NO3)2 4. Na → NaOH → Na2CO3 → BaCO3 → BaCl2 5. Al → Al2O3 → Al(NO3)3 → Al(OH)3 → Al(SO4)3 ТЕМА 11: ГИДРОЛИЗ СОЛЕЙ. 1. Характер (реакция) среды. Если в растворе содержатся свободные иона водорода - среда кислотная. Если в растворе содержатся свободные гидроксогруппы - среда щелочная. 2. Один из способов получения солей. Любую соль можно представить как продукт взаимодействия основания с кислотой. Например: Cu(OH)2 + H2SO4 → CuSO4 + 2H2O Понятие гидролиза. Гидролизом называется обменное взаимодействие солей с водой. В гидролизе участвует только ион слабого электролита. Гидролиз идет в сторону образования слабого электролита и останавливается обычно на первой стадии. ПРИМЕРЫ: 1. Гидролиз соли, образованной сильным основанием и слабой кислотой. 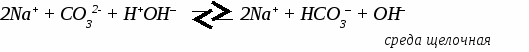 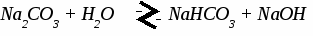 2. Гидролиз соли, образованной слабым основанием и сильной кислотой. 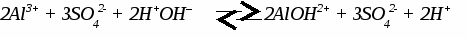 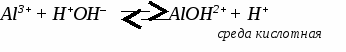  3. Гидролиз соли, образованной слабым основанием и слабой кислотой. Al2S3 + 6H2O → 2 Al(OH)3↓ + 3H2S↑ идет полный гидролиз 4. Соль, образованная сильным основанием и сильной кислотой. гидролиз не идет, среда нейтральная УПРАЖНЕНИЯ: Составьте уравнения реакций гидролиза следующих солей, укажите реакцию среды.
ТЕМА 13: КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКАЯ КИНЕТИКА. 1. Скорость химических реакций. Известно, что одни химические реакции протекают за малые доли секунда, другие же - за несколько минут, часов, суток (приведите примеры). Для того, чтобы охарактеризовать насколько быстро протекает химическая реакция, используют понятие «скорость химической реакции», которую обозначают латинской буквой υ. Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени. Формула для расчета скорости реакции имеет вид где С1и С2 - молярная концентрация реагирующих (и образующихся) веществ в момент времени t1 и t2 соответственно. Факторы, влияющие на скорость химической реакции. 1. Природа реагирующих веществ. Чем активнее исходные вещества, тем больше скорость реакции. 2. Концентрация реагирующих веществ. Увеличение концентрации веществ влечет за собой рост скорости реакции в соответствии с законом действующих масс. «Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам». 3. Температура. При увеличении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 - 4 раза. 4. Поверхность соприкосновения реагирующих веществ. При увеличении поверхности соприкосновения исходных веществ скорость реакции увеличивается. 5. Катализ. Катализатор - вещество, которое в незначительных количествах существенно увеличивает скорость химической реакции, не изменяя после ее окончания своего химического состава. 2. Обратимость химических реакций Химическое равновесие. Обратимыми называет химические реакции, которые протекают одновременно в двух противоположных направлениях - прямом и обратном. Например: Состояние обратимого химического процесса, при котором скорости прямой и обратной реакции равны, называют химическим равновесием. Химическое равновесие смещается по принципу Ле Шателье. «Если на систему, находящуюся в состоянии равновесия, оказывают внешнее воздействие (изменяют температуру, давление или концентрацию веществ), то в системе происходит смещение равновесия - возникает процесс, ослабляющий это воздействие». Рассмотрим это на примере реакции синтеза аммиака.  ТЕМА 14: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. Окислительно-восстановительными называют реакции, протекающие с изменением степеней окисления элементов, образующих вещества, участвующие в реакции. Основные понятия: 1. Степень окисления - условный заряд атомов в химическом соединении, вычисленный из предположения, что соединение состоит только из простых ионов. Для того чтобы рассчитать степень окисления, нужно знать, что: степень окисления кислорода почти всегда равна -2; степень окисления водорода почти всегда равна +1; степень окисления металлов всегда положительная; степень окисления свободных атомов и атомов в простых веществах всегда равна нулю; суммарная степень окисления атомов всех элементов в соединении обязательно равна нулю. УПРАЖНЕНИЯ: Рассчитайте степени окисления элементов в соединениях:
2.Элемент или вещество, отдающие электроны, называют восстановителями, сами они при этом окисляются. 3. Элемент или вещество, принимающие электроны, называют окислителями, сами они при этом восстанавливаются. Метод электронного баланса. 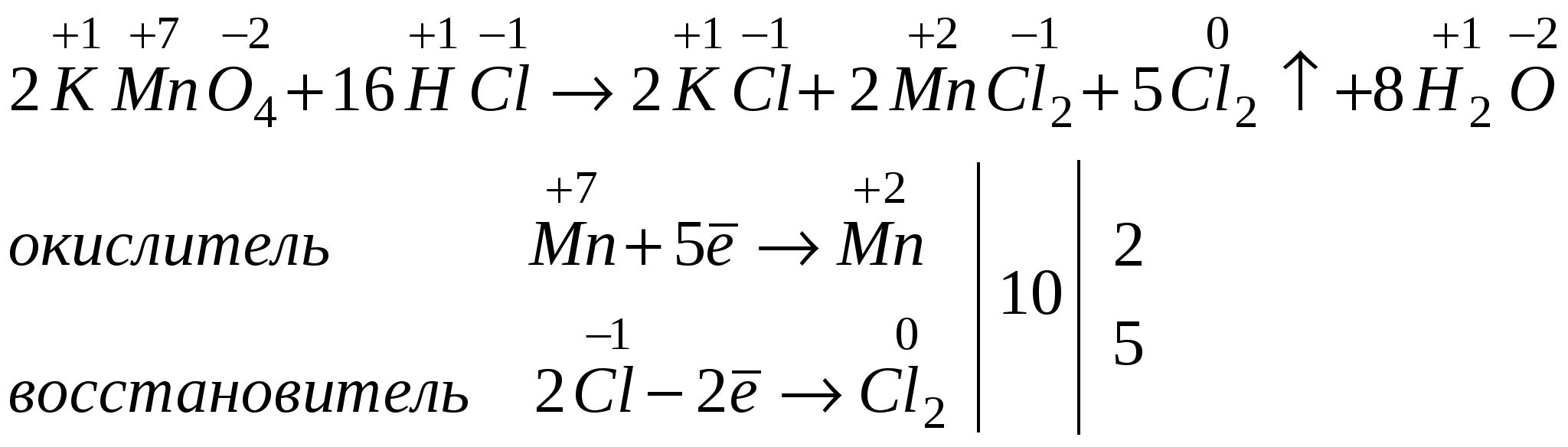 Взаимодействие азотной кислоты с металлами. При взаимодействии азотной кислоты с металлами водород, как правило, не выделяется. Кислота в зависимости от концентрации и активности металла может восстанавливаться до соединений: 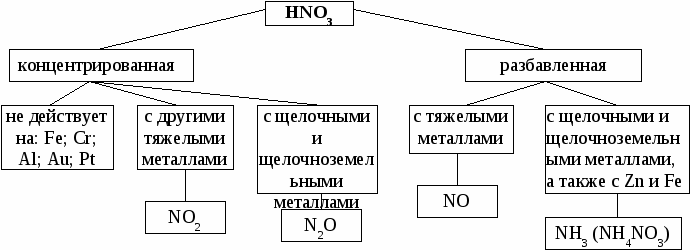 УПРАЖНЕНИЯ: Составьте уравнения реакции взаимодействия концентрированной и разбавленной азотной кислоты с медью и барием. Расставьте коэффициенты методом электронного баланса. САМОСТОЯТЕЛЬНАЯ РАБОТА. Окислительно-восстановительные реакции. Вариант 1. Расставьте коэффициенты, укажите окислитель и восстановитель: 1. CrCl3 + Br2 + KOH → K2CrO4 + KBr + KCl + H2O 2. K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + K2SO4 + S + H2O 3. S + KClO3 + H2O → Cl2 + K2SO4 + H2SO4 4. H2SO4 + NaCl + KMnO4 → MnSO4 + Cl2 + K2SO4 +Na2SO4 + H2O 5. Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O Вариант 2. Расставьте коэффициенты, укажите окислитель и восстановитель: 1. MnSO4 + KNO3 + Na2CO3 → CO2 + KNO2 + NaMnO4 + Na2SO4 2. KOH + MnO2 + KNO3 → K2MnO4 + H2O + KNO2 3. MnO2 + Cl2 + KOH → KCl + H2O + KMnO4 4. KCrO2 + PbO2 + KOH → K2CrO4 + K2PbO2 + H2O 5. H2SO4 + Zn + K2Cr2O7 → Cr2(SO4)3 + ZnSO4 + K2SO4 + H2O Вариант 3. Расставьте коэффициенты, укажите окислитель и восстановитель: 1. Na2SO3 + KOH + KMnO4 → Na2SO4 K2MnO4 + H2O 2. H2O + KMnO4 + Na2SO3 → KOH + Na2SO4 + MnO2 3. HCl + K2Cr2O7 → KCl + CrCl3 + Cl2 + H2O 4. KMnO4 + PH3 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O 5. KOH + CrCl3 + Br2 → KBr + K2CrO4 + KCl + H2O Вариант 4. Расставьте коэффициенты, укажите окислитель и восстановитель: 1. H2SO4 + K2Cr2O7 + KJ → K2SO4 +J2 + Cr2(SO4)3 + H2O 2. KBr + HCl + K2Cr2O7 → Br2 + CrCl3 + KCl + H2O 3. K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + K2SO4 + S + H2O 4. MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O 5. HCl + KMnO4 → Cl2 + MnCl2 + KCl + H2O Вариант 5. Расставьте коэффициенты, укажите окислитель и восстановитель: 1. S + KClO3 + H2O → Cl2 + K2SO4 + H2SO4 2. Cr2O3 + Br2 + NaOH → Na2CrO4 + NaBr + H2O 3. Mo + NaNO3 + NaOH → Na2MoO4 + NaNO2 + H2O 4. K2Cr2O7 + (NH4)2S + H2O → Cr(OH)3 + S + NH3 + KOH 5. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O Вариант 6. Расставьте коэффициенты, укажите окислитель и восстановитель: 1. H2SO4 + FeSO4 + KMnO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + H2O 2. Na2SO3 + KMnO4 H2SO4 → Na2SO4 + K2SO4 + MnSO4 + H2O 3. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O 4. NaOH + Cl2 + Cr2(SO4)3 → NaCl + Na2CrO4 + Na2SO4 + H2O 5. H2S + H2SO4 + K2Cr2O7 → K2SO4 +S + Cr2(SO4)3 + H2O |
