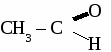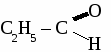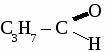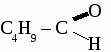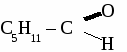конспект лекций по физхимии. Конспект лекций по дисциплине Химия тема 1 основые понятия и законы химии. Основные законы химии. Закон сохранение массы
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
ТЕМА 11: КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА. Предельные одноатомные спирты. Этиловый спирт. 1. Строение молекулы.  2. Физические свойства. Жидкость, бесцветная, прозрачная, с характерным запахом, смешивается с водой в любых соотношениях, обладает наркотическим действием. Температура кипения 78,4ºС. 3. Химические свойства. 3.1 горение С2Н5ОН + 3О2 → 2СО2 + 3Н2О 3.2 взаимодействие с металлическим натрием 2С2Н5ОН + 2Na → 2 С2Н5ОNa + 2H2 этилат натрия 3.3 взаимодействие с кислотами С2Н5ОН + HBr → С2Н5Br + H2O бромэтан 3.4дегидратация а) образование этилена б) образование диэтилового эфира 4. Получение этилового спирта.
С6Н12О6 → 2С2Н5ОН + 2СО2
4.3 получение синтетического этилового спирта С2Н4 + Н2О → С2Н5ОН t = 280º – 300ºC P = 7-8 МПа Катализатор Н3РО4 5. Применение этилового спирта. Для получения бутадиенового каучука, в медицине, в парфюмерии, в лакокрасочной промышленности, в авиации, для приготовления спиртных напитков, для производства уксусной кислоты. 6.Действие этилового спирта на организм. Борьба с алкоголизмом. Гомологический ряд предельных одноатомных спиртов. Одноатомные спирты - органические вещества, молекулы которых содержат одну гидроксильную группу, соединенную с углеводородным радикалом. R - ОН общая формула одноатомных спиртов.
Изомерия и номенклатура спиртов. Дляспиртов возможна два вида изомерии: изомерия положения гидроксильной группы и изомерия углеродного скелета. В соответствии с правилами номенклатуры ИЮПАК выбирают самую длинную цепь атомов углерода и нумеруют ее с того конца, к которому ближе гидроксильная группа. Окончанием -ОЛ и цифрой после названия указывают наличие гидроксильной группы. Упражнение. Составить формулы четырех изомеров пентанола и назвать их. 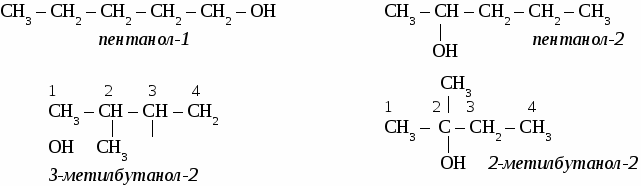 Химические свойства одноатомных спиртов. 1. взаимодействие с активными металлами 2R–OH + 2Na → 2R–ONa + H2↑ алкоголет натрия 2.взаимодействие с кислотами R–OH + HCl → R–Cl + H2O галогенпроизводные 3. взаимодействие с другими спиртами R1–OH + НО–R2 простой эфир Общие способы получения спиртов. 1.гидратация этиленовых углеводородов 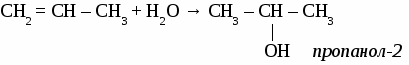 2. гидролиз галогенпроизводных СН3Cl + NaOH → CH3OH + NaCl Простые эфиры. Простые эфиры - органические вещества, в молекулах которых два углеводородных радикала соединены через атом кислорода. R1–O–R2 – общая формула простых эфиров Простые эфиры образуются при взаимодействии молекул одного и того же спирта или различных спиртов при нагревании в присутствии серной кислоты. Упражнение. Составьте уравнения реакций получения всех простых эфиров, образовавшихся при нагревании смеси метанола и этанола в присутствии серной кислоты, назовите их. Задача. При сгорании 3,45 г вещества образовалось 6,6 г СО2 и 4,05 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определить молекулярную формулу вещества. ОДНОАТОМНЫЕ СПИРТЫ. (самостоятельная работа) Вариант 1. 1. Составьте уравнения реакций, протекающих при нагревании смеси метанола и бутанола в присутствии серной кислоты. 2. Составьте формулы по названиям: а) 2,5-дихлорпентен-2 б) 2-метил-3-этилгексанол-2 в) 1,2-диметил-4-этиленбензол Вариант 2.
а) 2-метилпропанол-2 б) 2,4,5-триметилгоксанол-2 в) 3-этилбутанол-2 Вариант 3. 1. Составьте уравнения четырех реакций, протекающих при нагревании смеси пропанола и бутанола в присутствии серной кислоты. 2. Составьте уравнения реакций по схеме: 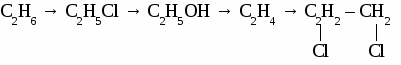 Вариант 4. 1. Составьте уравнения четырех реакций протекающих при нагревании смеси этанола и пентанола в присутствии серной кислоты.
СH4 → С2Н2 → С2Н4 → С2H5OH → С2H5 – O – СH3 Вариант 5. 1. Составьте уравнения четырех реакций, протекающих при нагревании смеси этанола и пропанола в присутствии серной кислоты. 2. Составьте формулы по названиям: а) 2-метил-4-этилгексанол-3 б)3,3-диметилпентанол-1 в) 2-метилбутанол-1 Вариант 6. 1. Составьте уравнения четырех реакции, протекающих при нагревании смеси бутанола и пентанола в присутствии серной кислоты. 2. Составьте формулы по названиям: а) 5-метил-3-этилпентанол-1 б)2,3-диметилбутадиен-1,3 в) гексанол-2 ТЕМА 12: МНОГОАТОМНЫЕ СПИРТЫ. 1. Отдельные представители. Номенклатура  2. Физические свойства этиленгликоля и глицерина. Этиленгликоль и глицерин бесцветные, прозрачные сиропообразные жидкости. Растворимы в воде, вкус сладкий. Этиленгликоль ядовит. 3. Химические свойства. Многоатомными спиртам называют производные предельных углеводородов, в молекулах которых содержатся две или более гидроксильные группы. Свойства многоатомных спиртов сходны со свойствами одноатомных. В реакцию может вступать одна или несколько гидроксильных групп. Многоатомные спирты реагируют с щелочными металлами с выделением водорода, вступают в реакции замещения с галогеноводородами.  Многоатомные спирты могут образовывать сложные эфиры по всем гидроксильным группам. 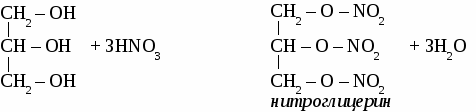 Качественная реакция на многоатомные спирты. Реактивом на многоатомные спирты является свежеосажденный гидроксид меди. Результат реакции - ярко-синее окрашивание раствора. 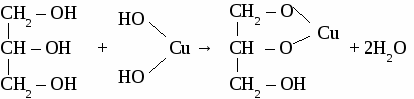 4. Получение многоатомных спиртов. Общим способом получения многоатомные спиртов является гидролиз полигалогенпроизводных предельныхуглеводородов. 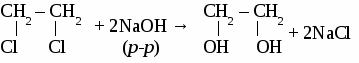 Этиленгликоль образуется по реакции Вагнера окислением этилена водным раствором перманганата калия. 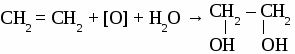 Глицерин в промышленности получают из пропена или гидролизом жиров. 5. Применение. Этиленгликоль применяют для приготовления антифризов - незамерзающих жидкостей, для синтеза пластмасс, синтетического волокна лавсан, для изготовления взрывчатых веществ. Глицерин используют для производства взрывчатых веществ, в парфюмерии для изготовления мазей и кремов, вкожевенном производстве. ФЕНОЛ. Фенолами называют производные ароматических углеводородов, в которых один или несколько атомов водорода бензольного кольца замещены на гидроксильные группы.
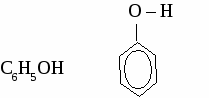 2. Физические свойства. Фенол - твердое кристаллическое вещество, в результате окисления на воздухе имеет красный цвет, плохо растворяется в холодной воде, лучше в горячей. Ядовит. 3. Химические свойства. 3.1 Кислотные свойства. 2С6Н5ОН + 2Na → 2С6Н5ОNa + H2↑ 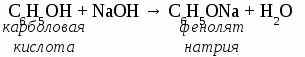 3.2 Реакции электрофильного замещения. 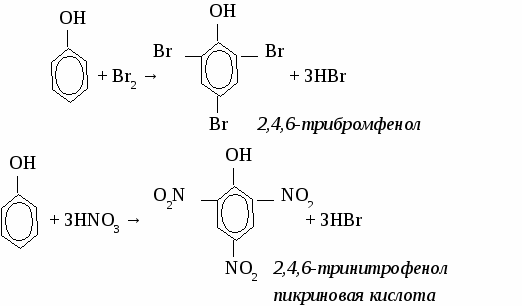 3.3 Качественная реакция на фенол. Реактивом на фенол является хлорид железа (3). Результат реакции -фиолетовое окрашивание. 4. Получение фенола. 4.1 Большое количество фенола выделяют из каменноугольной смолы. 4.2 Кумольный способ. 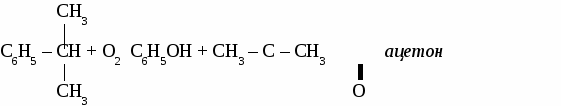 4.3 Получение из бензола. С6Н6 + Сl2 С6Н5Сl + NaOH 5. Применение фенола. Фенол используют для получения фенолоформальдегидных смол, пластмасс, синтетических волокон, красителей, лекарственныхи взрывчатых веществ. Упражнение. Составьте уравнения реакций посхеме СH4 → С2Н2 → С6Н6 → С6H5Cl → С6H5OH Задача. Сколько мл азотной кислоты (плотность 1,4) с массовой долей НNO3 68 %вступит в реакцию с фенолом для получения 22,9 г 2,4,6-тринитрофенола? МНОГОАТОМНЫЕ СПИРТЫ. (самостоятельная работа) Вариант 1.
а) 3-метилбутантриол-1,2,4. б) 2,3-диэтилпентандиол-1,5
3. Из 156 кг бензола получили 200 кг хлорбензола. Вычислить выход хлорбензола в %от теоретически возможного. 4. Составьте уравнения реакций по схеме: С4H10 → С4Н8 → С4Н9Cl → С4H9OH Вариант 2. 1. Составьте формулы по названиям: а) 2-метил-4-этилгександиол-1,5 б) 3-метилпентантриол-1,3,5 2. Составьте уравнения реакций получения этанола из карбида кальция.
С5H12 → С5Н10 → С5Н11Cl → С5H11OH Вариант 3. 1. Составьте уравнения реакций получения гликолята меди исходя из этана. 2. Составьте формулы по названиям: а) 3-этилгенсандиол-1,5 б) 2,3-диметилпентанол-3
С3Н8 → С3Н6 → С3Н7ОН → С3H7 – O – СH3 Вариант 4.
а) 2-метилбутандиол-1,4 б) 2-метил-4,4-диэтилгексанол-2 3. При хлорировании бензола получили 18 кг хлорбензола, что составляет 80 %от теоретически возможного выхода. Сколько кг бензола ввели в реакцию с хлором? 4. Составьте уравнения реакций по схеме: С2Н6 → С2Н4 → С2H5OH → С2H5 – O – С4H9 ТЕМА 13: АЛЬДЕГИДЫ. Альдегидами называют органические соединения, содержащие альдегидную группу 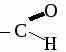 связанную о углеводородным радикалом. связанную о углеводородным радикалом.Гомологический ряд альдегидов.
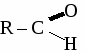 общая формула альдегидов общая формула альдегидов1. Физические свойства. Муравьиный альдегид - газ, остальные низшие альдегида - жидкости с резким запахом хорошо растворимые в воде. 2.Химические свойства. 2.1. Гидрирование 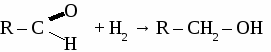 2.2 Реакции окисления: а) сильными окислителями 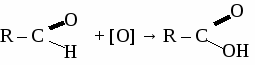 б) реакция "серебряного зеркала" 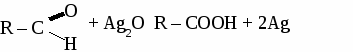 в) окисление гидроксидом меди 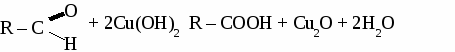 Получение и применение муравьиного альдегида.
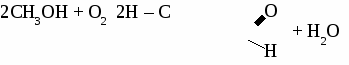
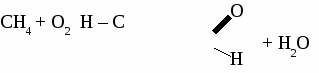 Формальдегид используется для получения фенолформальдегидных и карбамидных смол и пластмасс на их основе, для получения лекарств, для дубления кожи, для хранения биологических препаратов. Получение и применение уксусного альдегида. 1. В лаборатории а) окисление этанола дихроматом калия 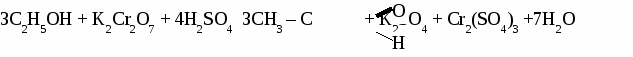 б)окисление этанола оксидом меди 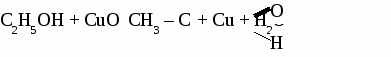 2. В промышленности. а) реакция Кучерова 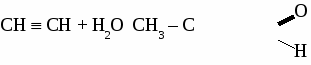 б) окисление этилена 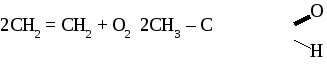 Ацетальдегид используется для получения уксусной кислоты, этанола, в органическом синтезе. КЕТОНЫ. Кетонами называют органические вещества, в молекулах которых карбонильная группа ( 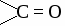 )связана с двумя углеводородными радикалами. )связана с двумя углеводородными радикалами.Изомерия и номенклатура кетонов. 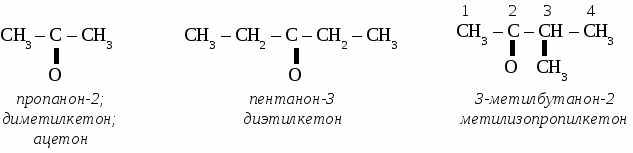 Применение кетонов. Кетоны широко применяются в качестве растворителей и сырья для производства ядохимикатов, лекарственных препаратов, полимеров. Упражнение. Составьте уравнения реакций по схеме: 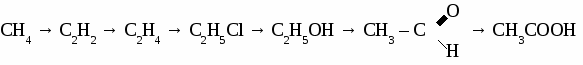 Задача №1. Какой объем кислорода необходим для окисления метанола, если при этом получили 200 г 40 %раствора формальдегида? Задача №2. Вычислить массу этанола, необходимую для получения 400 г 15 % раствора уксусного альдегида. Задача №3. При гидролизе хлорбензола получили 316,8 кг фенола, что составляет 80 %от теоретически возможного выхода. Сколько кг хлорбензола ввели в реакцию гидролиза? АЛЬДЕГИДЫ. (самостоятельная работа) Вариант 1. 1. Составьте уравнения реакций по схеме: С2Н6 → С2Н4 → С2H5Cl → С2H5OH → С2H5 – O – СH3
Вариант 2. 1. Составьте уравнения реакций по схеме: 
4. Полечить этиловый спирт исходя из этана. Вариант 3.
С3Н8 → С3H7Cl → С3H7OH → С3H7 – O – С2H5
Вариант 4. 1. Составьте уравнения реакций по схеме: 
Вариант 5.
С4Н10 → С4H9Cl → С4H9OH → С4H9 – O – СH3
Вариант 6. 1. Составьте уравнения реакций по схеме: 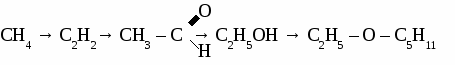
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||