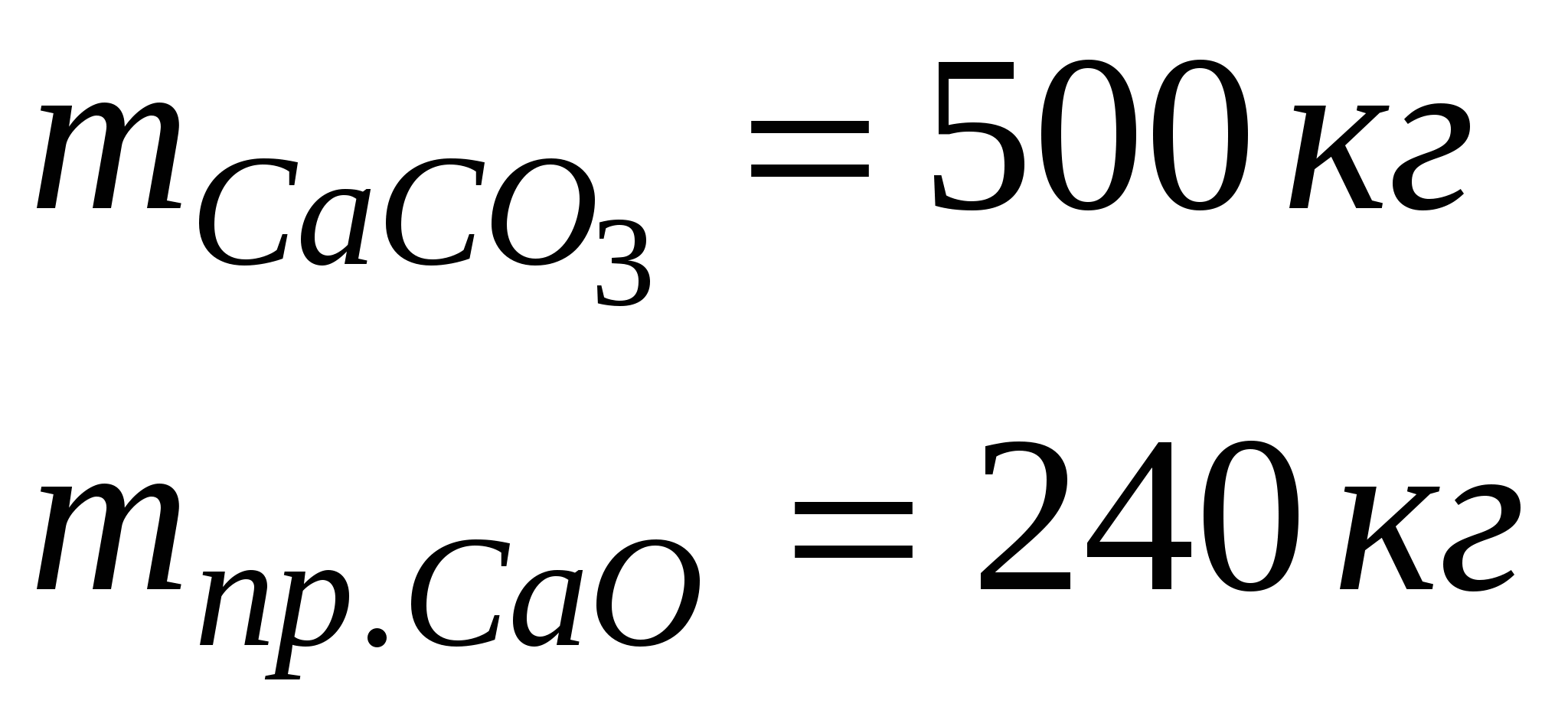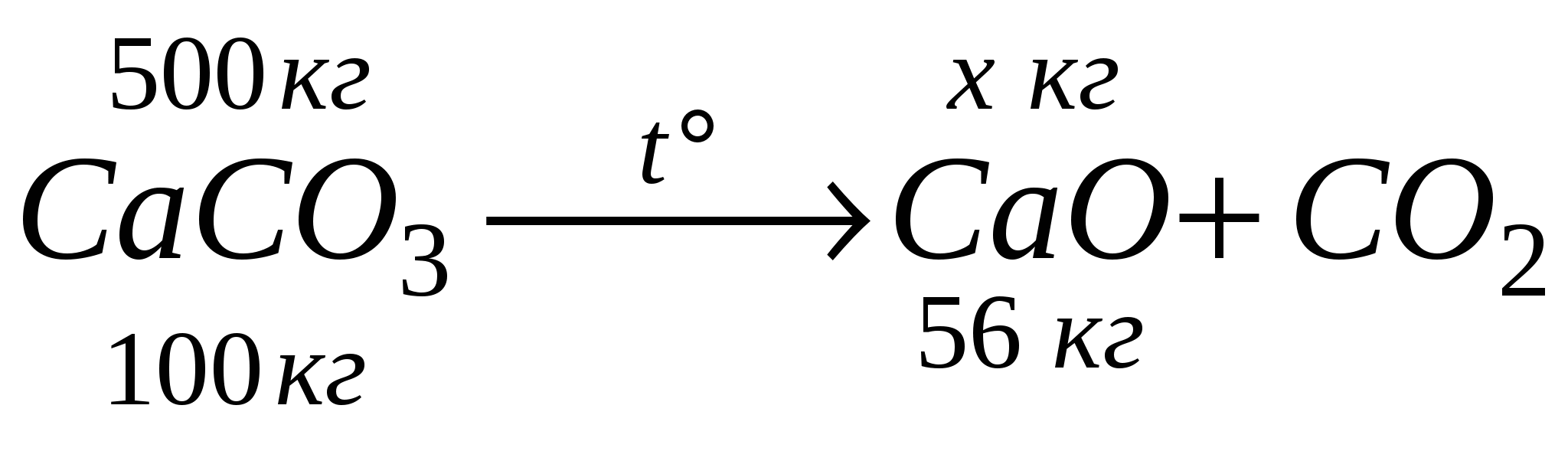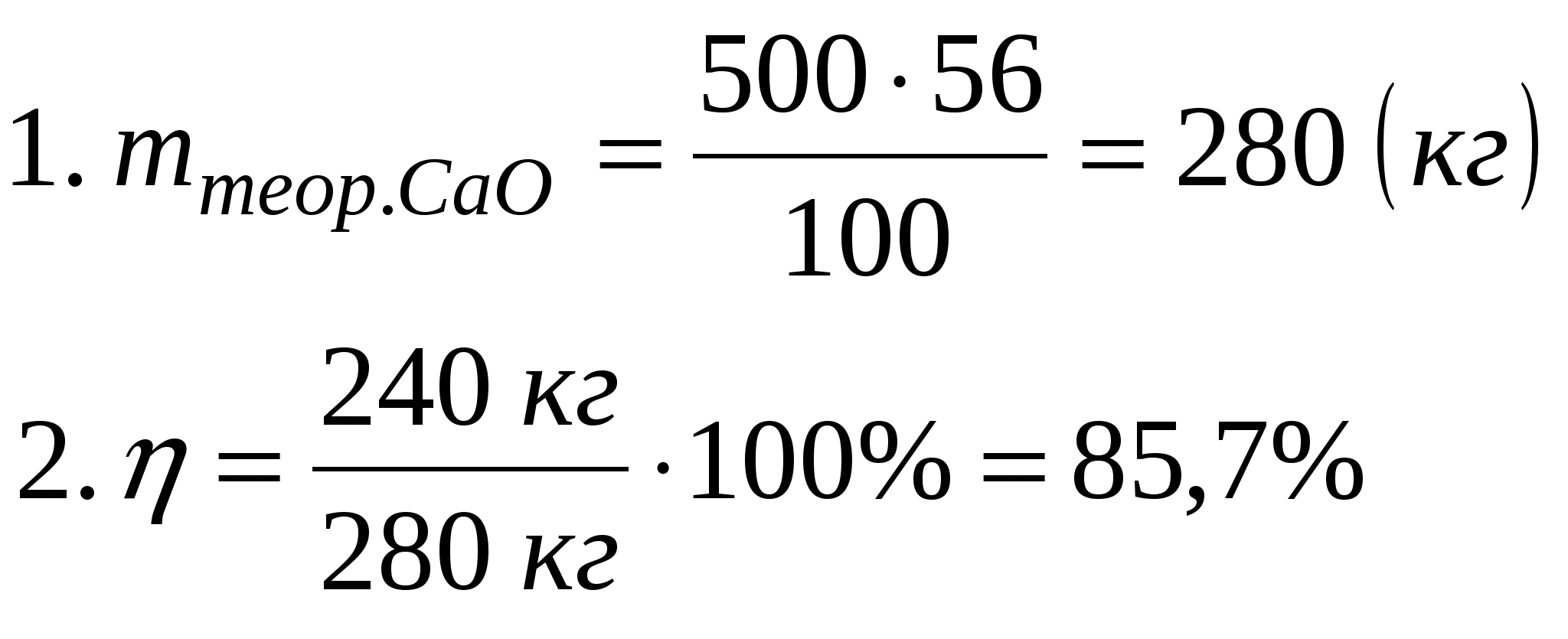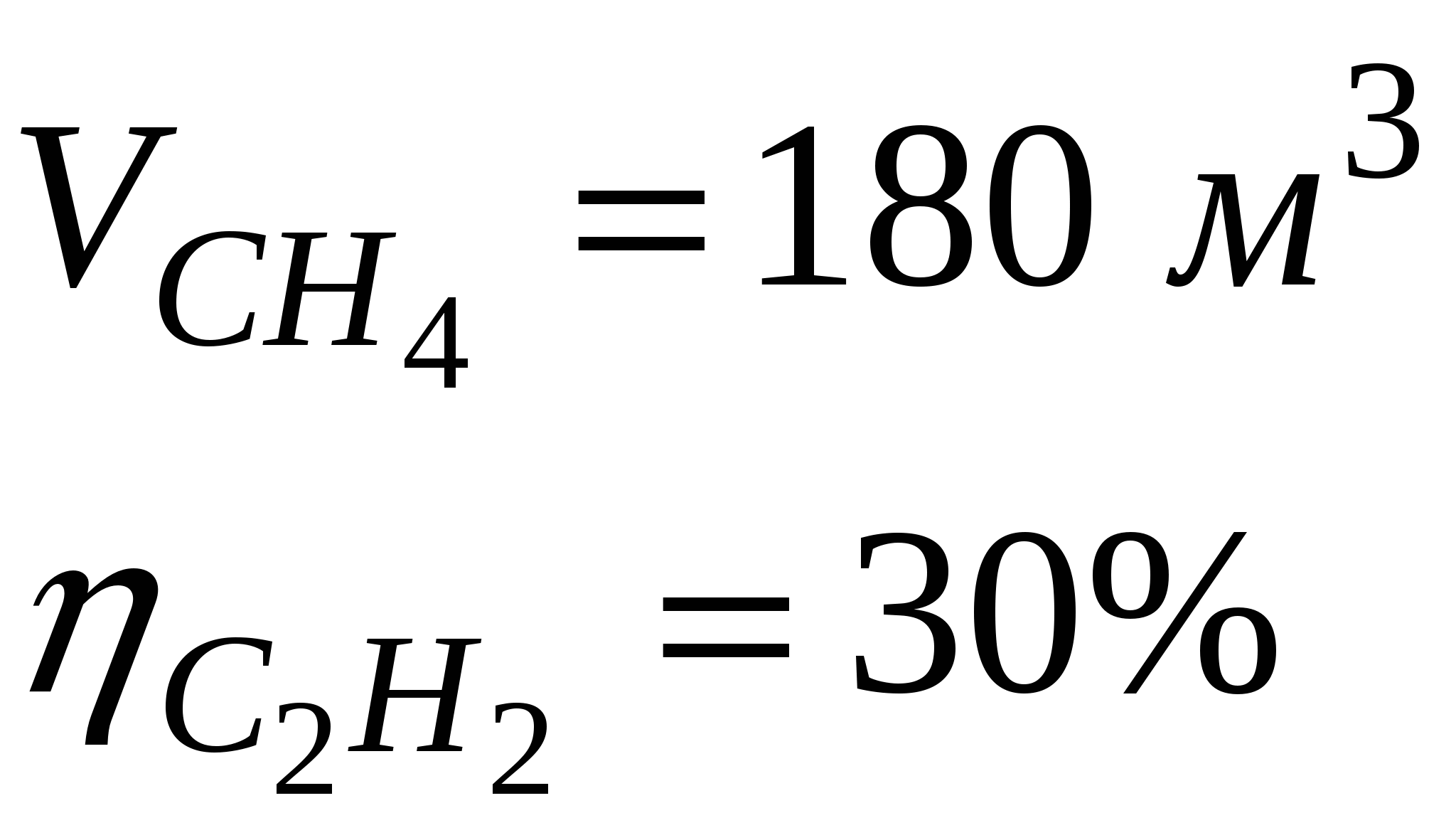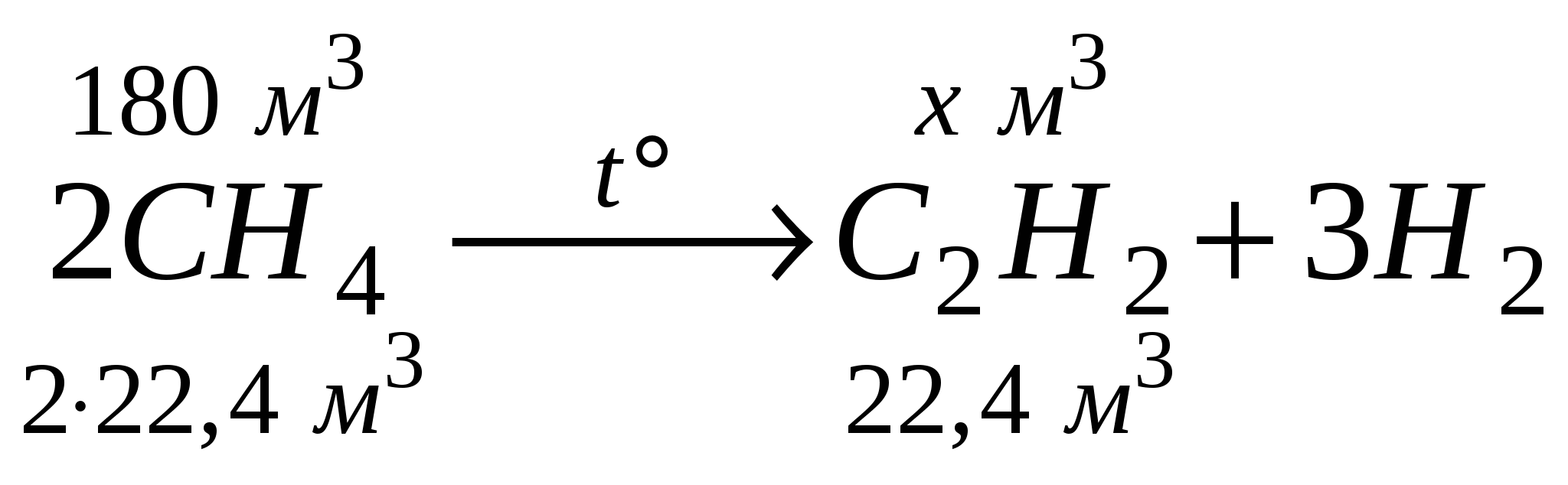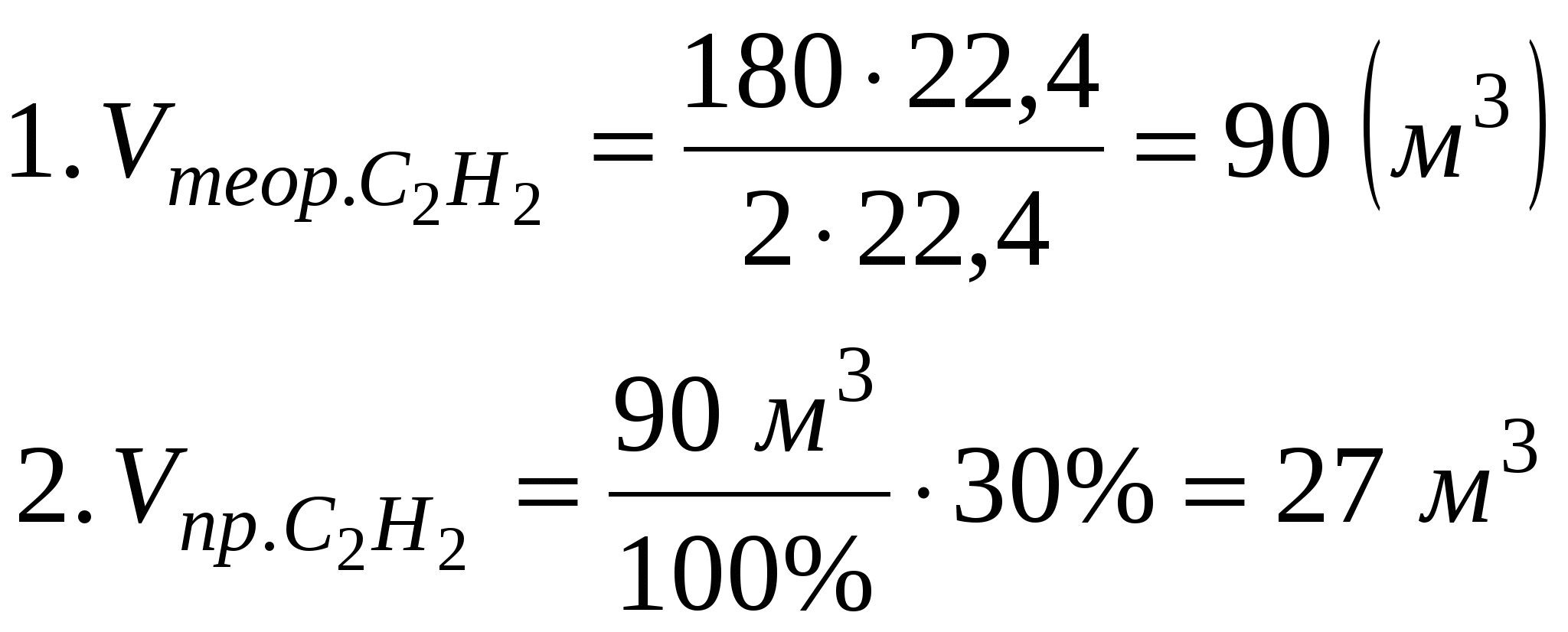конспект лекций по физхимии. Конспект лекций по дисциплине Химия тема 1 основые понятия и законы химии. Основные законы химии. Закон сохранение массы
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
ТЕМА 3 РЕШЕНИЕ ЗАДАЧ, СВЯЗАННЫХ С ПОНЯТИЕМ "ВЫХОД ПРОДУКТА РЕАКЦИИ". η (выход продукта) - масса, или объем продукта реакции. выход теоретический - всегда 100 % выход практический – 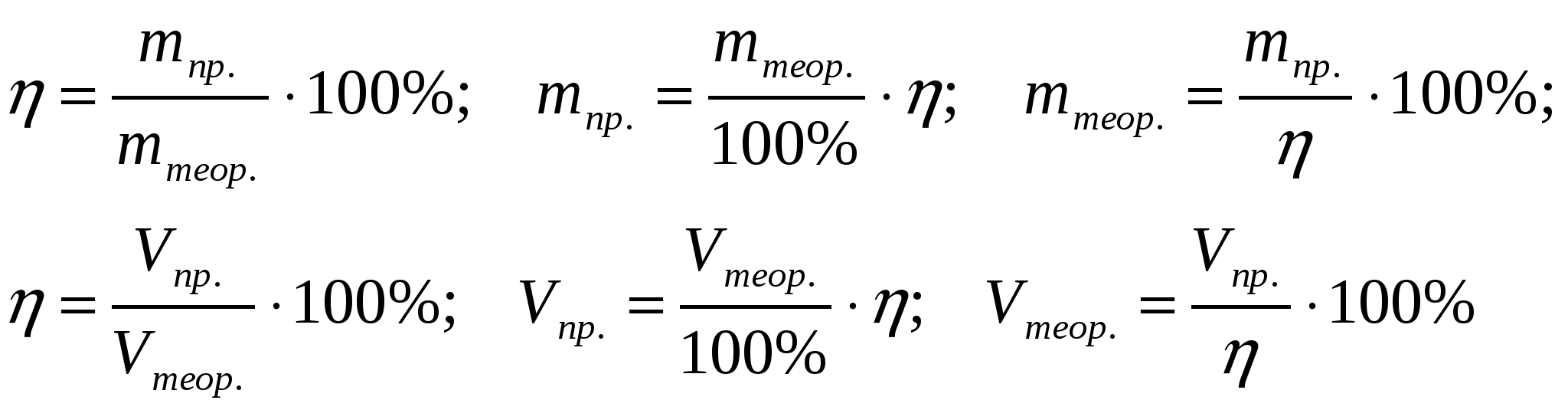 Задача 1. При обжиге 500 кг СаСО3 получили 240 кг СаО. Определить выход оксида кальция в %от теоретически возможного.
Задача 2. Вычислить объем ацетилена, образовавшегося при разложении 180 м3 метана, если выход С2Н2 составляет 30%от теоретически возможного.
Задача 3. Сколько граммов CaC2 ввели в реакцию, если при этом получили 5,6 л С2Н2, что составляет 80%от теоретически возможного выхода? САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ТЕМЕ «РЕШЕНИЕ ЗАДАЧ, СВЯЗАННЫХ С ПОНЯТИЕМ "ВЫХОД ПРОДУКТА РЕАКЦИИ"». Вариант № 1 1. Какой объем ацетилена (С2Н2) собрали при взаимодействии 6,4 г карбида кальция (СаС2) с водой, если выход продукта составляет 90% от теоретически возможного? СаС2+ 2Н2О → Cа(OH)2+ С2Н2 2. Из 92 г этанола (С2H5OН) получили 33,6 л этилена (С2Н4). Вычислите выход этилена в %от теоретически возможного. С2H5OН → С2Н4 + Н2О Вариант № 2 1. При дегидратации 92 г этилового спирта(С2H5OН) получили этилен (С2Н4). объемом 40 л. Вычислите выход этилена в %от теоретически возможного. С2H5OН → С2Н4 + Н2О 2. Сколько г тетрахлорметана (СН3Сl) можно получить из 28 л метана (СН4), если выход тетрахлорметана составляет 80%от теоретически возможного? ТЕМА 5: ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ Углеводороды, содержащие в углеродной цепи одну или несколько кратных (двойных или тройных) углерод-углеродных связей, называют непредельными. Термин «непредельные» означает, что атомы углерода не до предела насыщены атомами водорода и, как следствие, склонны к реакциям присоединения. Характеристика двойной связи. Двойная связь состоит из одной сигма-связи и одной пи-связи. Сигма-связь более прочная, она осуществляется по линии, соединяющей ядра атомов. Пи-связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Свободное вращение атомов углерода относительно двойной связи невозможно.
ЭТИЛЕН. Строение молекулы этилена. Молекула этилена имеет плоское строение, углы между направлениями связей равны 120º. Между атомами углерода располагается двойная связь, длина которой составляет 0,133 нм, 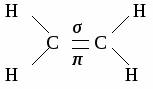 Физические свойства этилена. Этилен – газ без цвета и запаха, немного легче воздуха, нерастворим в воде, растворим в спирте и эфире. При концентрации 80%обладает наркотическим действием. Химические свойства этилена. 1. горение С2H4 + 3O2 → 2 CO2 + 2H2O 2. реакции присоединения а) окисление перманганатом калия 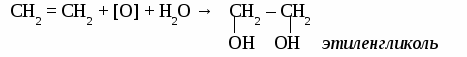 б) галогенирование 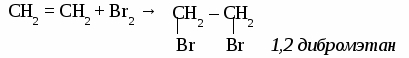 в) гидрогалогенирование CH2 = CH2 + НBr → CH3 – CH2Br бромэтан г) гидрирование CH2 = CH2 + Н2 → CH3 – CH3 этан д) гидратапия CH2 = CH2 + H2O → CH3 – CH2ОН этиловый спирт е) полимеризация n CH2 = CH2 → (– CH2 – CH2 –)n полиэтилен Получение этилена.
Применение этилена. Этилен используется для получения растворителей, ядохимикатов, антифризов, полиэтилена, этилового спирта, дляускорения созревания овощей и фруктов. Задача 1. Смесь этана и этилена объемом 2,5 л пропустили через раствор брома в воде. При этом образовался 1,2-дибромэтан массой 4,7 г. Определите состав исходной смеси газов в %. Задача 2. При дегидратации 92 г этилового спирта получили этилен объемом 40 л. Вычислите выход этилена в %от теоретически возможного. Гомологический ряд этилена.
СnН2n - общая формула этиленовых углеводородов Изомерия и номенклатура алкенов. Для алкенов возможны следующие виды изомерии:
В соответствии с требованиями ИЮПАК при названии алкенов руководствуются следующими правилами: 1. Самую длинную цепь, содержащую двойную связь, нумеруют с того конца, к которому она ближе. При расположении кратной связи в центре цепи нумерацию ведут от атома углерода к которому ближе разветвление. 2. Положение и названия заместителей указывают перед основой названия. 3.Записывают название того углеводорода, чья цепь взята за основу, заменяя окончание -ан на -ен и указывав цифрой через дефис место кратной связи (номер того атома углерода, от которого она начинается). Упражнение. Составить формулы четырех изомеров пентена и назвать их, используя номенклатуру ИЮПАК.   Химические свойства непредельных углеводородов. Для непредельных углеводородов характерна реакция присоединения по месту разрыва кратной связи. Они присоединяют: галогены, галогеноводороды, воду, водород и вступают в реакцию полимеризации. Упражнение. Составить уравнения лекций, характеризующих химические свойства пропилена. 1. с галогенами 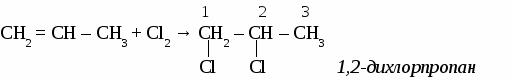 2. с галогеноводородами Присоединение галогеноводородов к алкенам определяется правилом Марковникова: «Галоген присоединяется к наименее гидрогенизированному атому углерода двойной связи, а водород - к наивнее гидрогенизированному». 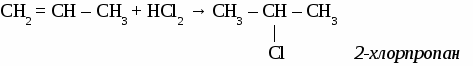 3. с водородом CH2 = CH – СН3 + Н2 → СН3 – СН2 – СН3 пропан 4. с водой 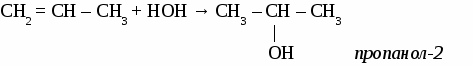 5. полимеризация 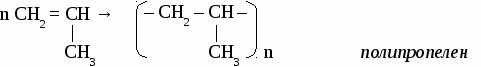 САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ТЕМЕ «ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ» Вариант №1 1. Составить 5 изомеров октена. Дать им названия по международной номенклатуре. 2. Продолжить уравнения реакций: 1) СН2 = СН―CН2―СН3 + Вr2→ 2) СН2 = СН―CН2―СН3 + НВr→ 3) СН2 = СН―CН2―СН3 + Н2О→ 4) СН2 = СН―CН2―СН3 + Н2→ 5) СН2 = СН―CН2―СН3 + [О]+ Н2О→ Вариант №2 1. Составить 5 изомеров гексена. Дать им названия по международной номенклатуре. 2. Продолжить уравнения реакций: 1) СН2 = С― СН3 + Cl2→ 4) СН2 = С― СН3 + НCl→ | | СН3 СН3 2) СН2 = С― СН3 + Н2О → 5) СН2 = С― СН3 + Н2→ | | СН3 СН3 3) nСН2 = СН ―СН3 + НВr→ ТЕМА 6 ДИЕНОВЫЕ УГЛЕВОДOPOДЫ. Диеновыми углеводородами (алкадиенами) называют углеводороды с открытыми углеродными цепями, в молекулах которых содержатся две двойные связи. Номенклатура алкадиенов.  Особенности реакций присоединения к алкадиенам. В процессе присоединения на первой стадии у диеновых углеводородов разрываются обе двойные связи, образуется двойная связь посредине молекулы, а присоединение атомов других элементов происходит по концам молекулы в положениях 1, 4 . Упражнение. Уравнениями реакций подтвердить химические свойства бутадиена-1, 4. 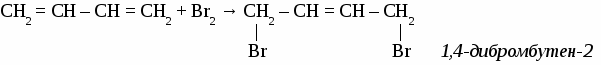 CH2 = CH – СН = СН2 + Н2 → CH3 – CH = СН – СН3 бутен-2 CH2 = CH – СН = СН2 + НCl → CH3 – CH = СН – СН2Cl 1-хлорбутен-2 n CH2 = CH – СН = СН2 бутадиеновый каучук Упражнение. Составить формулы по названиям:
КАУЧУК. Каучуками называют продукты полимеризации диеновых углеводородов и их производных. Природный, или натуральный, каучук получают из млечного сока (латекса) каучуконосных растений, например гевеи. 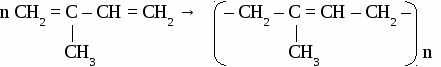 Каучуки относят к полимерам, называемым эластомерами. Однако каучуки очень чувствительны к высоким и низким температурам. Этот недостаток устраняется с помощью процесса, называемого вулканизацией. Он заключается в нагревании каучука с серой, при этом отдельные полимерные цепи сшиваются между собой за счет образования дисульфидных мостиков. Продукт частичной вулканизации каучука называют резиной. Она имеет сетчатую структуру и менее эластична, чем каучук, но обладает значительно большей прочностью. При увеличении количества серы (до 30%) продукт вулканизации (эбонит) полностью теряет пластичность. Синтетические каучуки. Первый синтетический каучук был получен в СССР под руководством академика С.В. Лебедева в 1932 году, радикальной полимеризацией бутадиена-1,3 в присутствии металлического натрия. Бутадиеновый каучук обладает хорошей водо- и газонепроницаемостью, но менее эластичен, чем натуральный каучук. Общим недостатком углеводородных каучуков является их низкая термическая устойчивость, набухание и разрушение в нефтепродуктах, этих недостатков лишен хлоропреновый каучук. 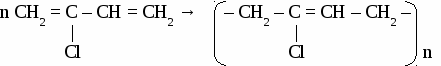 Хлоропреновый каучук используют для изготовления бензо- и маслостойкой резины, трубопроводов при перекачке нефтепродуктов. АЦЕТИЛЕН 1. Строение молекулы. Молекула ацетилена содержит тройную связь и имеет линейное строение. 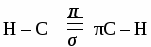 2.Физические свойства ацетилена. Ацетилен - газ без цвета, вкуса и запаха, легче воздуха, нерастворим в воде, растворим в ацетоне. 3. Химические свойства ацетилена. Благодаря наличию тройной связи ацетилен вступает в реакции присоединения. а) галогенирование CH CH + Br2 → CHBr = CHBr 1,2-дибромэтан б)гидрирование CH CH + Н2 → CH2 = CH2 в) гидрогалогенирование CH CH + HCl → CH2r = CHCl винилхлорид г) гидратация 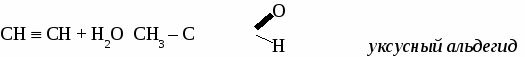 д) окисление раствором перманганата калия CH º CH + 4[O] → H2C2O4 щавелевая кислота е) димеризация CH º CH + CH º CH → CH º CH – CH º CH2 винилацетилен ж) тримеризация 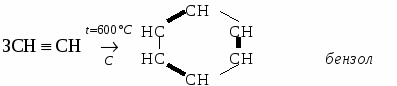 Горение 2C2H2 + 5O2 → 4CO2 + 2H2O Получение ацетилена. 1. Карбидный способ. CaC2 + 2H2O → C2H2 + Ca(OH)2 2. Пиролиз метана. Гомологи ацетилена.
Задача 1. Определите массу уксусного альдегида, полученного из 100 л ацетилена с выходом 80%от теоретического. Задача 2. На технический карбид кальция массой 120 кг подействовали водой. При этом образовался газ объемом 33,6 м3. Определите массовую долю чистого карбида в техническом. Задача 3. Сколько литров воздуха, содержащего 20%кислорода, потребуется для полного сжигания смеси объемом 30 л, состоящей из этилена (60%) и ацетилена (40%)? ТЕМА 8: ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ ФОРМУЛЫ ВЕЩЕСТВА ПО ПРОЦЕНТНОМУ СОДЕРЖАНИЮ ЭЛЕМЕНТОВ И ПО ПРОДУКТАМ СГОРАНИЯ. Задача 1. Определить молекулярную формулу вещества, содержащего: 50% Са , 15%С, 35%N. CaxCyNz – общая формула. 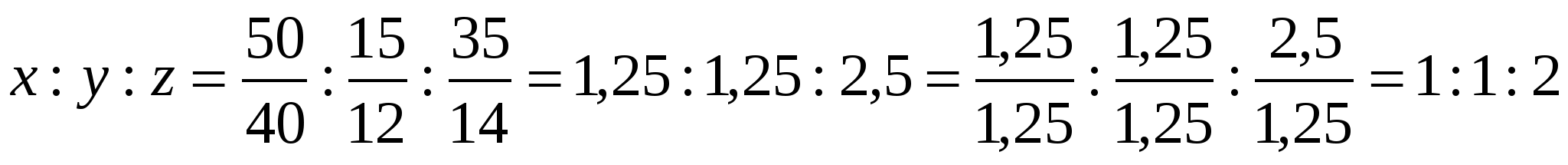 CaCN2 – истинная формула Относительная плотность газов.   Задача 2. Определить молекулярную формулу вещества, содержащего, 85,7% С и 14,3%Н. Плотность по водороду равна 21. CxНy – общая формула. 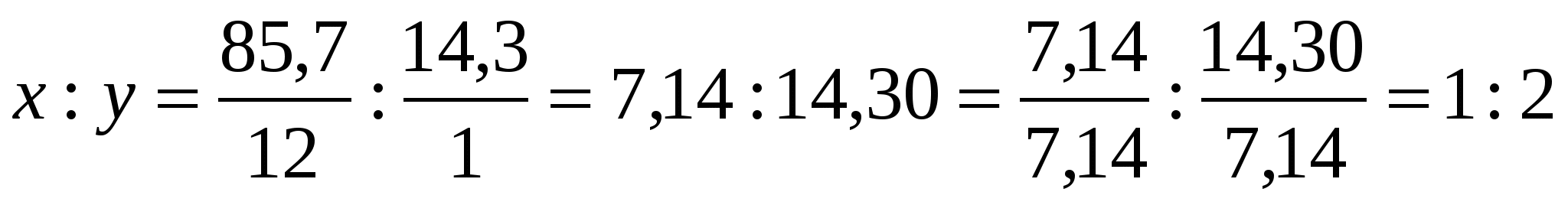 С3Н6 – истинная формула Задача 3. При сгорании 2,9 г вещества выделилось 8,8 г СО2 и 4,5 г Н2О. Плотность по воздуху равна 2. Определить молекулярную формулу вещества.
CxНy – общая формула. С4Н10 – истинная формула Задача 4. При сгорании 16,2 г вещества выделилось 52,8 г СО2 и 16,2 гН2О. Плотность по водороду равна 27. Определить молекулярную формулу вещества.
CxНy – общая формула. С4Н6 – истинная формула Задача 5. При сгорании 11, 5 г вещества выделилось 22 г СО2 и 13,5 г Н2О. Плотность паров по водороду равна 23. Определить молекулярную формулу вещества.
CxНyOz – общая формула. С4Н6О – истинная формула САМОСТОЯТЕЛЬНАЯ РАБОТА « ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ ФОРМУЛЫ ВЕЩЕСТВА ПО ПРОЦЕНТНОМУ СОДЕРЖАНИЮ ЭЛЕМЕНТОВ И ПО ПРОДУКТАМ СГОРАНИЯ». Вариант 1. 1. Определить молекулярную формулу вещества содержащего: 85,7%С и14,3 %Н. Плотность по воздуху равна 1,931. 2. При сгорании 2,1 г вещества получили 6,6 г СО2 и 2,7 г воды. Определите молекулярную формулу вещества. Вариант 2. 1. При сгорании 5,3 г вещества получили 17,6 г СО2 и 4,5 г воды. Определите молекулярную формулу вещества. 2. При сгорании 5,7 г вещества получили 17,6 г СО2 и 8,1 г волы. Определите молекулярную формулу вещества. Вариант 3. 1. При сгорании 9 г вещества получили 26,4 г СО2 и 16,2 г воды. Определите молекулярную формулу вещества. 2. При сгорании 8,4 г вещества получили 25,4 г СО2 и 10,8 г воды. Определите молекулярную формулу вещества. Вариант 4.
2. При сгорании 4 г вещества получили 13,2 г СО2 и 3,6 г воды. Определите молекулярную формулу вещества. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||