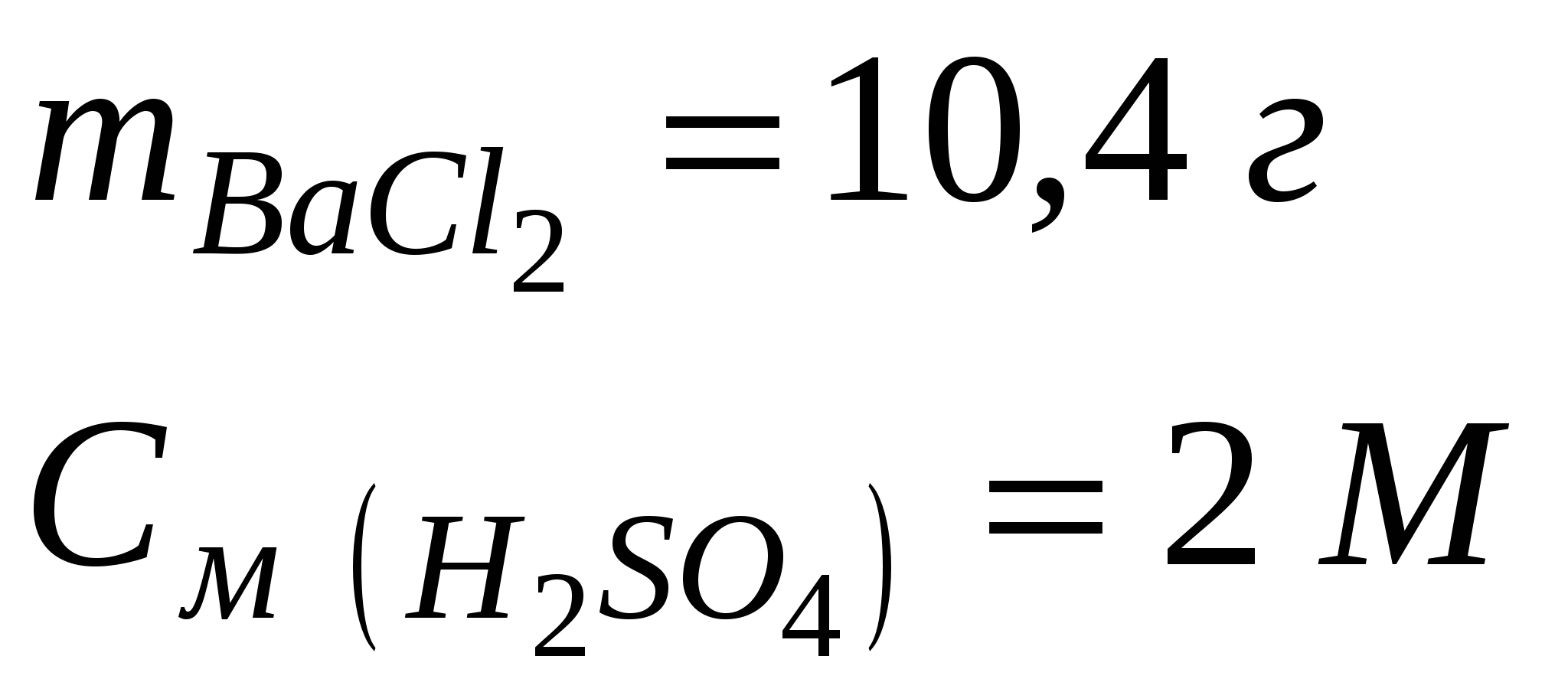конспект лекций по физхимии. Конспект лекций по дисциплине Химия тема 1 основые понятия и законы химии. Основные законы химии. Закон сохранение массы
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
ТЕМА 3: ПЕРИОДИЧЕСКИЙ ЗАКОН И СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА.Свойства химических элементов и образуемых ими соединений находятся в периодической зависимости от величины заряда их атомных ядер. Графическим изображением периодического закона является периодическая система элементов. По горизонтали система элементов делится на семь периодов. Периоды, кроме первого, начинаются щелочным металлом и заканчиваются инертным газом. Три первые периода называется малыми, остальные – большими. В периодах слева направо металлические свойства элементов ослабевают, а неметаллические усиливаются. По вертикали химические элементы распределены по восьми группам. Каждая группа состоит из двух подгрупп - главной и побочной. Подгруппа, в которую входят элементы малых и больших периодов, называется главной. Подгруппа, в которую входят элементы только больших периодов, называется побочной. В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Атом - это электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра, образованного протонами и нейтронами, и электронов. Характеристика элементарных частиц.
Состояние электронов в атоме. Электроны располагаются на энергетических уровнях. Число энергетических уровней в атоме элемента совпадает с номером периода, в котором расположен элемент. Максимальное число электронов, которые могут поместиться на n-м уровне составляет 2 n2. Энергетические уровни делятся на подуровни. Число подуровней равно номеру уровня. Подуровни обозначаются буквами и имеют различную вместимость, а именно: Электрон в атоме не имеет траектории движения, то есть можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называют орбиталью, или электронным облаком. s-орбитали имеют сферическую форму, р–орбитали - форму объемной восьмерки, d-орбитали - форму листа клевера, f-орбитали - форму шестилепесткового цветка. На одной орбитали не может быть больше двух электронов. Электронные формулы атомов. Энергетические уровни и подуровни заполняются в определенной последовательности - по правилу Клечковского. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 …. УПРАЖНЕНИЯ: Составить электронные формулы атомов: натрия, фосфора, титана. 11Na 1s2 2s2 2p6 3s1 15Р 1s2 2s2 2p6 3s2 3p3 22Ti 1s2 2s2 2p6 3s2 3p6 3d24s2 Для большей наглядности строение электронной оболочки можно изображать графически с помощью так называемых квантовых ячеек. Каждую орбиталь изображают в виде квадратика (квантовой ячейки), а электрон обозначают стрелкой. Для электронов одной орбитали стрелки должны быть направлены в разные стороны, так как эти электроны имеют противоположные спины. УПРАЖНЕНИЯ: Распределить по квантовым ячейкам электроны атомов: углерода, кислорода, натрия, титана. ТЕМА 4: ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ. Под химической связью понимают такое взаимодействие атомов, которое соединяет их в молекулы, ионы, радикалы, кристаллы. В образовании химической связи могут принимать участие: а) неспаренные электроны атома; б) пара валентных электронов, находящихся на одной орбитали. Ионная связь. По строению атома все элементы можно разделить на две группы: с завершенным последним квантовые слоем - благородные газы, с незавершенным - все остальные. Элементы с завершенным слоем при обычных условиям химически инертны, все остальные - активны. Каждый атом стремится быть похожим на инертные газы, т.е. иметь завершенный внешний слой (октет), и на пути к этому происходит процесс потери или получения электронов. Атомы, присоединившие чужие электроны, превращаются в отрицательные ионы, или анионы. Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы. Между противоположно заряженными ионами возникают силы электростатического притяжения, осуществляя тем самым ионную химическую связь. Ионная связь - это связь, образовавшаяся между катионами и анионами за счет их электростатического притяжения. Соединения с ионной связью образуют металлы с неметаллами. Например: Ковалентная связь, Альтернативным путем построения устойчивой конфигурации из восьми (для водорода-двух) электронов является их обобществление, т.е. предоставление в совместное пользование. В результате образуются общие электронные пары, которые играют роль «связующей нити» между атомами, образующими химическую связь. Ковалентной называется химическая связь между атомами, возникающая путем обобществления электронов с образованием общих электронных пар. Соединения с ковалентной связью образуют только неметаллы. Ковалентная связь, образующаяся между атомами одного и того же неметалла, называется неполярной. Например: Ковалентная связь, образующаяся между атомами различных неметаллов, называется полярной. Например: УПРАЖНЕНИЯ: Определите вид химической связи в соединениях:
Металлическая связь Все металлы в твердом состоянии имеют металлическую кристаллическую решетку. При ее образовании атомы сближаются до такой степени, что электрон может относительно свободно перемещаться от своего атома к соседнему, при этом исходный атом превращается в катион. Электроны же могут относительно свободно перемещаться по всему объему металла. Металлической называется связь в металлах и сплавах, обусловленная взаимодействием относительно свободных электронов с катионами в узлах кристаллической решетки. Водородная связь. Химическую связь между атомами водорода одной молекулы и атомами электроотрицательных элементов (фтором, кислородом, азотом) другой молекулы называют водородной. Например: 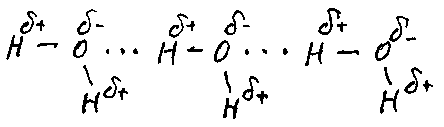 САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ТЕМЕ «СТРОЕНИЕ АТОМА. ХИМИЧЕСКАЯ СВЯЗЬ». Вариант 1. 1. Дать характеристику атомам алюминия, брома по их положению в периодической таблице по плану: а) № периода, № группы; б) заряд ядра атома; число протонов, нейтронов, электронов; в) распределение электронов по уровням; г) электронная формула; д) распределение электронов по квантовым ячейкам. 2. Определите вид химической связи в соединениях: а) N2О5; в) Ca; д) Н2; ж) ZnS б) N2 ; г) KOH е) H3PO4 з) CaO Вариант 2. 1. Дать характеристику атомам азота, меди по их положению в периодической таблице по плану: а) № периода, № группы; б) заряд ядра атома; число протонов, нейтронов, электронов; в) распределение электронов по уровням; г) электронная формула; д) распределение электронов по квантовым ячейкам. 2. Определите вид химической связи в соединениях: а) CaCO3 в) O2 д) H2S ж) Zn б) SO3 г) Ba е) F2 з) CuSO4 Вариант 3. 1. Дать характеристику атомам хлора, калия по их положению в периодической таблице по плану: а) № периода, № группы; б) заряд ядра атома; число протонов, нейтронов, электронов; в) распределение электронов по уровням; г) электронная формула; д) распределение электронов по квантовым ячейкам. 2. Определите вид химической связи в соединениях: а) SiO2 в) NaCl д) H2O ж) Cl2 б) Ag г) O3 е) ZnO з) NaOH Вариант 4. 1. Дать характеристику атомам углерода, железа по их положению в периодической таблице по плану: а) № периода, № группы; б) заряд ядра атома; число протонов, нейтронов, электронов; в) распределение электронов по уровням; г) электронная формула; д) распределение электронов по квантовым ячейкам. 2. Определите вид химической связи в соединениях: а) AlCl3 в) I2 д) С ж) HF б) HNO3 г) Zn е) Fe2O3 з) Na2CO3 ТЕМА 4: ВОДА. РАСТВОРЫ КОНЦЕНТРАЦИЯ РАСТВОРОВ. Дисперсные системы. Термины:
Например: лед в воде. Понятие о дисперсных системах. Дисперсными называются системы, компоненты которых равномерно распределены друг в друге. В дисперсных системах различают дисперсную фазу - мелкораздробленное вещество, и дисперсионную среду - вещество в котором распределена дисперсная фаза. Классификация дисперсных систем. 1. Истинные растворы (величина частиц дисперсной фазы не более 1 нм). 2. Коллоидные растворы (диаметр частиц дисперсной фазы от 1 нм до 100 нм). 3. Взвеси (диаметр частиц дисперсной фазы больше 100 нм). В истинных растворах частицы дисперсной фазы представляют собой ионы или молекулы. Истинные растворы устойчивы. В коллоидных, растворах частицы представляют собой конгломераты молекул. Устойчивость коллоидных растворов достаточно велика не только из-за небольших размеров частиц, но и благодаря наличию у них одноименного заряда. Коллоидные системы чрезвычайно многообразны, они составляют основу всего живого мира (цитоплазма клеток, кровь, лимфа и т.д.), распространенность их в быту, технике, промышленности также очень велика (тушь, водоэмульсионные и вододисперсионные краски). Взвеси, как и коллоид, широко распространены в природе и используются в промышленности. Из-за больших размеров частиц дисперсной фазы взвеси быстро расслаиваются, очень неустойчивы. Примеры взвесей: Суспензия - дисперсная фаза - твердое вещество, дисперсионная среда - жидкость (зубная паста, кремы, мази). Эмульсия. Дисперсная фаза дисперсионная среда - жидкости, нерастворимые друг в друге (молоко, смесь воды и масла). Дым. Дисперсная фаза - твердое вещество, дисперсионная среда - газ. Туман. Дисперсная фаза - жидкость, дисперсионная среда - газ. Концентрация растворов. 1. Процентная концентрация.  Задача 1. Сколько граммов сульфата натрия потребуется для приготовления 200 г 20% раствора?
Задача 2. В 150 г воды растворили 25 г аммиачной селитры. Определить процентную концентрацию полученного раствора.
Задача 3. Сколько граммов гидроксида натрия потребуется для приготовления 300 мл 10%раствора с плотностью 1,1 г/мл?
Задача 4. Какой объем 30%раствора КОН пл. 1,29 г/мл потребуется для нейтрализации раствора, содержащего 24,5 г серной кислоты?
2. Молярная концентрация. Задача 1. Определить молярностъ раствора в 50 мл которого содержится 5,6 г КОН.
Задача 2. Плотность 35%раствора серной кислоты равна 1,26 г/мл. Определить молярностъ раствора.
Задача 3. К раствору гидроксида натрия добавили 200 мл 0,3 М раствора сульфата меди. Определить массу выделившегося осадка.
Задача 4. Какой объем 2 M раствора серной кислоты необходим для реакции с раствором, содержащим 10,4 г хлорида бария?
3. Эквивалентная (нормальная) концентрация. 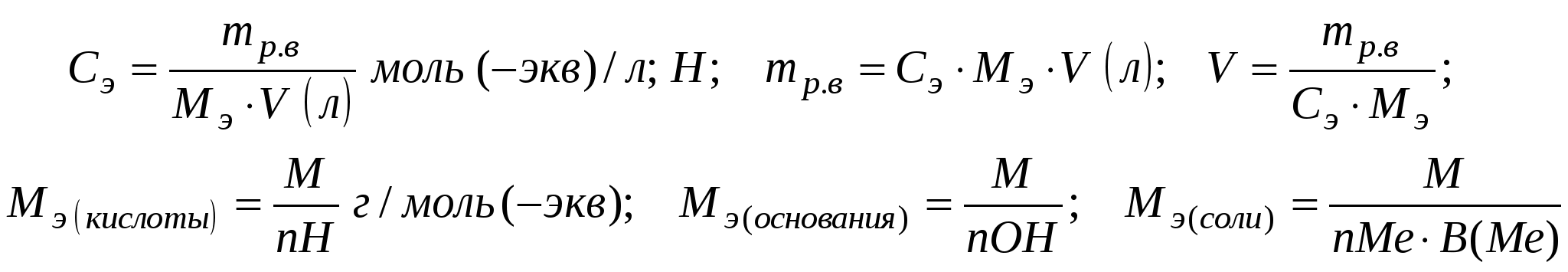 Задача 1. В 400 мл раствора содержится 19,6 г H3PO4. Определить нормальность раствора.
Задача 2. Какой объем 20%раствора К2СО3 пл. 1,19 г/мл потребуется для приготовления 500 мл 0,5 н раствора?
Задача 3. К 250 мл 0,5 н раствора карбоната натрия добавили необходимей объем нитрата кальция. Определите массу образовавшегося осадка.
ТЕМА 7: ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ. 1.Основные положения Т.Э.Д.
2.Степень электролитической диссоциации. Степенью электролитической диссоциации называют отношение числа молей электролита, распавшегося на ионы, к общему числу молей электролита в растворе. Степень диссоциации выражают в долях единицы или в процентах. Степень диссоциации увеличивается при разбавлении раствора. 3.Сильные и слабые электролиты.
4. Реакции ионного обмена. Реакции обмена в растворах электролита идут «до конца», если в результате реакции выпадает осадок, выделяется газ или образуется малодиссоциирующее вещество. В ионных уравнениях оксиды, осадки, газы и малодиссоциирующие вещества всегда записывают в молекулярной форме. Например: CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓ молекулярное уравнение Cu2+ + SO42- + 2Na+ + 2OH– → 2Na+ + SO42- + Cu(OH)2↓ полное ионное уравнение Cu2+ + 2OH– → Cu(OH)2↓ сокращенное ионное уравнение УПРАЖНЕНИЯ Составьте уравнения реакции в молекулярной и ионной форме между: а) карбонатом кальция и соляной кислотой; б) оксидом железа (3) и серной кислотой; в) фосфатом натрия и хлоридом бария САМОСТОЯТЕЛЬНАЯ РАБОTA. Реакции ионного обмена. Вариант 1. Составьте уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме: BaCl2 + K2CO3 → K2O + HCl → Na3PO4 + CaCl2 → Mg(OH)2 + HNO3 → Al(NO3)3 + Ba(OH)2 → Вариант 2. Cоставьте уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме: AgNO3 + AlCl3 → Fe(OH)2 + H2SO4 → Al2(SO4)3 + BaCl2 → ZnCl2 + K2S → Fe2O3 + HNO3 → Вариант 3. Составьте уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме: Al2O3 + HCl → Ba(OH)2 + HNO3 → MgCO3 + HCl → Fe2(SO4)3 + KOH → CuCl2 + K3PO4 → Вариант 4. Составьте уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме: Pb(NO3)2 + Na2S → CO2 + NaOH → Na2SiO3 + H3PO4 → Al(OH)3 + H2SO4 → FeCl3 + AgNO3 → ТЕМА: КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ОКСИДЫ. Оксиды - это сложные вещества, состоящие из двух элементов, один из которых – кислород. |