хирургия 2021. Контрольные вопросы для студентов 6 курса 1
 Скачать 0.73 Mb. Скачать 0.73 Mb.
|
|
32. Грыжа пищеводного отверстия диафрагмы(ГПОД) — хроническое рецидивирующее заболевание, при котором через пищеводное отверстие диафрагмы смещается абдоминальный отдел пищевода, кардия, верхний отдел желудка и в крайне редких случаях петли кишечника. Классификация ГПОД скользящие тракционные пульсионные смешанные[2]; параэзофагеальные; смешанные. По уровню возвышения над диафрагмой и объёму: кардиальные; кардиофундальные; субтотальные; тотально-желудочные. 33.Атеросклероз (греч. athḗra, кашица + sklḗrōsis, затвердевание[2]) — хроническое заболевание артерий эластического и мышечно-эластического типа, возникающее вследствие нарушения липидного и белкового обмена и сопровождающееся отложением холестерина и некоторых фракций липопротеидов в просвете сосудов. Отложения формируются в виде атероматозных бляшек. Последующее разрастание в них соединительной ткани (склероз), и кальциноз стенки сосуда приводят к деформации и сужению просвета вплоть до обтурации (закупорки сосуда). Важно отличать атеросклероз от артериосклероза Менкеберга, другой формы склеротических поражений артерий, для которой характерно отложение солей кальция в средней оболочке артерий, диффузность поражения (отсутствие бляшек), развитие аневризм (а не закупорки) сосудов. Атеросклероз сосудов сердца ведёт к развитию ишемической болезни сердца. Этиология На данный момент единой теории возникновения данного заболевания нет. Выдвигаются следующие варианты, а также их сочетания: теория липопротеидной инфильтрации — первично накопление липопротеидов в сосудистой стенке, теория дисфункции эндотелия — первично нарушение защитных свойств эндотелия и его медиаторов, аутоиммунная — первично нарушение функции макрофагов и лейкоцитов, инфильтрация ими сосудистой стенки, моноклональная — первично возникновение патологического клона гладкомышечных клеток, вирусная — первично вирусное повреждение эндотелия (герпес, цитомегаловирус и др.), перекисная — первично нарушение антиоксидантной системы, генетическая — первичен наследственный дефект сосудистой стенки, хламидиозная — первичное поражение сосудистой стенки хламидиями, в основном, Chlamydiapneumoniae. гормональная — возрастное повышение уровня гонадотропных и адренокортикотропных гормонов приводит к повышеному синтезу строительного материала для гормонов-холестерина. Патогенез Патогенез атеросклерозаучитывает все факторы, способствующие его развитию, но при этом прежде всего те, которые ведут к атерогеннойлипопротеидемии иповышению проницаемости мембран стенки артерий. С ними связано в дальнейшем повреждение эндотелия артерий, накопление плазменных модифицированных липопротеидов (ЛПОНП, ЛПНП) в интиме, нерегулируемый захват атерогенныхлипопротеидов клетками интимы, пролиферация в ней гладкомышечных клеток и макрофагов с последующей трансформацией в так называемые пенистые клетки, которые причастны к развитию всех атеросклеротических изменений (схема XVIII). Патологическая анатомия и морфогенез Сущность процесса хорошо отражает термин: в интиме артерий появляются кашицеобразный жиробелковый детрит (athere) и очаговое разрастание соединительной ткани (sklerosis), что приводит к формированию атеросклеротической бляшки, суживающей просвет сосуда. Обычно поражаются, как уже упоминалось, артерии эластического и мышечно-эластического типа, т. е. артерии крупного и среднего калибра; значительно реже в процесс вовлекаются мелкие артерии мышечного типа. Атеросклеротический процесс проходит определенные стадии (фазы), которые имеют макроскопическую и микроскопическую характеристику (морфогенез атеросклероза). При макроскопическом исследованииразличают следующие виды атеросклеротических изменений жировые пятна или полоски; фиброзные бляшки; осложнённые поражения, представленные фиброзными бляшками с изъязвлением, кровоизлияниями и наложениями тромботических масс; кальциноз, или атерокальциноз. Жировые пятна или полоски — это участки жёлтого или жёлто-серого цвета (пятна), которые иногда сливаются и образуют полоски, но не возвышаются над поверхностью интимы. Они содержат липиды, выявляемые при тотальной окраске сосуда красителями на жиры, например Суданом. Раньше всего жировые пятна и полоски появляются в аорте на задней стенке и у места отхождения её ветвей, позже — в крупных артериях. У 50% детей в возрасте моложе 1 года можно обнаружить в аорте липидные пятна. В юношеском возрасте липидоз усиливается, жировые пятна появляются не только в аорте, но и в венечных артериях сердца. С возрастом изменения, характерные для физиологического раннего липидоза, в подавляющем большинстве случаев исчезают и не являются источником развития дальнейших атеросклеротических изменений. Фиброзные бляшки — плотные, овальные или круглые, белые или бело-жёлтые образования, содержащие липиды и возвышающиеся над поверхностью интимы. Часто они сливаются между собой, придают внутренней поверхности сосуда бугристый вид и резко суживают его просвет (стенозирующий атеросклероз). Наиболее часто фиброзные бляшки наблюдаются в брюшной аорте, в отходящих от аорты ветвях, в артериях сердца, мозга, почек, нижних конечностей, сонных артериях и др. Чаще поражаются те участки сосудов, которые испытывают гемодинамическое (механическое) воздействие (в областях ветвления и изгибов артерий, на стороне их стенки, которая имеет жёсткую подстилку). 34. Истинные грыжи слабых зон диафрагмы • Люмбокостальные грыжи (грыжи Богдалека) встречаются крайне редко. • Парастернальные грыжи (грыжи Ларрея и Морганьи) от 2 до 6% всех диафрагмальных грыж: А) Ретрокостостернальные грыжи - выходящие в грудную полость через грудино-реберный треугольник. При этой патологии имеется грыжевой мешок, выступающий в плевральную полость соответствующей стороны и состоящий из брюшины и плевры с более или менее выраженной прослойкой соединительной и жировой ткани между ними. Ретрокостостернальные грыжи обычно располагаются справа от грудины. Б) Ретростернальные грыжи - обусловлены с врожденным отсутствием или недоразвитием мышечного слоя грудинной части диафрагмы. Они представляют собой истинные грыжи с мешком, расположенным в переднем средостении непосредственно за грудиной спереди от перикарда. КЛИНИКА И ДИАГНОСТИКА Иногда под влиянием тяжелого физического труда, травмы, беременности и родов или значительной прибавки в весе, т.е. при самых разнообразных состояниях, ведущих к повышению внутрибрюшного давления, грыжа, длительное время не дававшая никаких симптомов, начинает вызывать ряд неприятных ощущений.+ они могут давать ущемление. При развития ущемления возникают симптомы, характерные для странгуляционной кишечной непроходимости, по поводу которой большинство больных подвергается экстренной лапаротомии, причем правильный диагноз устанавливают только во время операции. Рентгенодиагностикарентгенографии в двух проекциях обнаруживается округлая или овальная ячеистая с отдельными просветлениями тень в области правогокардио-диафрагмального угла. В отдельных случаях в этой области можно видеть и более крупные скопления газа над диафрагмой и типичную для толстого кишечника гаустрацию. Контрастное исследованиежелудка в - в наддиафрагмальное пространство переместилась часть желудка, расположен в переднем средостениинепосредственно за грудиной. при ирригоскопии при грыжах, содержащих петлю толстой кишки, последняя видна в наддиафрагмальном пространстве справа от грудины, (“симптом сдавления” или “обтекания”). Наиболее ценным диагностическим методом - пневмоперитонеум, при котором воздух может проникнуть в грыжевой мешок, расположенный над диафрагмой, причем на фоне газа в ряде случаев можно отметить более контрастную тень сальника. 35. Показания к реваскуляризации миокарда у больных ИБС Нет ответа!!! 36.Медиастиниты. Определение понятия. Патогенез, этиология. Медиастинит - это асептический или микробный воспалительный процесс в клетчатке средостения с острым либо хроническим течением. Этиология Первичные травматические медиастиниты возникают вследствие экзогенного инфицирования. Чаще всего это происходит при открытых, в том числе огнестрельных, травмах органов средостения. Второй по частоте причиной первичного медиастинита выступают травмы пищевода при инструментальных манипуляциях (бужировании пищевода, кардиодилатации, эзофагоскопии, интубации трахеи, трахеостомии, желудочном зондировании). Нередко повреждения пищевода обусловлены инородными телами, спонтанным разрывом пищевода, ожогами, перфорацией дивертикула, изъязвлением опухолей и др. К числу первичных медиастинитов также относят послеоперационные воспаления клетчатки средостения, обусловленные нарушением герметичности пищеводно-желудочных анастомозов (после выполнения резекции и пластики пищевода, резекции желудка), осложнениями кардиохирургических вмешательств (маммарокоронарного шунтирования, аортокоронарного шунтирования, протезирования митрального клапана и аортального клапана). Вторичные медиастиниты являются осложнением какого-либо гнойного или деструктивного процесса и развиваются при непосредственном переходе воспаления на клетчатку средостения или метастазировании возбудителей из установленных или неустановленных инфекционных очагов. Контактный медиастинит может развиваться на фоне ран и флегмон шеи, гнойного тиреоидита, пневмонии, ранений легкого и плевры, абсцесса и гангрены легких, туберкулеза, эмпиемы плевры, бронхоэктатической болезни, пищеводно-плевральных свищей, перикардита, остеомиелита ребер, грудины и грудного отдела позвоночника. Первичным источником инфекции при метастатических медиастинитах могут являться флегмоны верхних и нижних конечностей, отморожения, периостит, остеомиелит нижней челюсти, заглоточный абсцесс при тонзиллите, флегмонозный паротит, ангина, язвенный колит, дизентерия, рожа, лимфаденит, сепсис и мн. др. Микробиологическая основа медиастинита представлена, в основном, смешанной флорой. Актуальными патогенами при медиастините выступают анаэробы (бактероиды, пептострептококки, превотеллы, порфиромонады, фузобактерии) и аэробы (стафилококки, стрептококки, клебсиелла), грибки. Особенность смешанной микрофлоры заключается в синергизме анаэробов и аэробов в ассоциациях, что предопределяет злокачественность течения медиастинита и высокую летальность. Этиология и патогенез Причины острого медиастинита: открытые повреждения; закрытая травма (нагноение гематомы); перфорация пищевода; осложнения операций на пищеводе, трахее, крупных бронхах, медиастиноскопии, пневмомедиастинографии; контактное распространение инфекции; метастатическое распространение инфекции. По происхождению различают первичные (травматические) и вторичные медиастиниты. Первичные медиастиниты возникают при ранениях и закрытых повреждениях средостения и его органов, а также после операционных и эндоскопических вмешательств на них. Острый первичный медиастинит при ранениях средостения встречается нечасто. Это объясняется, главным образом, сравнительно небольшим числом пострадавших с открытыми повреждениями средостения, которых успевают доставить в лечебные учреждения. Большинство из них быстро погибает на месте происшествия из-за тяжелых сочетанных повреждений и массивной кровопотери. Так, по опыту Великой Отечественной войны и последних локальных военных конфликтов, частота ранений средостения по отношению к проникающим ранениям груди у поступавших раненых, составила всего около 0,5%. Возникновение и тяжесть инфекционного процесса в средостении обычно связано с видом оружия и ранящего снаряда, характером ранения (сквозное, слепое), наличием или отсутствием повреждений внутренних органов. Прогрессированию хирургической инфекции способствует высокий уровень бактериальной обсемененности, вирулентности микрофлоры, образующиеся в результате травмы медиастинальная гематома и травматический некроз клетчатки средостения. Важное значение в развитии гнойного осложнения имеет исходное состояние организма в момент ранения и снижение его защитных сил в ответ на острую кровопотерю и тяжелый травматический шок. Гнойный медиастинит может быть по причинам развития: раневым; перфоративным; послеоперационным. Заболевание чаще возникает в результате проникновения микрофлоры в средостение из просвета поврежденных пищевода, трахеи или бронхов. Причины перфораций пищевода: бужирование при рубцовых сужениях; инородное тело; эзофагоскопия (при эзофагоскопии в 0,25% случаев - перфорации); ранения; тупая травма груди; химические агенты, чаще щелочи; воспаление лимфоузлов средостения; спонтанный разрыв; аневризма аорты. Причиной инфекции могут быть слепые, как правило, осколочные ранения, даже без нарушения целости полых органов. Занесенные, таким образом, в рану металлические осколки и обрывки одежды нередко вызывают значительное микробное загрязнение раны. Инфицированные инородные тела, располагаясь в рыхлой медиастинальной клетчатке, способны вызывать некрозы с расплавлением окружающих тканей и развитием флегмон или абсцессов средостения. Воспалительный процесс, возникающий при огнестрельных ранениях, в связи с тяжестью травмы чаще бывает диффузным и захватывает все задние или передние отделы средостения. Иногда развивается тотальный медиастинит. В мирное время первичные медиастиниты могут возникнуть при повреждениях пищевода и трахеи (инструментальных и инородными телами), открытых переломах грудины, в результате нагноения гематом при закрытых травмах груди. Нередко причиной медиастинита являются осложнения оперативных вмешательств на органах средостения: несостоятельность швов или некроз желудочного или кишечного трансплантата при пластике пищевода, несостоятельность швов трахеи и бронхов, нагноение послеоперационной раны или гематомы средостения и др. Вторичные медиастиниты встречаются в 2-3 раза чаще, чем первичные, и могут возникать при проникновении в средостение инфекции контактным, гематогенным и лимфогенным путями. Они могут быть осложнениями гнойных и гнилостных воспалений клетчатки шеи, дивертикулов и других нагноений стенок пищевода, распадающегося рака пищевода, остеомиелитов костного каркаса грудной клетки, воспалительных процессов кист и лимфатических узлов средостения, нагноений легких и плевры, иногда абсцессы и флегмоны средостения могут диагностировать как проявление септикопиемии при наличии первичного септического очага различной локализации. К развитию вторичных острых медиастинитов могут приводить инфекционные осложнения ранений легких плевры с формированием гнойных процессов контактным или метастатическим путем. Способствующим фактором в таких случаях является скопление крови в средостении в результате травмы. К образованию воспалительных очагов в средостении часто приводят и ранения шеи с повреждением пищевода гортани или трахеи. Условия для развития инфекционного процесса на шее с последующим его переходом на клетчатку средостения в силу анатомических особенностей этой области чрезвычайно благоприятные. Иногда источник медиастинита остается не выявленным (так называемые криптогенные медиастиниты). В основе патогенеза абсцессов и флегмон средостения находятся особенности взаимодействия макро- и микроорганизма. Далеко не всегда микробное обсеменение клетчатки средостения (в частности, при расширенных резекциях легких, резекции и пластике пищевода) приводят к развитию в ней нагноительных процессов. Возникновению гнойного медиастинита способствуют снижение защитных и репаративных способностей организма в результате травмы, оперативного вмешательства, кровопотери, наличия гнойной интоксикации, травматизации и некроза клетчатки средостения, скопления в ней крови, наличия источника постоянного инфицирования. С формированием в средостении гнойника патогенетические особенности заболевания обусловлены развитием компрессии органов груди, а также явлениями быстро нарастающего эндотоксикоза. Различают ограниченные (абсцессы) и распространенные (флегмоны) формы. Среди них выявляются медиастиниты передние (верхние - с расположением очагов выше уровня III межреберья; нижние - книзу от III межреберья, и всех передних отделов средостения), задние (верхние - с расположением очага выше уровня V грудного позвонка; нижние - книзу от V грудного позвонка, и всех задних отделов средостения) и тотальные. Острые медиастиниты могут иметь молниеносную, острую и подострую формы течения. Наиболее частой причиной развития медиастинита является кардиохирургическое вмешательство. В США медиастинит чаще всего возникает после проведения шунтирующих операций (аортокоронарного, маммарокоронарногошунирования), при этом частота этого осложнения в большинстве крупных центров составляет 1-2%. Риск развития медиастинита после проведения операции трансплантации сердца значительно выше [7]. Постстернотомический медиастинит развивается, в среднем, в 1-3% случаев кардиохирургических вмешательств [44]. По данным другого исследования, частота развития медиастинита после проведения стернотомии составила 0,34%. Основными факторами риска развития медиастинита были послеоперационная пневмония, инфекции мочевых путей и проведение внутриаортальной баллонной контрпульсации [21]. В работе R. Finkelsteinetal. [47] были приведены менее оптимистичные данные: инфекции области операции у кардиохирургических больных встречались в 10,4%. В то же время, частота развития медиастинита остается небольшой и составляет 3,25% - 1,48%. Согласно результатам проспективногомультицентрового исследования, частота инфекционных осложнений со стороны области вмешательства после проведения кардиохирургических операций составила 3% (38 гнойных осложнений на 1268 вмешательств). При этом раневая инфекция отмечена у 20 (1,6%), медиастинит - у 18 (1,4%) пациентов. Факторами риска, ассоциировавшимися с развитием инфекции в области операции, были трансплантации сердца, использование в ходе операции аппарата искусственного кровообращения, использование при коронарном шунтировании артерии молочной железы, повторные оперативные вмешательства в связи с тампонадой полости перикарда или кровотечением [78]. Аналогичные данные в отношении риска развития медиастинита при использовании технологии искусственного кровообращения приводят и другие авторы [63]. Согласно J.C. Walkesetal. [144], частота развития послеоперационного медиастинита в 2 раза выше при использовании для шунтирования двух внутренних грудных артерий, чем при одной, и составляет 4,4%. Сообщается о возможном развитии медиастинита в результате пересадки инфицированного трансплантата [19]. Таким образом, установленными факторами риска развития послеоперационного медиастинита являются [58]: - операция двухстороннего маммарокоронарногошунитрования - сахарный диабет - неотложный характер операции - присутствие внешней компрессии сердца - ожирение более 20% от идеальной массы тела - шок в послеоперационном периоде, особенно если имела место массивная гемотрансфузия - длительный период искусственного кровообращения и время операции проведение повторной операции - расхождение краев послеоперационной (стернотомной) раны - технические особенности выполнения операции (чрезмерное использование электрокоагуляции, обработка среза кости парафином, выполнение парамедианнойстернотомии). Необходимость в проведении трахеостомии после шунтрования коронарных сосудов увеличивает частоту развития медиастинита с 0,7% до 8,6% (Р<0,001) и летальность с 5,2% до 24,7% (Р<0,001), но не влияет на Кроме перечисленных выше, факторами риска развития постстернотомического медиастинита могут быть низкая фракция выброса левого желудочка, почечная недостаточность, доказанное поражение трех коронарных артерий [130], национальность, длительность госпитализации [139], исходно низкий уровень гемоглобина и эритроцитов крови [134], курение, продолжительность нахождения в отделении интенсивной терапии 2 и более суток, наличие отдаленных очагов инфекции [1], применение бета-адренэргических препаратов перед моментом инфицирования [12], класс по NewYorkHeartAssociation, предшествующие операции на сердце [92]. Существенное значение имеет исходный уровень гликемии. Так, в работе S.J. Wilsonetal. показано, что по данным многофакторного анализа риск развития медиастинита при проведении открытых операций на сердце возрастает при уровне сахара крови 126 мг/дл и выше [148]. Кроме того, инфекционные осложнения, включая медиастинит, чаще встречаются у женщин (9,2%), чем у мужчин (6,6%) (p < 0,05) [107]. Некоторые авторы приводят другие результаты исследований. По данным M. Uraetal [140], независимыми факторами риска развития медиастинита при шунтирующих операциях являются ожирение и распространенный атеросклеротический процесс с облитерацией сосудов. Сахарный диабет, гемодиализ, женский пол, пожилой возраст не являлись факторами риска медиастинита, но оказывали влияние на развитие инфекционных осложнений иных локализаций. Важнейшей причиной медиастинитов в многопрофильных клиниках является нисходящая одонтогенная инфекция. Трудности с диагностикой, исходно тяжелое состояние больных и задержка с оказанием необходимым оперативным лечением являются причиной высокой летальности [60]. Основные пути распространения инфекции - лимфогенный, реже - гематогенный и на протяжении. Факторами риска развития медиастинита являются вирулентность орофарингеальной флоры с преобладанием анаэробных возбудителей, локализация первичного очага на нижней челюсти, хронические, часто рецидивирующие процессы с вовлечением пародонта и костей челюсти, инфекция околоушных слюнных желез, ослабленные, истощенные больные из категорий лиц с низким социальным статусом, пациенты с сахарным диабетом и иммунной недостаточностью, получающие химио- и лучевую терапию [76]. Перфорация пищевода в США является редкой причиной развития медиастинита. Вместе с тем, развитие заболевания в этом случае сопровождается гораздо худшими показателями выживаемости [46]. Перфорация пищевода может развиться при онкологической патологии и стать причиной тяжелого медиастинита [49], а также быть спонтанной [131]. Чаще в клинической практике встречаются перфорации пищевода инородными телами при случайном или преднамеренном их проглатывании (куриные и рыбьи кости, булавки, металлические предметы и др.). Подобные ситуации наблюдаются у детей, стариков и пациентов, страдающих психическими заболеваниями [35]. Описаны случаи ятрогенного медиастинита, возникшие при дислокации назогастрального зонда с перфорацией пищевода [149], перфорации пищевода зондом Блэкмора [24] или пищеводным УЗ-кардиографическим датчиком [39], центральным венозным катетером [85]. Причиной медиастинита также может быть ятрогенная перфорация пищевода при проведении ряда лечебных и диагностических процедур в гастроэнтерологии, оториноларингологии [82, 122], например, при баллонной дилатации пищевода при его ахалазии [34]. Обобщенно, перфорация пищевода чаще возникает при [67, 131]: - эрозиях и опухолях пищевода - воздействии инородных тел - постановке назогастрального зонда или зонда для питания - спонтанном разрыве пищевода (синдром Вoerhaave) - инвазивном микозе пищевода - травме грудной клетки и живота, чаще при тупой травме. Другими причинами развития медиастинита в порядке убывания значимости и частоты возникновения могут быть [9, 22, 57, 60, 72, 100, 101]: - нисходящая некротизирующая инфекция как осложнение гнойно-воспалительных заболеваний головы, ЛОР-органов и шеи - нисходящая некротизирующая инфекция после операций на голове и шее, магистральных сосудах и позвоночнике - инфекции легких и плевры - трахеобронхиальная перфорация (при тупой или проникающей травме, проведении интубации трахеи и бронхоскопии) - гранулематозные инфекции. Микробиология Большинство послеоперационных медиастинитов в кардиохирургии вызываются грамположительными кокками, прежде всего Staphylococcusaureus и Staphylococcusepidermidis, которые выделяются в 70-80% случаев. При этом на долю Staphylococcusaureus приходится не менее 50% случаев этого осложнения. По данным Upton A etal., частота стафилококкового постстернотомического медиастинита составила 1,2% (60 случаев на 5176 срединных стернотомий). Staphylococcusaureus выделены в 49 (82%) случаях, коагулазо-негативные стафилококки в 11 (18%) случаях. 8 (16%) S. aureus были метициллинрезистентными [139]. Некоторые авторы отмечают более высокую частоту выделения метициллин-резистентных Staphylococcusaureus у больных с медиастинитами, чем у других категорий пациентов отделений интенсивной терапии [38, 97]. Выделение метициллинрезистентногоStaphylococcusaureus является фактором риска неблагоприятного исхода послеоперационного медиастинита [70]. Значимость уровня резистентности патогена для исхода медиастинита подтверждена и в исследовании A. Mekontso-Dessapetal. [89]. Тяжелое течение медиастинита может быть связано с пневмококковой инфекцией, хотя Streptococcuspneumoniae и не является типичным возбудителем при этом осложнении [133]. При нестабильности грудины чаще встречаются коагулазонегативные стафилококки. Факторами риска развития инфекции, вызванной коагулазонегативными стафилококками являются ожирение (P<0,001) и хроническая обструктивная болезнь легких (P=0,04) [55]. По данным испанских кардиохирургов, проанализировавших особенности этиологии медиастинита за период 1986-1996 гг., у 45 из 1779 оперированных на сердце больных, грамположительные возбудители встречались чаще у пациентов с длительным периодом ИВЛ и при наличии инфекций другой локализации (например, мочевых) (P<0,05) [115]. Смешанная грамположительная и грамотрицательная инфекция встречается в около 40% случаев. Грамотрицательная моноинфекция встречается очень редко [44]. Грамотрицательные аэробы чаще выделяются при инфекциях поверхностной локализации (57,8% против 16,7% при глубоких инфекциях, P<0,01) [25]. По данным C.B. Longetal., частота выделения грамотрицательных возбудителей составила 30%, в т.ч. Pseudomonasaeruginosa - 17%. Бактериемия зарегистрирована в 53% случаев. Факторами риска грамотрицательной инфекции средостения были увеличение продолжительности операции на открытой грудной полости и повторные вмешательства (32% против 15% в группе оперированных однократно) [80]. Медиастинит, связанный с распространенными формами сопутствующих инфекций, иных от области операции локализаций, а также требующий длительного проведения ИВЛ, также чаще вызывается грамотрицательной микрофлорой. [55, 115]. Существенным моментом является то, что медиастинит, вызванный E.coli и Ps.aeruginosa демонстрирует большие показатели летальности, чем аналогичный процесс, вызванный иными патогенами [46]. Медиастинит, не связанный с операциями на сердце, чаще всего вызывается смешанной флорой с преобладанием анаэробов. По данным L.M. Sanchoetal., при нисходящем некротизирующем медиастините в 71% случаев были выделены аэробно-анаэробные ассоциации, в 29% - только аэробы [120].Смешанная грамотрицательная и грамположительная флора, а также грибы рода Candida чаще встречаются при перфорации пищевода и при нисходящих инфекциях головы и шеи [146]. Медиастинит в результате перфорации пищевода, прорыва ретрофарингеального абсцесса, паротита, флегмоны шеи или абсцесса орофарингеальной локализации подразумевает инфицирование средостения аэробно-анаэробной флорой ротовой полости. Наиболее актуальными патогенами являются Bacteroidesspp., Peptostreptococcusspp., Prevotella и Porphyromonasspp., Fusobacteriumspp. [16, 17]. Из аэробных возбудителей при подобной этиологии медиастинита часто выделяются: Staphylococcusaureus, Streptococcusspp., Klebsiellaoxytoca, Eukenellacorrodens, микроаэрофильные стрептококки (Streptococcusmilleri), Trichosporum и другая флора, характерная для ротовой полости [51, 109]. Характерной особенностью подобной смешанной инфекции является синергизм между аэробами и анаэробами в ассоциациях, что определяет злокачественность течения и высокую летальность. Некроз клетчатки средостения и в ряде случаев газообразование ведут к повреждению прилежащих структур, прежде всего, плевры, с формированием фокуса эмпиемы. Грибковое поражение средостения возможно в результате: - гематогенного инфицирования тканей средостения при фунгемии - послеоперационной грибковой инфекции после стернотомии - грибковых форм нисходящего некротизирующегофасциита шеи - контактного инфицирования средостения (percontinuitatem) - грибковой инфекции заднего средостения в результате перфорации пищевода [75]. Развитие хронического фиброзирующего медиастинита в большинстве случаев ассоциируется с инфекцией Histoplasmacapsulatum и Mycobacteriumtuberculosis [68, 81]. 37.Анатомо-физиологические сведения о пищеводе. Классификация заболеваний пищевода. Методы исследования (рентгеноскопия, рентгенография, эзофагоскопия. Радиоизотопная диагностика). Краткие анатотомо-физиологические характеристики пищевода Пищевод — это часть пищеварительного канала, представляющая собой полую мышечную трубку со слизистой оболочкой внутри и хорошо развитым подслизистым слоем, богатым сетью кровеносных и лимфатических сосудов и нервным сплетением. Вокруг пищевода находится клетчатка заднего средостения и прилегающие органы. В абдоминальном отделе пищевод покрыт брюшиной. Пищевод осуществляет активную эвакуацию пищевого комка из глотки в желудок. Анатомически он разделяется на шейную — 5– 8 см, грудную — 15–18 см и абдоминальную — 1–3 см части (рис. 1). В месте перехода глотки в пищевод, на расстоянии 15–16 см от резцов, находится верхнее сужение; на уровне бифуркации трахеи — среднее сужение, а в месте его прохождения через диафрагму, на расстоянии 37–45 см от резцов, располагается нижнее сужение пищевода. В местах этих сужений имеются, так называемые физиологические сфинктеры. Просвет пищевода равняется в среднем 2–3 см, а форма — щелевидная. М 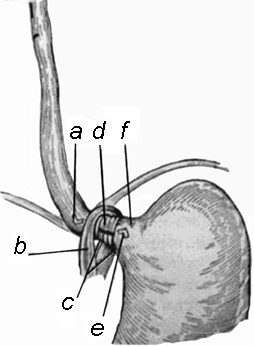 есто перехода пищевода в желудок называется кардией, которая в физиологии пищеварения и патогенеза некоторых заболеваний пищевода занимает важное место (рис. 2). Хотя макроскопический анатомический сфинктер здесь не обнаруживается, однако физиологически и клинически он имеется, что легко обнаруживается при исследованиях: рентгенологически, эндоскопически и внутрипищевод-ной ультрасонографии с манометрией. есто перехода пищевода в желудок называется кардией, которая в физиологии пищеварения и патогенеза некоторых заболеваний пищевода занимает важное место (рис. 2). Хотя макроскопический анатомический сфинктер здесь не обнаруживается, однако физиологически и клинически он имеется, что легко обнаруживается при исследованиях: рентгенологически, эндоскопически и внутрипищевод-ной ультрасонографии с манометрией. Главная функция кардии — пропускать пищевой комок и препятствовать желудочно-пищеводному рефлюксу. В осуществлении замыкательной функции кардии имеет несколько взаимосвязанных факторов и анатомических образований: 1)острый угол Гиса (до 30º) между абдоминальным отделом пищевода и дном желудка, которые под давлением газового пузыря последнего плотно прилегают друг к другу; 2)клапан Губарева из складок слизистой оболочки терминального отдела пищевода3)диафрагмально-пищеводная связка; 4)диафрагмальные ножки, окружающие абдоминальный отдел пищевода и др. Слизистая оболочка пищевода покрыта многослойным плоским эпителием, который на уровне кардии довольно резко переходит в цилиндрический эпителий желудка Подслизистый слой состоит из рыхлой подвижной соединительной ткани, образующей широкие продольные складки слизистой оболочки. В этом слое располагается обильная сосудистая сеть и симпатическое нервное сплетение Мейснера, иннервирующее слизистую оболочку. Наиболее прочным в механическом отношении является подслизистый слой пищевода за счёт наличия здесь эластических волокон. Мышечный слой пищевода состоит из двух слоёв: внутреннего циркулярного и наружного продольного, а между ними располагается парасимпатическое нервное сплетение Ауербаха, иннервирующее мышечные волокна. Наружная соединительнотканная оболочка пищевода наиболее прочна в нижнем отделе грудной его части, где и располагается связочный его аппарат в виде тяжей. В окружающей параэзофагеальной клетчатке заднего средостения проходят артериальные, венозные и лимфатические сосуды, блуждающие нервы, симпатические цепочки и прилегающие соседние органы. Кровоснабжение пищевода по всей его длине происходит из различных источников: шейная часть — из нижних щитовидных, глоточных и подключичных артерий; грудная — из подключичных, бронхиальных и межрёберных артерий, а также непосредственно из аорты; абдоминальная — из левых желудочной и нижне — диафрагмальной артерий. В стенке пищевода имеется интраорганная многослойная коммуникантная сеть артерий, что обеспечивает равномерное распределение артериальной крови по всем слоям. Через хорошо развитые внутриорганные и внеорганные венозные сплетения кровь оттекает в системы парных и полунепарных вен, а, следовательно, в систему верхней полой вены. Причём, обширное сплетение вен подслизистого слоя пищевода является одним из мощных коллекторов связи портальной системы с верхнекавальной, что очень важно для снижения портальной гипертензии. Отток лимфы из внутристеночных сети и сплетений пищевода происходит в регионарные лимфоузлы шеи, заднего средостения, кардии и желудка. Кроме этого, лимфоотток грудного отдела пищевода возможен непосредственно в грудной лимфатический проток, через который возможно метастазирование злокачественных опухолей в отдаленные органы. Иннервация пищевода происходит из блуждающих нервов и пограничных стволов симпатических нервов. Обе ветви вегетативной нервной системы образуют густую нервную сеть как внутри — так и внеорганно, а также через коллатерали имеют связь с другими органами грудной клетки и брюшной полости. Заболевания пищевода.Классификация болезней пищевода А. Врождённые: Атрезии (полное отсутствие пищевода, два изолированных мешка, верхний или нижний конец соединён с трахеей и др.). Стриктуры (продольные, кольцевидные и мембранные). Идиопатическое расширение. Халазия (кардиальная недостаточность). Удвоение пищевода. Неопущение желудка или короткий пищевод. Б. Приобретённые заболевания Функциональные заболевания: а) ахалазия или кардиоспазм; б) эзофагоспазм (дискинезия пищевода); в) халазия (недостаточность кардии). Дивертикулы пищевода: а) глоточно-пищеводные (ценкеровские); б) бифуркационные; в) наддиафрагмальные (эпифренальные). Варикоз вен пищевода (первичная патология). В. Опухоли пищевода (доброкачественные и злокачественные). Методика рентгенологического исследования пищевода Пищевод исследуют натощак. Исследованию пищевода предшествует обзорное исследование грудной клетки и брюшной полости. При этом можно выявить наличие воздуха и жидкости в просвете пищевода, дивертикулах или грыже пищеводного отверстия диафрагмы, состояние газового пузыря желудка. Пищевод исследуется жидкой и густой бариевой взвесью. Вначале больного просят проглотить небольшой глоток стандартной бариевой взвеси. В момент проглатывания оценивают акт глотания, проходимость пищевода, функцию пищеводно-желудочного перехода и поступление бариевой взвеси в желудок. После приема одного – двух глотков бариевой взвеси последний проходит по пищеводу в течение 2-4 секунд, вначале туго заполняя просвет пищевода (фаза тугого наполнения). Тень контрастной массы представляет собой силуэт полости пищевода. На снимках в эту фазу изучают: положение, форму, величину, характер контуров, структуру тени, эластичность стенок, функцию пищевода. При тугом заполнении можно обнаружить различные выпячивания, сужения, искривления, деформацию контуров и обтурацию пищевода. Прием бариевой взвеси сопровождается заглатыванием определенного количества воздуха. Когда контрастное вещество переходит в желудок, в пищеводе в течение короткого времени остается воздух. При этом складки слизистой расправляются, сглаживаются. Воздух на фоне следов бариевой взвеси на внутренней стенке растянутого пищевода создает эффект двойного контрастирования. В эту фазу изучают эластичность стенок, внутреннюю поверхность пищевода – «тонкий рельеф», выявляют мелкие патологические образования – они обмазаны налетом бария и хорошо выделяются на фоне газа. Для получения изображения рельефа слизистой при исследовании пищевода используют густую бариевую взвесь, которая, проходя густым комком, импрегнирует слизистую оболочку, задерживается в межскладочных углублениях и, тем самым, отображает продольный ход складок пищевода. Просветления между полосками контрастной массы являются прямым отображением складок. Рентгеноанатомия пищевода Глотка и верхний отдел пищевода заполняются бариевой взвесью как единое целое, в прямой проекции они имеют вид булавы, в боковой – неправильной воронки. В прямой проекции хорошо видны валлекулы и грушевидные синусы. В боковой проекции задняя стенка глотки прямая и расположена параллельно передней поверхности шейных позвонков. Передняя стенка глотки неровная за счет корня языка, надгортанника, грушевидных синусов и валлекул. Пищевод начинается на уровне VI шейного позвонка, проходит в заднем средостении и заканчивается на уровне X-XI грудных позвонков. Заполненный барием пищевод представляет в рентгенологическом изображении эластичную трубку с практически параллельными наружными контурами. В нижней 1/3 пищевода в наддиафрагмальном пространстве пищевод равномерно суживается. Ширина пищевода зависит от степени наполнения его барием. Когда в нем нет содержимого, пищевод спадается до размеров узкого тяжа. При прохождении большого глотка бария пищевод растягивается, и диаметр его достигает 2,0 – 3,0 см, в местах физиологических сужений - до 1,4 см. В пищеводе различают 3 отдела: Шейный– начинается на уровне нижнего края глотки (С 6) и заканчивается у верхней апертуры грудной клетки (T 1). Длина его составляет 5-8 см. Грудной – расположен в заднем средостении, начинается на уровне верхней апертуры грудной клетки и продолжается до диафрагмы (Т 10 – Т 11), длиной 16-19 см. Брюшной отдел – продолжается от уровня диафрагмы (Т 10 – Т 11) до места впадения в желудок. Длина его – 2,5-5 см. При тугом наполнении в пищеводе выделяются четыре физиологических сужения: перстневидное – на уровне позвонков С 6 – С 7 в месте перехода глотки в пищевод (уровень перстневидно-глоточной мышцы); аортальное – на уровне дуги аорты по левому контуру пищевода (Т 4); бронхиальное – обозначают и как анатомическое и как физиологическое сужение, оно располагается в грудной части пищевода – на уровне бифуркации трахеи в месте отхождения левого главного бронха (Т 5 – Т 6); диафрагмальное — в пищеводном отверстии диафрагмы (Т 10 – Т 11). Жидкая бариевая взвесь проходит по пищеводу за 2-4 сек, растягивая его до 2,0-3,0 см в диаметре. Контуры пищевода ровные, четкие и слегка волнистые при прохождении пологих перистальтических волн. На вдохе, в момент прохождения бария по пищеводу, над диафрагмой образуется локальное расширение – пищеводная ампула (длина 6-7 см и ширина 4-5 см). Пищеводная ампула исчезает во время выдоха и этим отличается от диафрагмальной грыжи, визуализация которой сохраняется в эту фазу дыхания. На уровне X-XI грудных позвонков пищевод впадает в желудок, образуя с медиальным контуром свода желудка острый угол Гиса (примерно 400). Угол Гиса в норме должен быть меньше 900. +Рельеф слизистой пищевода представлен 3-4 продольными складками слизистой, ширина которых не превышает 2 мм. В норме складки в пищеводе имеют прямолинейное направление, одинаковую ширину и непрерывность. Эластичность стенок пищевода выражается в наличии пологих симметричных перистальтических волн в момент прохождения контрастной массы. Эзофагоскопия Это основной метод исследования пищевода, позволяющий не только визуально изучить состояние его стенок, но при необходимости удалить инородное тело, произвести биопсию, выполнить некоторые хирургические манипуляции. Таким образом, эзофагоскопия является диагностической и лечебной процедурой (рис. 2.40 а, б) Эзофагоскопия проводится в сидячем положении больного или лежа. Иногда используют положение на животе с несколько приподнятым ножным концом операционного стола. Это предотвращает затекание слюны в дыхательные пути и задержку желудочного сока и слюны в просвете трубки. Для лучшей ориентации перед эзофагоскопией рекомендуется рентгенологическое исследование пищевода, чтобы выяснить локализацию патологического процесса. Исследование проводится натощак или через 5-6 ч после последнего приема пищи. За 30 мин до выполнения эзофагоскопии взрослому больному подкожно вводят 1 мл 0,1% раствора сульфата атропина и 1 мл 2% раствора промедола. Интубационный наркоз предпочтителен, однако в тех случаях, когда отсутствуют местные и общие отягощающие факторы (перфорация или ранение стенки пищевода, больших размеров инородное тело, общие заболевания и т.д.), эзофагоскопия может быть проведена под местной анестезией. Для обезболивания у взрослых используют 10% раствор лидокаина или кокаина, 2% раствор дикаина с добавлением 0,1% раствора адреналина (по 1 капле на каждый мл раствора). После двукратной пульверизации глотки этим же составом последовательно 3-4 раза смазывают слизистую оболочку глотки и гортани. О наступлении анестезии свидетельствует отсутствие глоточного рефлекса и кашля при смазывании гортаноглотки и входа в пищевод. Перед началом эзофагоскопии выбирают соответствующего размера трубку. Если исследование проводится под местной анестезией, больной сидит на специальном кресле Брюнингса, позади него стоит помощник, удерживающий его голову и плечи в нужном положении. Больной широко раскрывает рот и высовывает язык. Дыхание должно быть ровным. Врач накладывает салфетку на высунутую часть языка и захватывает пальцами левой руки язык так же, как при непрямой ларингоскопии. Правой рукой врач вводит трубку эзофагоскопа с угла рта в ротоглотку, затем строго по средней линии проводит её в гортаноглотку, в это время осматривая валекулы. Отодвигая клювом трубки надгортанник кпереди, трубку продвигают к черпаловидным хрящам. В просвете трубки становится виден рот (вход) пищевода. Затем больного просят сделать глотательное движение, что способствует раскрытию рта пищевода. Голова больного в этот момент не должна быть резко запрокинута назад. Под контролем зрения, направляя трубку точно по средней линии, а клюв проводя несколько кзади от черпаловидных хрящей, в момент раскрытия входа в пищевод трубка продвигается ниже. Непременным условием дальнейшего продвижения эзофагоскопа является совпадение оси трубки и оси пищевода. Шейный отдел пищевода имеет вид сомкнутой звездочки со щелеобразным просветом. Продвинув трубку ещё на несколько сантиметров ниже, попадают в грудную – зияющую часть пищевода, где иногда наблюдается выпячивание и пульсация его левой стенки за счет прилежащей аорты. Видна розовая слизистая оболочка, собранная в продольные складки. Зияние просвета опять исчезает, когда конец трубки доходит до кардиального (желудочного) устья пищевода: здесь просвет имеет вид сомкнутых губ. После прохождения этого препятствия в поле зрения попадает слизистая оболочка желудка, отличающаяся насыщенным розовым цветом. Извлекать трубку следует осторожно, направляя дистальный отдел круговыми движениями по слизистой оболочке и производя тщательный осмотр её (рис.2.41) Чтобы ориентироваться в глубине пищевода, следует помнить, что у взрослых расстояние от переднего края верхних зубов до глоточного устья пищевода равно 14-15 см, а до кардиального устья – 45 см. Эзофагоскопия под наркозом имеет ряд особенностей. Во-первых, врач пальцами левой руки открывает широко рот больного, лежащего на спине. Через угол рта эзофагоскопическую трубку проводят ко входу в пищевод. Совершенно без усилий трубку через рот пищевода вводят в его просвет, однако такого зияния просвета, как при эзофагоскопии под местной анестезией в положении больного сидя, нет. Эзофагоскопия у детей под наркозом не отличается от таковой у взрослых. Однако введение эзофагоскопической трубки под местной анестезией может вызвать нарушение дыхания и сердечной деятельности за счет сдавления гортани и трахеи самой трубкой. Трудности при эзофагоскопии могут быть связаны прежде всего с неблагоприятными анатомическими условиями: короткая шея, высокие верхние зубы, ограничение подвижности нижней челюсти и позвоночника в шейном отделе. У таких больных трубку следует вводить со стороны угла рта. Иногда врач испытывает трудности при введении эзофагоскопа в пищевод. Если голова больного сильно запрокинута, происходит смещение вперед шейных позвонков и шейная часть пищевода сплющивается. Клюв трубки при попытке продвинуть её в пищевод как бы автоматически уходит кзади, упираясь в заднюю стенку гортанной части глотки и заднюю губу пищевода. Чтобы преодолеть это затруднение, голова больного не должна быть сильно запрокинута назад; в момент, когда губы пищевода становятся обозримыми, необходимо осторожно произвести легкие скользящие и вращательные движения трубкой при небольшом давлении, и зев пищевода откроется. При проведении трубки эзофагоскопа со стороны грушевидного кармана, когда дистальный конец трубки чрезмерно отклоняется в противоположную сторону, может быть повреждение стенки грушевидного кармана. Поверхностные повреждения слизистой оболочки пищевода встречаются довольно часто, однако они обычно не влекут серьёзных последствий. Более опасны глубокие повреждения стенки пищевода, особенно прободные. Прободение пищевода может быть в области первого физиологического сужения. Этому благоприятствует, в частности, отсутствие на задней стенке слоя продольных мышечных волокон. При патологических изменениях стенки пищевода (изъязвление, свежий ожог, опухолевый распад) прободение возможно на любом участке. Это приводит к развитию серьёзнейших осложнений - гнойного периэзофагита и медиастинита. +В последние годы для исследования пищевода все шире применяют гибкие эзофагоскопы со стекловолоконной оптикой. Эзофагофиброскопы облегчают проведение исследования. Используя имеющийся в фиброскопе канал, можно аспирировать содержимое пищевода, произвести биопсию, удалить небольшое инородное тело, с помощью специальных насадок выполнить фото- и видеосъёмку. Благодаря значительным техническим преимуществам современных фиброскопов перед линзовыми приборами исследование пищевода и желудка стало менее сложной и более безопасной процедурой. Подготовка к проведению сцинтиграфии пищевода Сцинтиграфию пищевода проводят исключительно на пустой желудок, но при этом пациент не должен чувствовать дискомфорт из-за сильного голода или жажды. В некоторых случаях сильное чувство голода и полностью пустой желудок могут стать причиной неправильных результатов, поэтому в каждом индивидуальном случае врач дает пациентам рекомендации относительно подготовки к сцинтиграфии. Если пациент перед проведением обследования принимал какие-либо медикаментозные препараты, следует сообщить об этом врачу. В некоторых случаях лекарства могут помешать проведению сцинтиграфии, в частности те, которые содержат любое, даже самое минимальное количество йода. ПРОВЕДЕНИЕ СЦИНТИГРАФИИ ПИЩЕВОДА Продолжительность сцинтиграфии пищевода может занимать много времени. Минимум – это двадцать минут, максимум – это шесть-семь часов непрерывного обследования пациента. Длительность диагностики зависит от того, за какой промежуток времени, введенный препарат с радионуклидами достигнет обследуемого органа. Сцинтиграфия пищевода – это возможность обнаружить любые аномалии в развитии органа, проверить рефлекторную функциональность. Процедура отличается высокой степенью безопасности и не приносит ни малейшего вреда организму и здоровью пациента. Пищевую массу помечают изотопным составом. Эта масса, которую пациент употребляет, движется по пищеводу, что и просматривается в процессе сцинтиграфии. В состав пищевой массы добавляется препарат, который называется коллоид технеция. Это радиофармацевтический компонент, микроскопическая доза которого в составе пищи не является вредной и опасной для здоровья. Пациенту предлагают проглотить определенное количество пищи с добавленным радионуклидного препарата, после чего начинается сканирование. При обследовании используется пища полужидкой консистенции. При сцинтиграфии пациента помещают в специальную камеру, которая называется гамма-камерой. В ней, по усмотрению обследующего врача, пациент может стоять, или лежать. При сцинтиграфии пищевода обследуемый не будет чувствовать никаких побочных эффектов, неприятных симптомов. В некоторых случаях врач может принять решение о проведении дополнительного исследования с помощью сцинтиграфии: проверить, как происходит обратное движение пищи по пищеводу, то есть ее эвакуацию из желудка. При проведении сцинтиграфии врач может попросить пациента сменить положение тела, - это необходимо для того, чтобы обследовать работу пищевода, затронув движениями его различные отделы. Сцинтиграфия. это эффективный способ проверить моторно-эвакуаторную функцию пищевода, нарушения и отклонения в ее работе. На просвечиваемых радионуклидами участках хорошо видно, как пища может задерживаться и плохо проходить в пораженных участках пищевода. Полученные результаты сцинтиграфии становятся основанием для постановки диагноза и для назначения соответствующего лечения. Сочетание сцинтиграфии с другими методами исследования Несмотря на то, что сцинтиграфия является вполне самодостаточным способом определения патологий и нарушения в области пищевода, она может являться частью комплексного обследования, включающего еще и эндоскопические, и рентгенологические обследования. Сцинтиграфия может быть назначена пациенту после эндоскопии в случае подозрения на эзофагит. В этом случае назначается манометрия, а также 24-часовая рН-метрия, с помощью которых исследуются гастроэзофагеальные рефлюксы. 38.Грыжи естественных отверстий диафрагмы. |
