МетодКА январь. Лабораторная работа 1 Определение содержания уксусной кислоты 16 в растворе методом кислотноосновного титрования 16
 Скачать 2.03 Mb. Скачать 2.03 Mb.
|
0,3000 г, взвешенную с погрешностью 0,0003 г, помещают в коническую колбу для титрования вместимостью 250 см3, растворяют в смеси 10 см3 воды и 10 см3 HCl (1:3), добавляют воду до общего объема 80 см3, 1 г бромида калия, 2 капли тропеолина 00 и 1 каплю метиленового синего и при постоянном перемешивании медленно (!) титруют раствором NaNO2 до перехода окраски из красно-фиолетовой в голубовато-зеленую. |
| № опыта | Объем сульфани- ловой кислоты, см3 | Объем NaNO2, см3 | Концентрация NaNO2, моль/дм3 | Средняя концентрация NaNO2, моль/ дм3 |
| 1 | 20,00 | | | |
| 2 | 20,00 | | | |
| 3 | 20,00 | | |
ВНИМАНИЕ! Определение выполняют при температуре не выше
18–200С. Скорость титрования должна быть замедленной: сначала
2,00 см3 в 1 мин, в конце титрования – 0,05 см3 в 1 мин.
Расчет массовой доли стрептоцида в препарате ведут по формуле
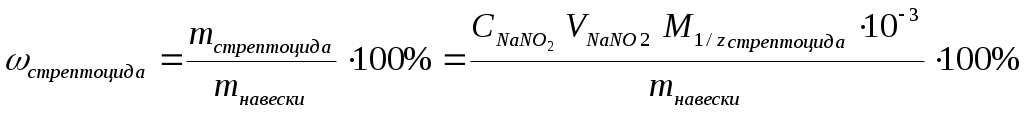 .
.Брутто-формула стрептоцида C6H8N2O2S
М (стрептоцида)=172,20 г/моль.
Результаты титрования заносят в табл. 19.
Согласно Государственной фармакопеи содержание стрептоцида в препарате должно составлять 99,0 %. Рассчитать относительную и абсолютную погрешности метода.
Таблица 19
Результаты титрования стрептоцида
| № опыта | Масса образца стрептоцида, г | Объем NaNO2, см3 | Масса стрептоцида в образце, г | Массовая доля стрептоцида в образце, % | стрептоцида в образце, % |
| 1 | | | m1= | ω1= | |
| 2 | | | m2= | ω2= | |
| 3 | | | m3= | ω3= | |
| 4 | | | m4= | ω4= | |
| 5 | | | m5= | ω5= |
Статистическая обработка результатов анализа
См. лабораторную работу № 1.
Вывод: приводят полученные данные в виде
Контрольные вопросы и задачи к лабораторной работе № 7
Теоретические вопросы
Что является титрантом в нитритометрии?
Применение нитритометрии для анализа восстановителей (Sn2+, Fe2+, As2O3). Напишите уравнения реакций. Предположите ход анализа.
Стандартизация NaNO2 по сульфаниловой кислоте. Напишите уравнения протекающих реакций и обоснуйте ход определения.
Стандартизация NaNO2 по KMnO4. Напишите уравнения протекающих реакций и обоснуйте ход определения.
Напишите реакцию взаимодействия нитрита натрия с ароматическими аминами (реакция диазотирования).
Напишите реакцию взаимодействия нитрита натрия с вторичными аминами, приводящую к образованию нитрозосоединений.
Особенности нитритометрии.
Индикаторы в нитритометрии: внешние и внутренние.
Особенности перманганатометрического титрования.
Особенности приготовления, хранения и применения раствора перманганата калия в окислительно-восстановительном титровании.
Влияние рН раствора на реакции перманганат-иона.
Методика стандартизации перманганата калия по оксалату натрия. Особенности.
Способы титрования, применяемые в перманганатометрии, при определении восстановителей, окислителей.
Задачи
Для анализа стрептоцида взяли навеску массой 0,3000 г. Растворили
в небольшом количестве воды, добавили 10 см3 соляной кислоты (1:3), несколько кристаллов KBr, смешанный индикатор (тропеолин 00
и метиленовый синий) и оттитровали раствором нитрита натрия с молярной концентрацией эквивалента 0,1987 моль/дм3. На титрование затратили
8,75 см3 NaNO2. Рассчитайте содержание стрептоцида в препарате.
Постройте кривые титрования KMnO4→H2C2O4.
Рассчитайте молярную массу эквивалента перманганата калия при использовании его в качестве титранта в кислой среде.
Определите константы равновесия и определите полноту протекания реакций:
2MnO4- + 5C2O42- + 6H+ → 2Mn2+ + 10CO2 + 8H2О
MnO4- + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2О
2MnO4- + 10Cl- + 8H+ → 2Mn2+ + 5Cl2 + 4H2О
2MnO4- + 3Mn2+ + 2H2O → 5MnO2 4H+
Сделайте расчет результатов определения массовой доли дихромата калия в техническом продукте, если для анализа была взята навеска пробы, равная 0,1000 г, и к раствору пробы добавлено 2,6 милиэквивалента
железа (II), на титрование избытка которого пошло 12,00 см3 перманганата калия с концентрацией
Библиографический список
ПриложениЯ
Приложение 1
Константы ионизации важнейших кислот
| № | Название | Формула | Ка | рКа |
| 1 | Аминоуксусная (глицин) | NH2CH2COOH | 1,710-10 | 9,77 |
| 2 | Аскорбиновая К1 К2 | 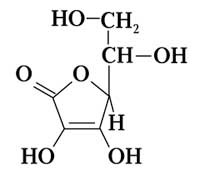 | 9,110-5 4,610-12 | 4,04 11,34 |
| 3 | Валериановая | CH3(CH2)3COOH | 1,410-5 | 4,86 |
| 4 | Винная К1 К2 | HOOCCH(OH)CH(OH)COOH | 1,310-3 3,010-5 | 2,89 4,52 |
| 5 | Кремниевая К1 К2 | H2SiO3 | | |
| 6 | Лимонная К1 К2 К3 К4 | HOOCCH2C(OH)(COOH)CH2COOH | 7,4310-4 2,210-5 4,010-7 1,010-16 | 3,13 4,66 6,40 16,0 |
| 7 | Муравьиная | НСООН | 1,810-4 | 3,75 |
| 8 | Серная К2 | H2SO4 | 1,1510-2 | 1,94 |
| 9 | Сероводородная К1 К2 | H2S | 1,010-7 2,510-13 | 6,99 12,6 |
| 10 | Сульфосалициловая К2 К3 | C6H3(OH)(COOH)SO3H | 3,110-3 2,010-12 | 2,57 11,70 |
| 11 | Угольная К1 К2 | СO2 (aq) + H2O | 4,510-7 4,810-11 | 6,35 10,32 |
| 12 | Уксусная | CH3COOH | 1,7410-5 | 4,76 |
| 13 | Фосфорная К1 К2 К3 | H3PO4 | 7,110-3 6,210-8 5,010-13 | 2,15 7,21 12,36 |
| 14 | Щавелевая К1 К2 | Н2С2О4 | 5,610-2 5,410-5 | 1,25 4,27 |
| 15 | ЭДТУ К1 К2 К3 К4 | 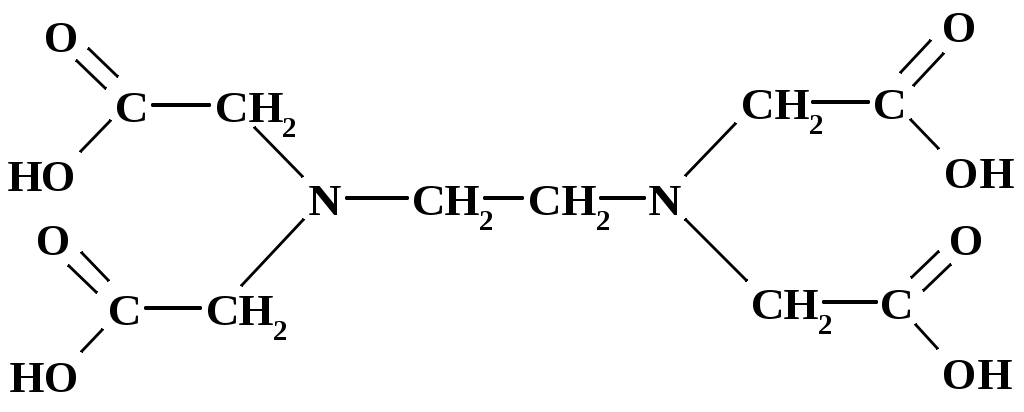 | 1,010-2 2,110-3 6,910-7 5,510-11 | 2,00 2,67 6,16 10,26 |

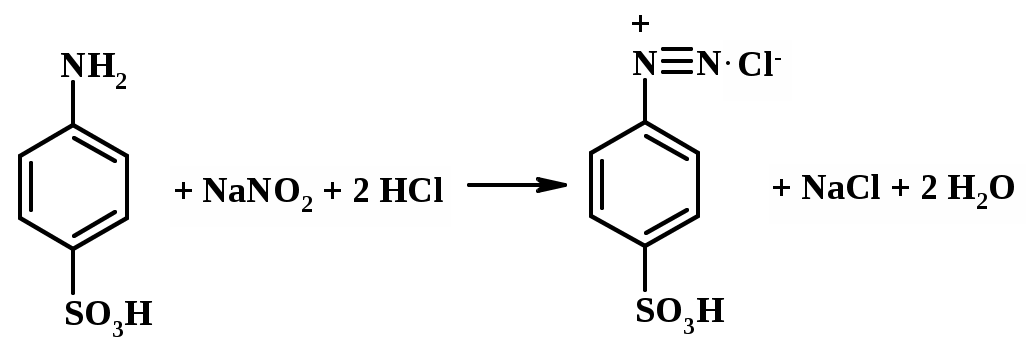
 Навеску САП
Навеску САП