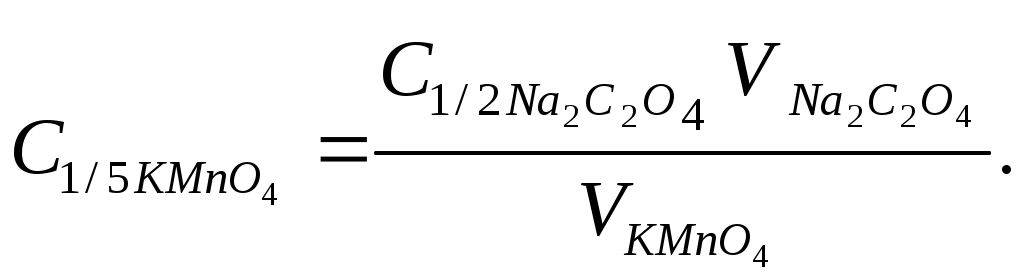|
|
МетодКА январь. Лабораторная работа 1 Определение содержания уксусной кислоты 16 в растворе методом кислотноосновного титрования 16
Индикация точки эквивалентности
при окислительно-восстановительном титровании
При титровании, основанном на реакциях окисления или восстановления определяемого вещества, изменяется окислительно-восстановительный потенциал системы, наиболее резкое изменение наблюдается вблизи точки эквивалентности.
Окислительно-восстановительными индикаторами являются вещества, которые изменяют окраску при определенном окислительно-восстановительном потенциале, которого система достигает в процессе титрования, подобно тому, как при кислотно-основном титровании пользуются индикаторами, изменяющими окраску при определенном значении рН раствора.
В окислительно-восстановительных методах применяют несколько различных способов индикации точки эквивалентности.
1. Безындикаторное титрование. При этом в конце титрования наблюдается исчезновение или появление окраски, характерное для данного рабочего раствора или для данного определяемого вещества.
К этой группе можно отнести перманганатометрическое титрование,
в котором в качестве титранта используется раствор перманганата калия, являющийся одновременно рабочим раствором и индикатором. После достижения точки эквивалентности избыточная капля титранта придает титруемому раствору отчетливо видимую розовую окраску.
2. Использование специфических реактивов в качестве индикаторов.
В йодметрии (при титровании йодом или тиосульфатом натрия)
в качестве индикатора применяется свежеприготовленный 0,5-ный % раствор крахмала, который с йодом образует адсорбционное соединение интенсивно–синего цвета.
3. Индикаторы, изменяющие окраску в зависимости от окислительно-восстановительного потенциала системы(прил. 7).
Основным достоинством этой группы индикаторов является возможность применения их для различных окислительно-восстановительных методов. Практическое значение имеет лишь небольшое их число. Основные трудности использования связаны с влиянием рН раствора и недостаточной скоростью изменения окраски.
Индикаторы данной группы характеризуются равновесием окисленной формы (IndOx) и восстановленной формы (IndRed), которые имеют различную окраску.
IndOx+ ne IndRed .
Выражение для окислительно-восстановительного потенциала имеет вид

4. Электрохимическая индикация точки эквивалентности.Физико-химические методы анализа: потенциометрическая индикация точки эквивалентности, амперометрическая индикация точки эквивалентности.
Перманганатометрия
Титрантом является раствор перманганата калия KMnO4, являющийся сильным окислителем. Основное уравнение:
MnO4-+8H++ 5e = Mn2+ + 4H2O, 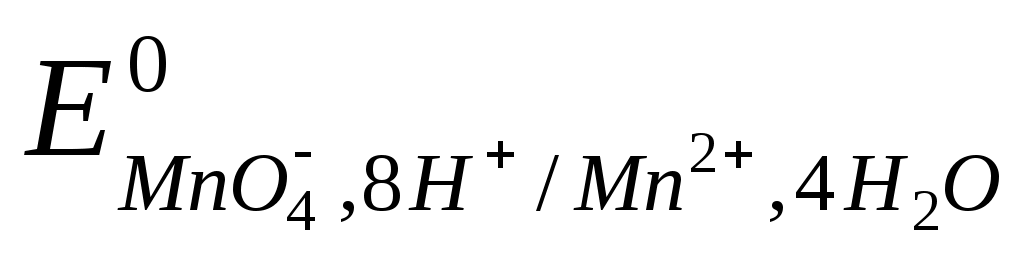 =+1,51 В. =+1,51 В.
М1/z(KMnO4)=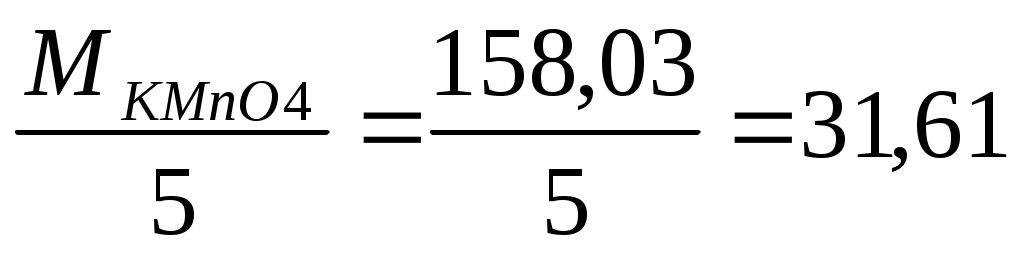 г/моль. г/моль.
В слабокислых, нейтральных и слабощелочных средах вследствие меньшего окислительно-восстановительного потенциала перманганат-ион восстанавливается до Mn+4.
MnO4-+2H2O + 3e = MnО2 + 4OH-, 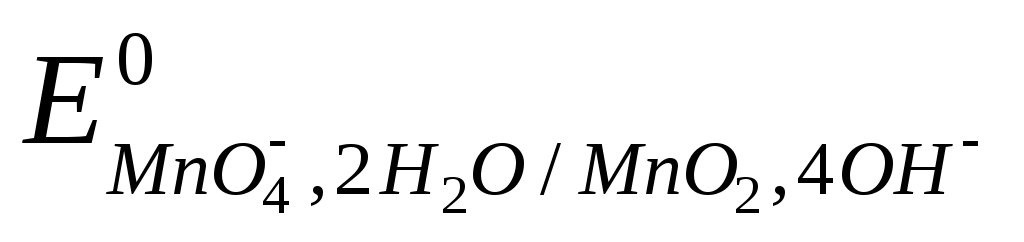 = +0,60 В. = +0,60 В.
М1/z (KMnO4)= 158,03/3= 52,68 г/моль. 158,03/3= 52,68 г/моль.
В щелочной среде раствор перманганата калия восстанавливается
до Mn+6.
MnO4-+ 1e = MnO42- , 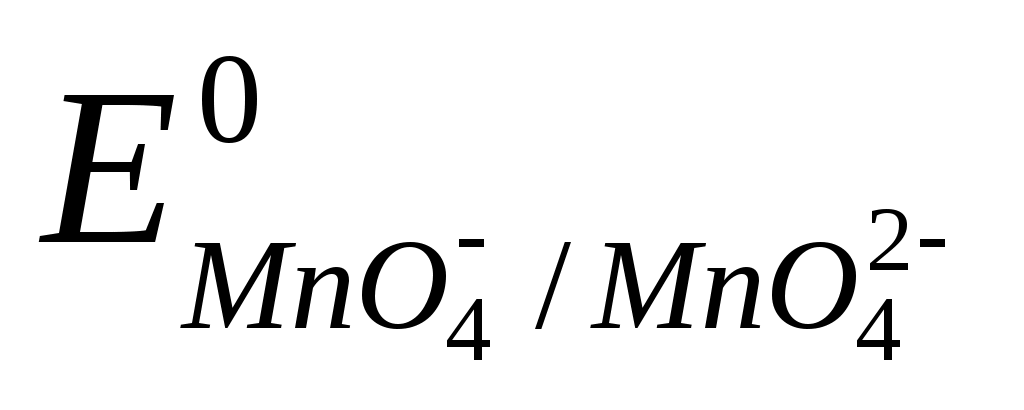 = +0,558 В. = +0,558 В.
М1/z (KMnO4)=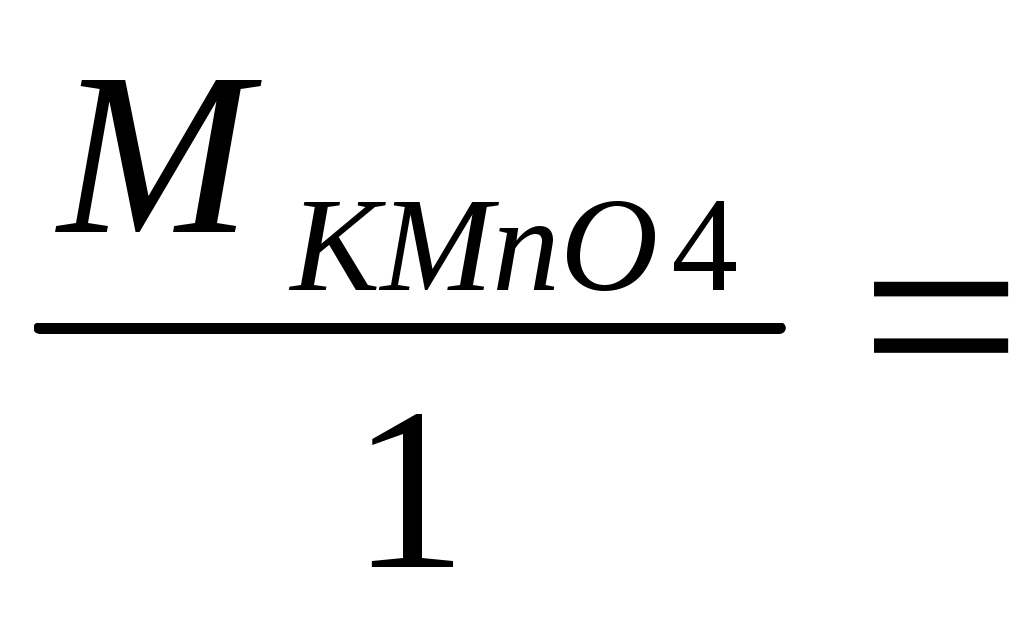 158,03 г/моль. 158,03 г/моль.
Для исключения побочных реакций титрование перманганатом калия проводят в кислой среде, которую создают серной кислотой. Соляную кислоту для создания среды применять не рекомендуется, так как перманганат калия способен окислять хлорид-ион.
2Cl- – 2e = Cl2 , 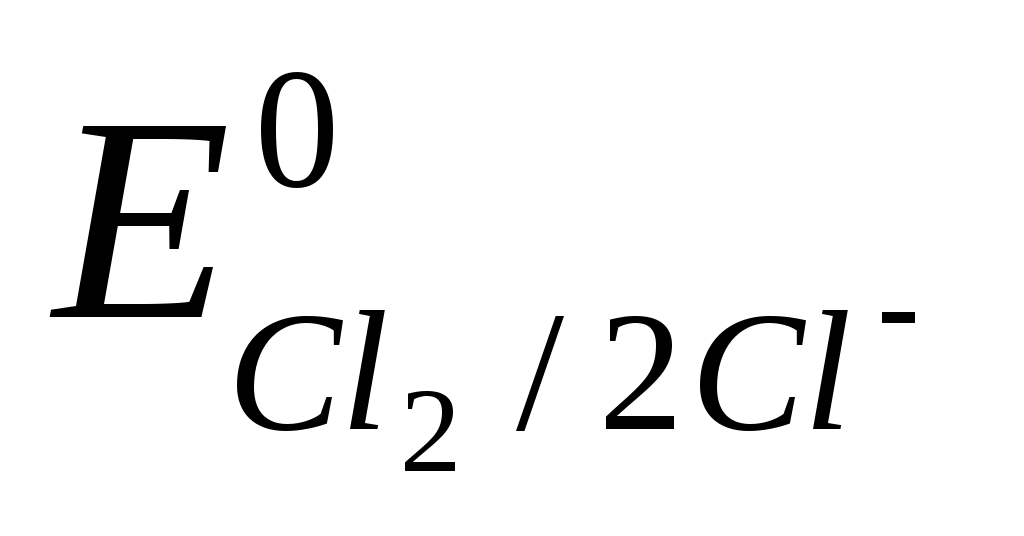 = +1,359 В. = +1,359 В.
Наиболее часто перманганат калия применяют в виде раствора
с молярной концентрацией эквивалента
0,05 – 0,1 моль/дм3. Он не является первичным стандартом в силу того, что водные растворы перманганата калия способны окислять воду и органические примеси в ней:
4MnO4- + 2H2O = 4MnО2+ 3O2+ 4OH-
Разложение растворов перманганата калия ускоряется в присутствии диоксида марганца. Поскольку диоксид марганца является продуктом разложения перманганата, этот осадок оказывает автокаталитический эффект на процесс разложения.
Твердый перманганат калия, применяемый для приготовления растворов, загрязнен диоксидом марганца, поэтому приготовить раствор из точной навески нельзя. Для того чтобы получить достаточно устойчивый раствор перманганата калия, его после растворения навески KMnO4 в воде оставляют в темной бутыли на несколько дней (или кипятят), а затем отделяют MnO2 фильтрованием через стеклянный фильтр (применять бумажный фильтр нельзя, так как он реагирует с перманганатом калия, образуя диоксид марганца).
Окраска раствора перманганата калия настолько интенсивна,
что индикатор в этом методе не требуется. Для того чтобы придать заметную розовую окраску 100 см3 воды, достаточно 0,02 – 0,05 см3 раствора KMnO4
с молярной концентрацией эквивалента 0,1 моль/дм3 (0,02 М). Окраска перманганата калия в конечной точке титрования неустойчивая и постепенно обесцвечивается в результате взаимодействия избытка перманганата
с ионами марганца (II), присутствующими в конечной точке в относительно большом количестве:
2MnO4-+ 3Mn2+ + 2H2O « 5MnО2 + 4H+
Стандартизацию рабочего раствораKMnO4 проводят по оксалату натрия или щавелевой кислоте (свежеперекристаллизованной и высушенной при 105°С).
Используют растворы первичных стандартов с молярной концентрацией эквивалента С (½ Na2C2O4) = 0,1000 или 0,05000 моль/л.
C2O42- – 2e 2CO2 , 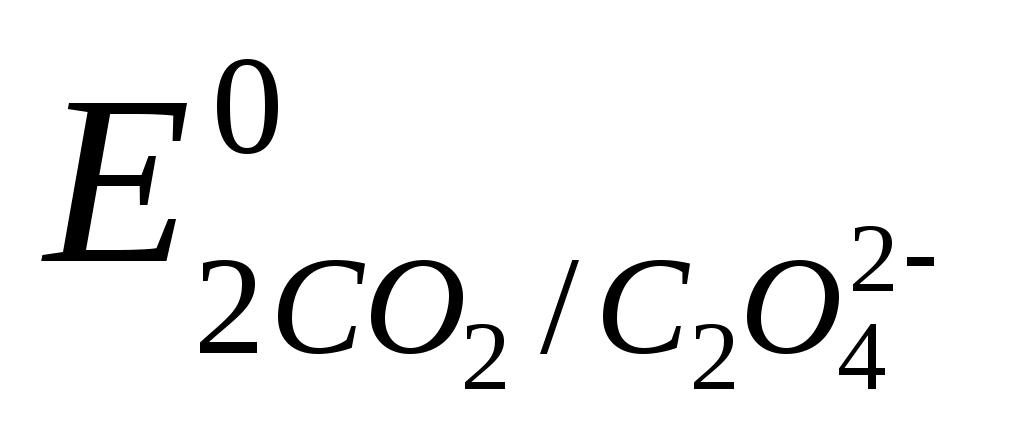 = -0,49 В = -0,49 В
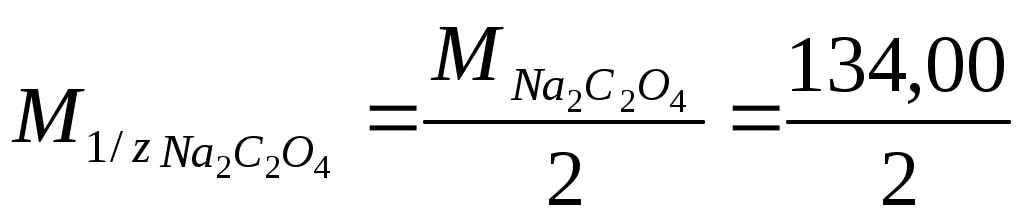 = 67,00 г/моль. = 67,00 г/моль.
При титровании происходит следующая реакция:
5Na2C2O4 + 2KMnO4 + 8H2SO4 = K2SO4 + 2MnSO4 + 10CO2 + 5Na2SO4 +8H2O
При комнатной температуре эта реакция протекает медленно и является автокаталитической (Mn2+ является катализатором реакции взаимодействия перманганата калия с оксалатом натрия), поэтому для ускорения реакции раствор разбавляют горячей водой и ведут титрование при температуре
60–70°С. Первая порция титранта обесцвечивается медленно. После
её обесцвечивания и накопления Mn2+ реакция протекает с достаточно высокой скоростью.
Молярную концентрацию эквивалента KMnO4 вычисляют по формуле
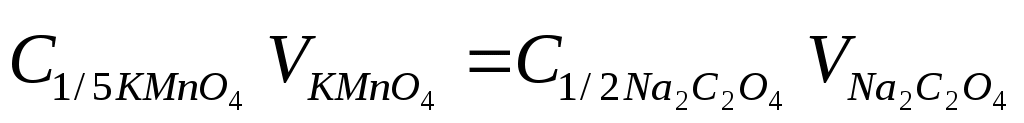 , ,
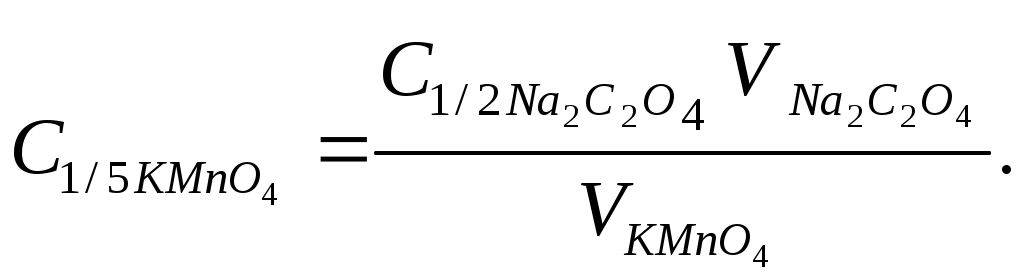
В методе перманганатометрии восстановители (щавелевую, муравьиную, сероводородную и некоторые другие кислоты, перекись водорода, соли железа (II), бромид–ион) определяют способом прямого титрования, а окислители – способом обратного титрования (определение K2Cr2O7 в техническом образце).
Перманганатометрия применяется для стандартизации нитрита натрия при определении сульфаниламидных препаратов (см. лаб. работу № 7).
Хроматометрия
Хроматометрией называют метод объемного анализа, основанный на использовании в качестве титранта раствора дихромата калия K2Cr2O7 или (реже) хромата калия K2CrO4.
Обычно титрование проводят в кислой среде (сернокислой, солянокислой или фосфорнокислой средах). Дихромат калия в кислой среде является довольно сильным окислителем.
Cr2О72- + 6 e + 14H+ 2Cr3+ + 7H2O, 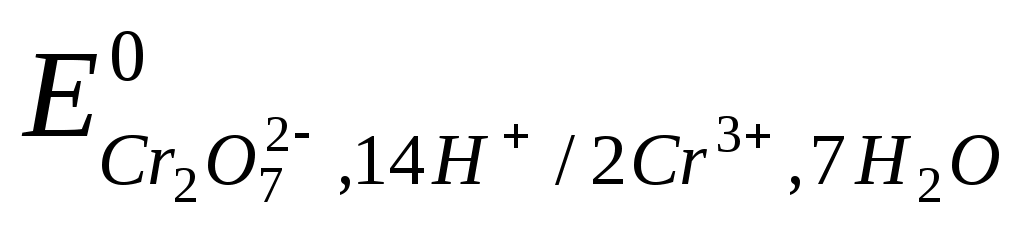 = +1,31 В = +1,31 В
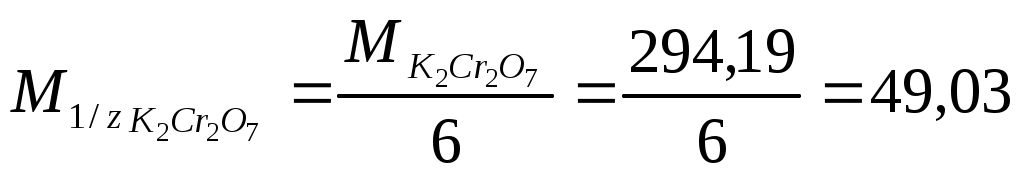 г/моль. г/моль.
Соединения Cr (VI) обладают большей окислительной способностью, чем элементарный йод 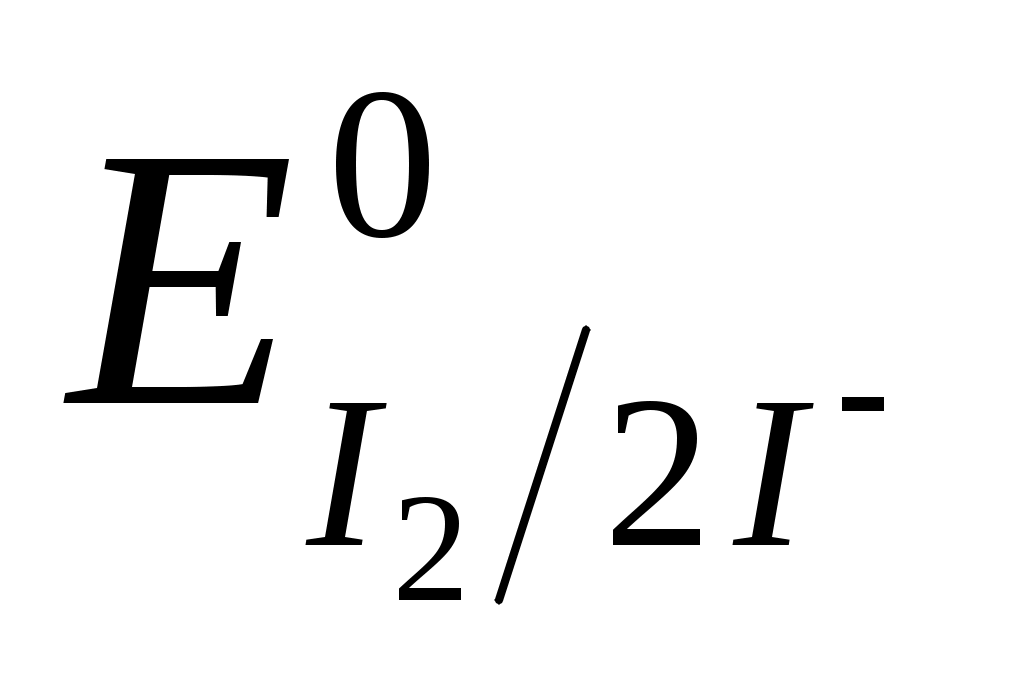 = + 0,54 В, но меньшей, чем перманганат-ион = + 0,54 В, но меньшей, чем перманганат-ион 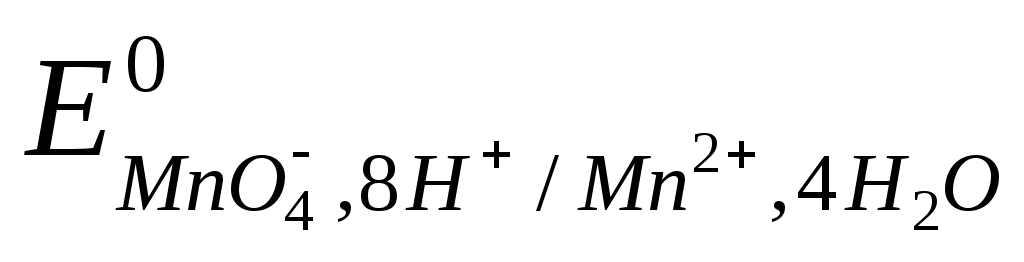 = +1,51 В. = +1,51 В.
Продажный химически чистый дихромат калия можно применять для приготовления первичных стандартов, после перекристаллизации
и высушивания при 105–110°С. Наиболее часто дихромат калия применяют в виде раствора с молярной концентрацией эквивалента 0,1000 моль/дм3, приготовленного из точной навески при растворении в точном объеме воды.
Хотя растворы дихромата калия окрашены в оранжевый цвет, интенсивность окраски недостаточна для определения конечной точки титрования. В дихроматометрическом титровании применяют
ОВ – индикаторы: дифениламин (с переходом окраски от бесцветной до темно-фиолетовой), дифениламиносульфокислоту (с переходом окраски от зеленой до фиолетовой), фенилантраниловую кислоту (с переходом окраски от бесцветной до красно-фиолетовой). Конечную точку титрования (точку эквивалентности) можно зафиксировать инструментальными методами (потенциометрическое титрование, кондуктометрическое титрование и др.).
Дихромат калия способен окислять многие неорганические и органические вещества: Fe (II), W (III), Mo (V), Ti (III) спирты, гидрохинон, глицерин, аскорбиновую кислоту, тиомочевину и др.
Дихромат калия является первичным стандартом для многих окислительно-восстановительных методов:
для йодометрии (см. лабораторную работу № 5);
при титровании солью Мора.
Йодметрия
Йод имеет несколько степеней окисления и в растворе может существовать в виде нескольких частиц: I-, I2, IO32-.
Йод кристаллический плохо растворим в воде и хорошо растворим
в спирте. Для увеличения его растворимости в воде растворение ведут в йодиде калия, где он образует комплексное соединение – трийодид-ион I- I2 = I3- , проявляющее окислительные свойства [9]:
I3- + 2e 3I- .
Эту реакцию чаще всего пишут в упрошенном виде, а именно:
I2 +2e 2I- ; 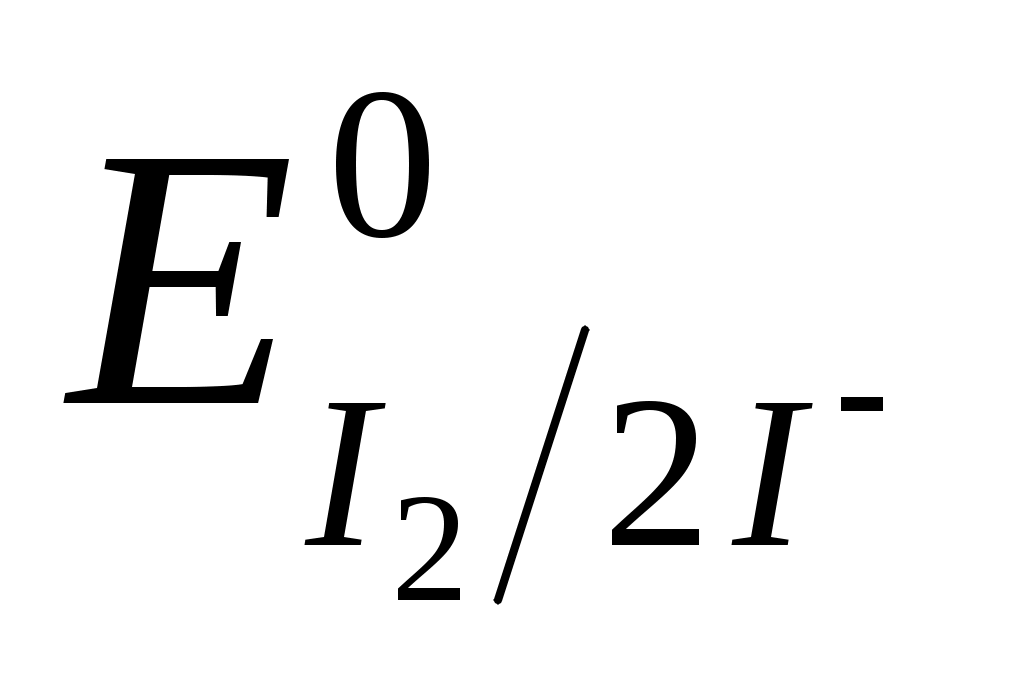 = +0,54 В. = +0,54 В.
Раствор йода обычно готовят приблизительной концентрации
(0,05–0,1 моль/дм3), а затем перед использованием его концентрацию устанавливают по подходящему стандартному раствору (тиосульфат натрия, оксид мышьяка (III)). Растворы йода неустойчивы, так как йод – это летучее вещество, а также действует на резиновые и корковые пробки. Йодид–ионы легко окисляются кислородом воздуха:
4I- + O2 + 4H+ 2I2 + 2H2O.
Эта реакция ускоряется на свету, при нагревании и в присутствии кислот, поэтому раствор йода хранят «на холоду» и в темных бутылях с притертой стеклянной пробкой.
Определение восстановителей (SO32-, S2O32-, S2-, SCN-, AsO33-, Cr2+, HCHO, N2H2) проводят методом прямого титрования раствором I2 (йодиметрия).
Na2SO3 + I2 + 2 NaOH = Na2SO4 + 2NaI + H2O
H2S + I2 = S + 2HI
Для случаев, когда вещество реагирует с раствором йода медленно, используют метод обратного титрования (по остатку): вводят фиксированный избыток йода в раствор, оставляют его на 5–7 минут (закрытый часовым стеклом), а затем остаток йода оттитровывают раствором тиосульфата натрия.
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Для определения окислителей (Cu2+, Fe3+, Mn3+, Mn (IV), Pb (IV), As (V)) применяют титрование по замещению (йодометрия): к анализируемому раствору приливают раствор KI и выделившийся I2 титруют раствором тиосульфата натрия. Количество образовавшегося йода химически эквивалентно количеству окислителя:
2Cu2+ + 4I- = 2CuI + I2
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Раствор тиосульфата натрия в иодометрическом методе является титрантом. Он проявляет свойства восстановителя:
2S2O32- - 2e S4O62- , 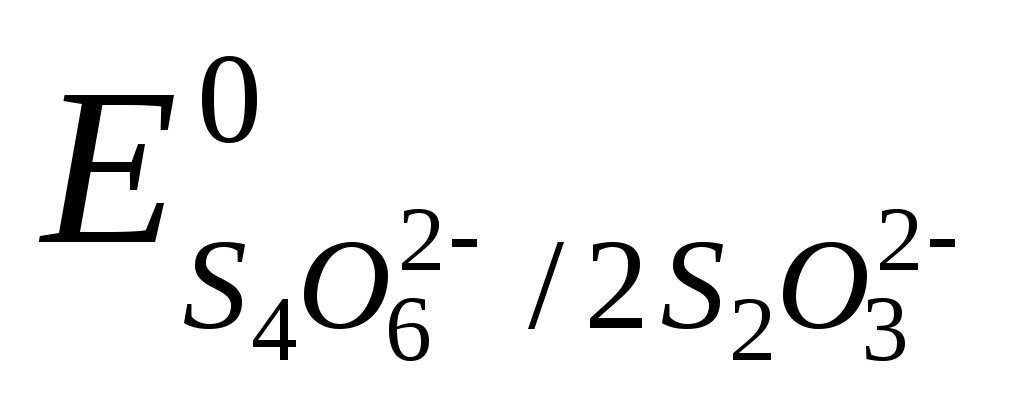 = +0,09 В. = +0,09 В.
Тиосульфат натрия не является первичным стандартом в силу того,
что его растворы неустойчивы при хранении, мутнеют за счет поглощения CO2 из воздуха (выделяется элементарная сера):
S2O32- + H2O+CO2 HCO3- + HS2O3– HCO3– + HSO3– + S
В присутствии сильных кислот, на свету и при уменьшении концентрации тиосульфата натрия разложение ускоряется:
S2O32- + H+ HS2O3– HSO3– + S
В присутствии серобактерий тиосульфат натрия разлагается на сульфит, сульфат и элементарную серу, поэтому его раствор с молярной концентрацией эквивалента
0,1 хранят в темных, закрытых бутылях.
Стандартизуют раствор тиосульфата натрия с использованием первичных стандартов (KIO3, КВrO3, K2Cr2O7), выделяющих при взаимодействии с избытком йодид-ионов известное количество йода, которое титруют раствором Na2S2O3.
K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Концентрацию тиосульфата рассчитываем по закону эквивалентов:
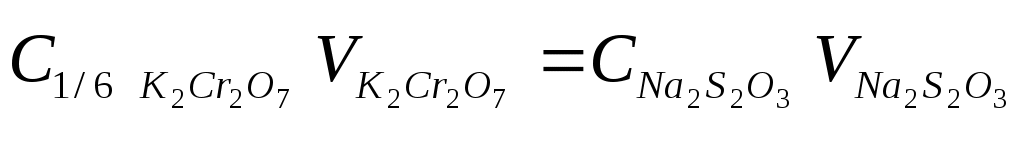 . .
Существует несколько способов определения конечной точки при титровании йодом. При титровании бесцветных растворов достаточно интенсивной является собственная окраска трийодид-иона: 1 капля раствора йода молярной концентрации эквивалента 0,1 моль/дм3 окрашивает 100 см3 раствора в желтый цвет.
Наиболее широко используемым индикатором в йодметрии является свежеприготовленный 0,1– ный % раствор крахмала, придающий раствору, содержащему следы йода, интенсивную синюю окраску. Раствор крахмала при прямом титровании йодом добавляют в начале, а в остальных методах – в конце титрования, т.е. когда йода в растворе осталось малое количество (раствор из бурого стал бледно-желтым), так как крахмал, добавленный в раствор
с высокой концентрацией йода, разрушатся с образованием продуктов, являющихся не полностью обратимыми индикаторами. Титрование продолжают до исчезновения синей окраски крахмала.
Источники ошибок в йодометрических методах
Окисление йодид-иона кислородом воздуха:
4I- + O2 + 4H+ 2I2 + 2H2O
скорость этой реакции очень мала, поэтому при титровании удалять растворенный кислород из всех растворов не обязательно. Для удаления растворенного кислорода из растворов к ним добавляют бикарбонат натрия или продувают углекислый газ.
Летучесть выделившегося йода. Для того чтобы избежать ошибок
за счет летучести йода, растворы хранят в закрытых сосудах и избегают
их нагревания, а при косвенном титровании после добавления KI колбы
с раствором закрывают часовым стеклом и оставляют в темноте на 5–7 минут,
а затем быстро титруют.
Разложение растворов тиосульфата натрия.
Щелочные растворы. В щелочных растворах происходит образование гипоиодита:
I2 + OH- HOI + I-
3HOI+ 3OH- IO3- + 2I- +3H2O
В связи с этим титрование тиосульфатом натрия необходимо вести при
рН=7–10, а если необходимо титрование в кислой среде, то титрование ведут очень медленно при тщательном перемешивании.
Преждевременное добавление крахмала. Правильный способ применения крахмала в качестве индикатора описан выше.
|
|
|
 Скачать 2.03 Mb.
Скачать 2.03 Mb.