МетодКА январь. Лабораторная работа 1 Определение содержания уксусной кислоты 16 в растворе методом кислотноосновного титрования 16
 Скачать 2.03 Mb. Скачать 2.03 Mb.
|
|
4. Статистическая обработка результатов анализа [5]. Результаты располагают в порядке возрастания. Выявляют грубые погрешности (промахи). Для выявления грубых погрешностей имеется простая методика, основанная на использовании Q-критерия: Q где R – размах варьирования; R=Xmax- Xmin; X1 – первый (последний) результат; X2– соседнее значение по ряду. Если Qрассч Qтабл, следовательно проверяемый результат не является грубым промахом и остается в выборке, если же Qрассч Qтабл – проверяемый результат является грубой погрешностью и должен быть исключен из выборки. Qтабл зависит от числа проведенных опытов (n) и доверительной вероятности (Р) (прил. 8)[6]. Рассчитывают: среднее арифметическое стандартное отклонение относительное стандартное отклонение доверительный интервал для среднего где Записывают результат анализа в виде Вывод: приводят полученные данные в виде лабораторная работа 2 Определение содержания этилендиамина в растворе методом кислотно-основного титрования Цель работы: 1) закрепление теоретических знаний о методе кислотно-основного титрования (метод нейтрализации); 2) освоение приемов работы с мерной посудой и аналитическим оборудованием (аналитические весы); 3) практическое применение метода кислотно-основного титрования для определения массы этилендиамина (ЭДА) в растворе. Реактивы Карбонат натрия Na2CO3 (х.ч.) – первичный стандарт. Н2О дистиллированная. Хлороводородная кислота НСl концентрации 1:1 (=1,095 г/см3). Кислотно-основной индикатор (выбирают по кривой титрования). Смешанный индикатор – метиловый оранжевый и метиленовый синий2. Ход выполнения работы: 1. Приготовление первичного стандарта карбоната натрия (Na2CO3). Раствор карбоната натрия готовят объёмом 200,00 см3 с молярной концентрацией эквивалента Расчет массы навески, г: Уравнения реакции: Na2CO3 + HCl = NaHCO3 + NaCl NaHCO3 + HCl = NaCl + H2O + CO2↑ _____________________________________ Na2CO3 +2HCl = 2NaCl + H2O + CO2↑ H2CO3 – слабая кислота (Ka1 = 10-6,35 , Ka2 = 10-10,32 ). Взятие навески (взвешивание): Масса часового стекла (стакана) Масса часового стекла (стакана) с навеской Масса навески Навеску количественно переносят в мерную колбу ( и тщательно перемешивают. Фактическую концентрацию первичного стандарта рассчитывают по формуле 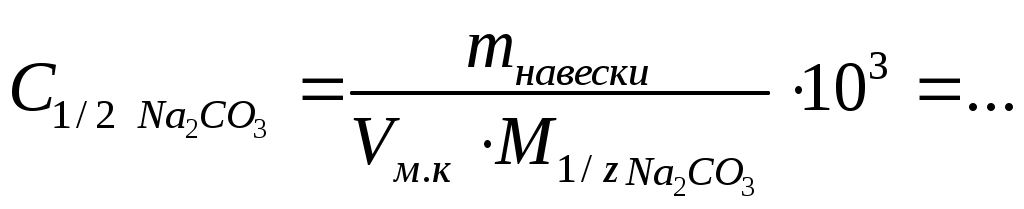 2. Приготовление и стандартизация титранта (раствора HCl) Раствор хлороводородной кислоты готовят объемом примерно 500 см3 с молярной концентрацией эквивалента примерно 0,05÷0,06 моль/дм3) Титрант – раствор хлороводородной кислоты приблизительной концентрацией 0,05 моль/дм3 готовят из хлороводородной кислоты, разбавленной 1:1 (=1,095 г/см3). Стандартизацию раствора HCl проводят по первичному стандарту Na2CO3 прямым титрованием, способом пипетирования. Индикатор выбирают по кривой титрования карбоната натрия хлороводородной кислотой (рис. 4). 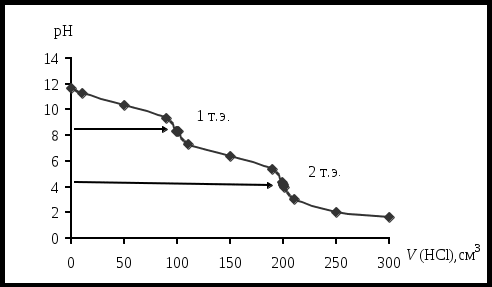 Рис. 4. Кривая титрования 100,00 см3 раствора Na2CO3 с С = 0,1000 моль/дм3 раствором HCl с С1/z = 0,1000 моль/дм3 При титровании до второй точки эквивалентности используют индикатор метиловый оранжевый, 0,1%-ный водный раствор (рТ = 4,0). Изменение окраски от желтой до оранжевой (цвет «чайной розы»). Интервал перехода (рН = 3,1 – 4,4) [6]. Схема 3. Стандартизация раствора HCl  В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту 25,00 см3 стандартного раствора Na2CO3 (пипеткой), добавляют 2 – 3 капли метилового оранжевого, разбавляют водой до 50 – 75 см3 и титруют раствором хлороводородной кислоты до перехода окраски из желтой в цвет «чайной розы» от одной капли титранта. Титрование проводят в присутствии «свидетеля» (исходный раствор Na2CO3 с индикатором). Результаты титрования заносят в табл. 4. Концентрацию хлороводородной кислоты определяют по закону эквивалентов: Таблица 4 Результаты стандартизации раствора соляной кислоты
3. Определение содержания этилендиамина в исследуемом растворе Методика определения аналогична стандартизации кислоты. Основное уравнение титрования: 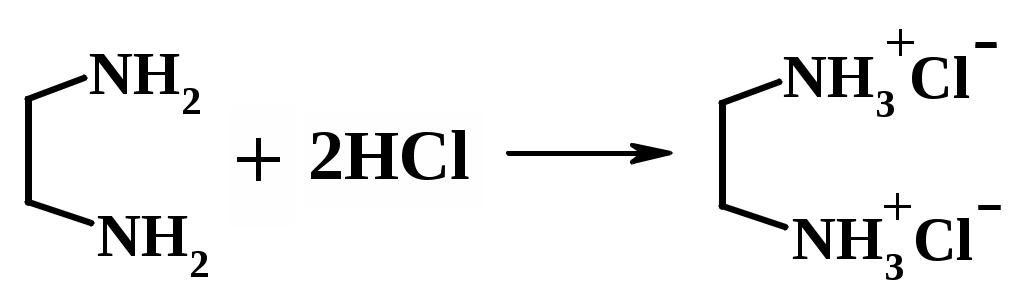 Кривую титрования этилендиамина (ЭДА) раствором соляной кислоты строят самостоятельно и выбирают индикатор. Раствор задачи в мерной колбе доводят до метки дистиллированной водой и тщательно перемешивают. Схема 4. Определение содержания этилендиамина в растворе  В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту 25,00 см3 исследуемого раствора ЭДА (пипеткой), добавляют 2 – 3 капли смешанного индикатора (метиловый оранжевый и метиленовый синий), разбавляют водой 50 – 70 см3) и титруют стандартизованным раствором соляной кислоты до изменения окраски раствора от одной капли титранта из зеленой в фиолетовую. Результаты титрования заносят в табл. 5. Таблица 5 Результаты титрования раствора этилендиамина
Статистическая обработка результатов анализа См. лабораторную работу № 1. Вывод: приводят полученные данные в виде Контрольные вопросы и задачи к лабораторным работам № 1,2 Теоретические вопросы Классификация методов титриметрического анализа: а) по количеству вещества, используемого для анализа; б) по типу химической реакции, лежащей в основе метода; в) по принципу фиксации точки эквивалентности. Основные требования, предъявляемые к методам анализа. Цель проведения анализа. Этапы выполнения анализа. Суть титриметрического метода анализа. Способы титрования и расчеты результатов титрования. Требования, предъявляемые к веществам, используемым в качестве первичных стандартов (примеры первичных стандартов). Способы выражения концентрации растворов. Взаимосвязь между ними. Расчет массы навески для приготовления первичных стандартов. Реакция, лежащая в основе кислотно-основного титрования, суть реакции. Смысл понятий «кислота» и «основание» в свете теории Бренстеда-Лоури. Что такое сопряженная кислота и основание? Приведите примеры сопряженных пар. Количественная характеристика силы кислот и оснований. Оказывает ли какое-либо влияние на силу кислот и оснований растворитель? Ответ поясните примерами. Общие положения метода кислотно-основного титрования. Титранты в кислотно-основном титровании и требования, предъявляемые к ним. Способы регистрации точки эквивалентности при кислотно-основном титровании. Механизм действия кислотно-основных индикаторов. Закономерность изменения концентрации реагирующих веществ при кислотно-основном титровании. Кривые титрования. Скачок титрования. Назначение кривых титрования. Факторы, влияющие на вид кривой титрования (природа вещества, концентрация, температура). Ионная сила раствора. Формулы для расчета. Выбор индикатора по кривой титрования. Метод пипетирования и метод отдельных навесок. Достоинства и недостатки методов. Вывод формул для вычисления рН в растворах слабых кислот и оснований. Отличие сильной кислоты от слабой. Степень диссоциации электролита. Вывод формул для вычисления рН в растворах катионных и анионных кислот и оснований (гидролизующихся солей). Буферные растворы (определение, примеры, применение). Вычисление значения рН буферного раствора. Механизм действия буферных растворов. Сформулируйте общие выводы по методу кислотно-основного титрования. Достоинства и недостатки метода. Основные правила техники безопасности при работе с кислотами и щелочами. Особенности приготовления, стандартизации и хранения рабочих растворов. Титранты в кислотно-основном титровании. Формулы для вычисления рН водных растворов электролитов. Понятие о буферных растворах. Кривые титрования в кислотно-основном методе. Способы регистрации точки эквивалентности. Индикаторы, применяемые в кислотно-основном титровании. Практические вопросы Стандартизация растворов для кислотно-основного титрования: а) NaOH; б) HCl. Подберите титрант и индикатор для определения: а) этилендиамина (аммиака, бензиламина, триметиламина и т. д.); б) уксусной кислоты (лимонной кислоты, винной кислоты, салициловой кислоты и т. п.); в) карбоната натрия. Поясните ход определения. Задачи Сформулируйте понятие эквивалента в кислотно-основных реакциях [6]. Вычислите величину эквивалентов соды и фосфорной кислоты в следующих реакциях: Na2CO3 + HCl = NaHCO3+NaCl Na2CO3 + 2HCl = 2NaCl + CO2 + H2O H3PO4 + NaOH = NaH2PO4 + H2O H3PO4 + 2NaOH = Na2HPO4 + H2O H3PO4 + 3NaOH = Na3PO4 + 3H2O Напишите уравнения реакций между соляной кислотой, серной кислотой, гидроксидом натрия, гидроксидом алюминия, карбонатом натрия, гидрокарбонатом калия и рассчитайте эквивалентную массу этих веществ. Постройте кривую титрования 100,00 см3 соляной кислоты с молярной концентрацией эквивалента 0,1 моль/дм3 гидроксидом натрия с молярной концентрацией эквивалента 0,1 моль/дм3. Выберите возможные индикаторы и рассчитайте индикаторную погрешность титрования. Постройте кривую титрования 100,00 см3 акриловой кислоты (CH2=CHCOOH, pKa= 4,26) с молярной концентрацией эквивалента 0,1 моль/дм3 гидроксидом натрия с молярной концентрацией эквивалента 0,1 моль/дм3. Как изменяется состав раствора в процессе титрования? Выберите возможные индикаторы и рассчитайте индикаторную погрешность титрования. Постройте кривую титрования гидразина (N2H4+H2O, pKb= 6,03) с молярной концентрацией эквивалента 0,1 моль/дм3 соляной кислотой с молярной концентрацией эквивалента 0,1 моль/дм3. В чем сходство и различие расчетов рН и кривой титрования в сравнении с кривой титрования слабой кислоты щелочью? Выберите возможные индикаторы и рассчитайте индикаторную погрешность титрования. Вычислите коэффициенты активности и активные концентрации ионов в 0,001 М растворе сульфата алюминия, 0,05 М карбоната натрия, 0,1 М хлорида калия. Вычислите рН 0,20 М раствора метиламина, если его ионизация в водном растворе описывается уравнением В + Н2О = ВН + + ОН , Кb = 4,6 10 3, где В – основание. Вычислить константу диссоциации хлорноватистой кислоты HOCl, если 1,99 102 М раствор имеет рН = 4,5. Вычислите рН раствора, содержащего 6,1 г/моль гликолевой кислоты (СH2(OH)COOH, Ка= 1,5 104). Вычислите рН раствора, полученного смешением 40 мл 0,015 М раствора хлороводородной кислоты с: а) 40 мл воды; б) 20 мл 0,02 М раствора гидроксида натрия; в) 20 мл 0,02 М раствора гидроксида бария; г) 40 мл 0,01 М раствора хлорноватистой кислоты, Ка=5,0 108. Вычислите концентрацию ацетат-иона в растворе уксусной кислоты c массовой долей 0,1 %. Вычислите концентрацию иона аммония в растворе аммиака c массовой долей 0,1 %. Рассчитайте массу навески карбоната натрия, необходимую для приготовления 250,00 мл 0,5000 М раствора [7]. Рассчитайте объем раствора соляной кислоты с молярной концентрацией эквивалента 11 моль/л и объем воды, которые необходимо взять для приготовления 500 мл 0,5 М раствора соляной кислоты. В 300 мл 0,3 %-ного раствора хлороводородной кислоты растворили 0,15 г металлического магния. Вычислите молярную концентрацию ионов водорода, магния и хлора в полученном растворе. При смешении 25,00 мл раствора серной кислоты с раствором хлорида бария получено 0,2917 г сернокислого бария. Определите титр раствора серной кислоты. Вычислить массу карбоната кальция, вступившего в реакцию с 80,5 ммоль хлороводородной кислоты. Сколько граммов однозамещенного фосфата натрия надо добавить к 25,0 мл 0,15 М раствора гидроксида натрия, чтобы получить раствор с рН=7? Для фосфорной кислоты pKа1 = 2,15; pK а2 = 7,21; pK а3=12,36. На титрование 1,0000 г дымящейся серной кислоты, тщательно разбавленной водой, расходуется 43,70 мл 0,4982 М раствора гидроксида натрия. Известно, что дымящаяся серная кислота содержит серный ангидрид, растворенный в безводной серной кислоте. Вычислить массовую долю серного ангидрида в дымящей серной кислоте. Абсолютная погрешность измерения объема с помощью бюретки составляет 0,05 мл. Рассчитать относительную погрешность измерения объемов в 1; 10 и 20 мл. В мерной колбе вместимостью 500,00 мл приготовлен раствор из навески 2,5000 г карбоната натрия. Вычислить: а) молярную концентрацию раствора; б) молярную концентрацию эквивалента (½ Na2CO3); в) титр раствора; г) титр по соляной кислоте. Какой объем 10 %-ного раствора карбоната натрия плотностью 1,105 г/см3 нужно взять для приготовления: а) 1 л раствора с титром ТNa2CO3 = 0,005000 г/см3; б) 1 л раствора с ТNa2CO3/HCl = 0,003000 г/см3? Какой объем соляной кислоты с массовой долей 38,32 % и плотностью 1,19 г/см3 следует взять для приготовления 1500 мл 0,2 М раствора? Какой объем воды нужно добавить к 1,2 л 0,25 М HCl, чтобы приготовить 0,2 М раствор? Из 100 г технического гидроксида натрия, содержащего 3 % карбоната натрия и 7 % индифферентных примесей, приготовили 1л раствора. Вычислить молярную концентрацию и титр по соляной кислоте полученного щелочного раствора, считая, что карбонат натрия титруется до угольной кислоты. Имеется образец, в котором может содержаться NaOH, Na2CO3, NaHCO3 или смесь названных соединений массой 0,2800 г. Пробу растворили в воде. На титрование полученного раствора в присутствии фенолфталеина расходуется 5,15 мл, а в присутствии метилового оранжевого – 21,45 мл соляной кислоты с молярной концентрацией эквивалента 0,1520 моль/л. Определить состав образца и массовые доли компонентов в образце. Постройте кривую титрования 100,00 см3 0,1000 М раствора аммиака 0,1000 М раствором соляной кислоты, обоснуйте выбор индикатора. Вычислите рН точки эквивалентности, начала и конца титрования 100,00 см3 0,1000 М раствора малоновой кислоты (HOOCCH2COOH) 0,1000 М раствором гидроксида натрия (рКа1=1,38; рКа2=5,68 ). На титрование 25,00 см3 раствора карбоната натрия с молярной концентрацией эквивалента 0,05123 моль/дм3 пошло 32,10 см3 соляной кислоты. Вычислите молярную концентрацию эквивалента соляной кислоты. Сколько мл 0,1 М раствора хлорида аммония необходимо добавить к 50,00 мл 0,1 М раствора аммиака, чтобы получился буферный раствор с рН=9,3. Смесь серной и фосфорной кислот перенесли в мерную колбу объемом 250,00 см3. Для титрования взяли две пробы по 20,00 см3, одну оттитровали раствором гидроксида натрия с молярной концентрацией эквивалента 0,09940 моль/дм3 с индикатором метилоранжем, а вторую с фенолфталеином. Расход гидроксида натрия в первом случае составил 20,50 см3, а во втором 36,85 см3. Определите массы серной и фосфорной кислот в смеси. Комплексонометрическое титрование Комплексонометрическим титрованием (комплексонометрией) называют титриметрический метод количественного анализа, основанный на аналитическом использовании реакции комплексообразования ионов металлов с полидентатными хелатообразующими органическими аналитическими реагентами – комплексонами [4, 5, 8]. Комплексонами называют полидентатные хелатообразующие органические аналитические реагенты, отличающиеся наличием в их молекулах основных или кислотных групп и способные к образованию прочных растворимых в воде комплексов (хелатов) с ионами различных металлов. Основной группой обычно является аминогруппа, в которой атом азота имеет неподеленную пару электронов, кислотной группой может быть ацетатная –CH2COOH, карбоксильная –COOH или сульфо –SO3H группы. Вещества, с которыми взаимодействуют ионы металлов с образованием комплексных соединений, называются лигандами. Лиганды – доноры электронов, поэтому в их состав входят атомы с неподеленными электронными парами. В зависимости от количества пар электронов, способных образовывать связи с ионами металлов, лиганды называются монодентатными – одна группа, бидентатными – две группы и далее три-, тетра-, пентадентатными(полидентатные). Полидентатные лиганды способны образовывать хелатные (клешневидные) циклы, отличающиеся большой прочностью. Комплексы в этом случае называют хелатами. Количество связей, которые способен образовывать ион металла с донорными группами лиганда, зависит от возможного числа свободных орбиталей иона металла. Количество связей характеризует координационное число (к.ч.) атома металла, которое чаще всего равно удвоенной валентности металла. Наиболее распространенные координационные числа 4 и 6. Синтезировано большое число различных комплексонов, однако наибольшее значение для аналитической химии и титриметрического анализа имеют аминополикарбоновые кислоты с иминодиацетатными группировками –N(CH2COOH)2: комплексон I (нитрилотриуксусная кислота, НТУ) 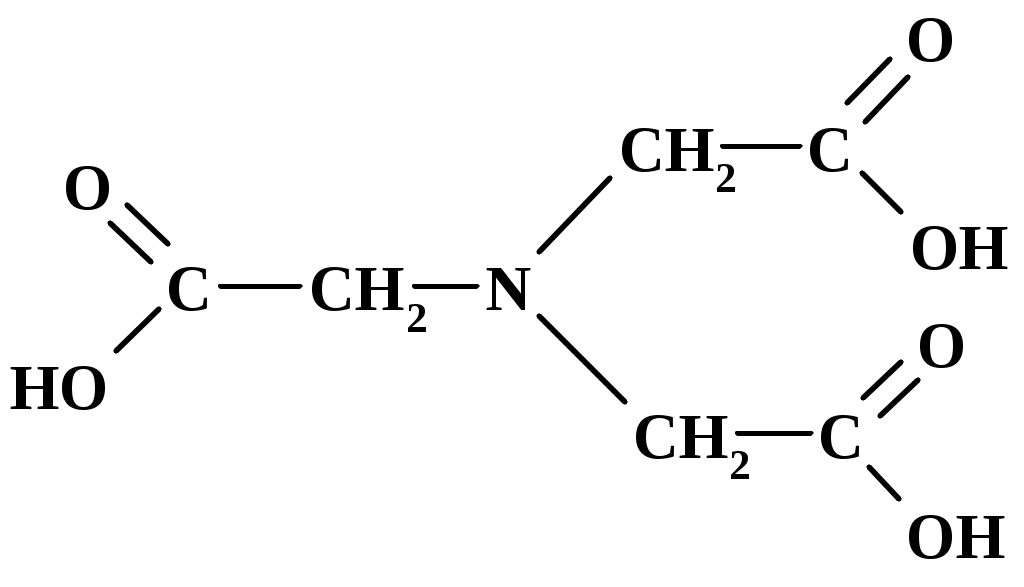 2) комплексон II (этилендиаминтетрауксусная кислота, ЭДТУ, H4Y) 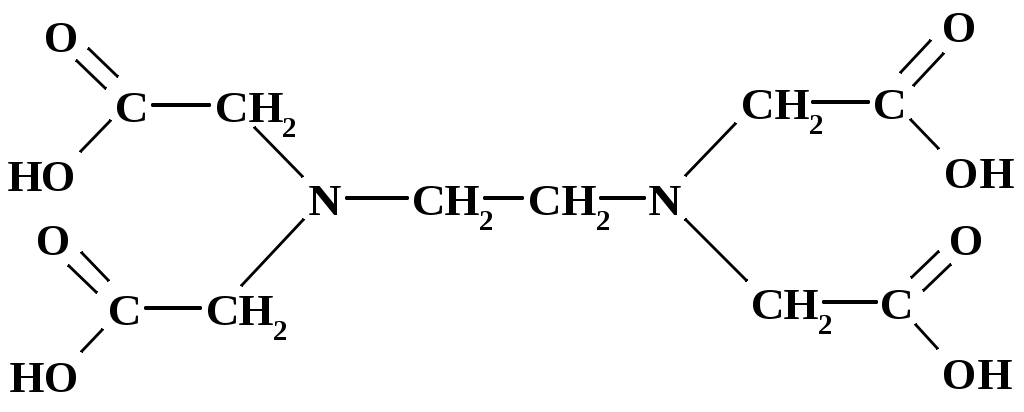 ЭДТУ плохо растворима в воде, поэтому наиболее часто применяют динатриевую соль этилендиаминтетрауксусной кислоты; комплексон III (динатриевая соль этилендиаминтетрауксусной кислоты, ЭТДА, Na2H2Y, трилон Б, хелатон) 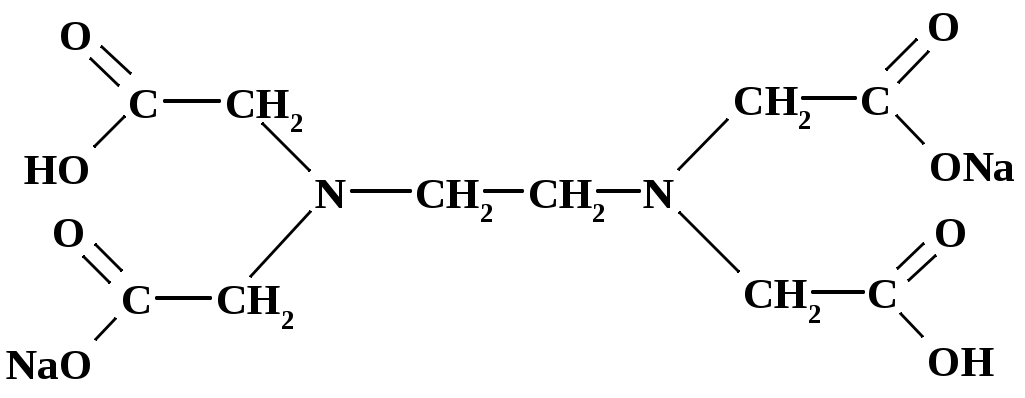 Комплексон III может находиться в растворе в разных формах (H4Y, H3Y-, H2Y2-, HY3-, Y4-) в зависимости от рН раствора (рис. 5). H4Y H3Y- + H+ pК H3Y- H2Y2- + H+ pК H2Y2- HY3- + H+ pК HY3- Y4- + H+ pК 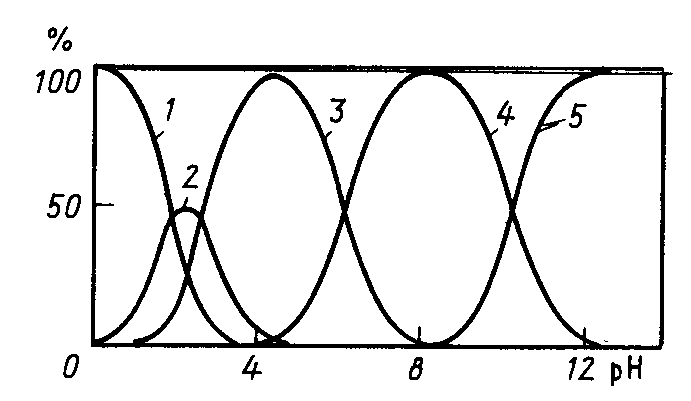 Рис.5. Ионные равновесия в растворе ЭДТА: 1 – H4Y; 2 – H3Y- ; 3 – H2Y2- ; 4 – HY3- ; 5 – Y4- ЭДТА образует прочные, растворимые в воде комплексные соединения; в результате реакции катион металла замещает катион водорода в карбоксильных группах и связывается донорно-акцепторными связями с атомами азота (рис. 6). 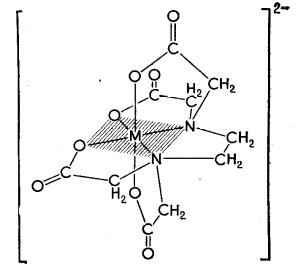 Рис. 6. Структура комплекса металла (III) с ЭДТА Пространственная структура комплексонатов металлов с ЭДТА не всегда строго доказана, поэтому на практике для простоты используют условные плоскостные графические формулы комплексонатов (рис. 7). 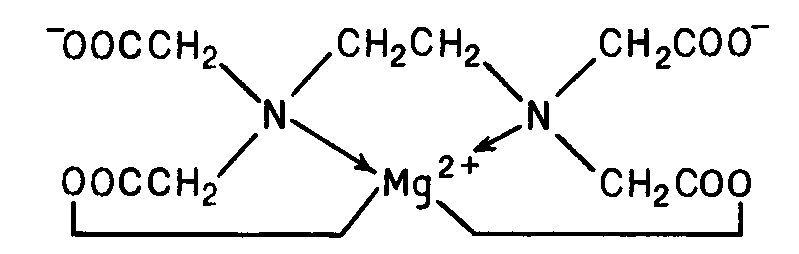 Рис. 7. Образование связей в комплексонатах магния (II) Комплексным соединениям двух- и трехзарядных катионов с этилендиаминтетрауксусной кислотой приписывается строение клешнеобразных соединений (хелаты). Комплекс металла с ЭТДА всегда образуется в соотношении 1:1, независимо от заряда металла, что позволяет считать эквиваленты металла и ЭДТА равными молярным массам. Взаимодействие катиона металла с ЭДТА (комплексон III) в слабокислой среде (рН=5) схематично выражается одним из уравнений: M2+ + H2Y2- MY2- + 2H+ M3+ + H2Y2- MY- + 2H+ M4+ + H2Y2- MY + 2H+ Реакция взаимодействия иона металла с ЭДТА описывается термодинамической константой устойчивости (Kуст), которая выражается следующим образом (при рН=12): M2+ + Y4- MY2-. Куст = Процесс диссоциации комплексного соединения описывается константой нестойкости: MY2- M2++ Y4-. Kнест= Kуст =1/Kнест . (16) При другом значении рН доля свободного иона [Y4-] (4 = Y4-/Cобщ) отличается от 1 (см. прил. 4, 5), поэтому в уравнение для расчета константы нестойкости следует подставлять реальное значение [Y4-] = 4 Cобщ, тогда Kнест= Величина быть 10-8. Kнест= Реакция образования комплексов металлов с ЭДТА сопровождается выделением ионов водорода, которые сдвигают реакцию комплексообразования в сторону исходных продуктов (принцип Ле-Шателье), поэтому титрование солей металлов раствором ЭДТА проводят в присутствии буферных растворов, связывающих ионы Н+. Прочность образующихся комплексов резко различается в зависимости от заряда комплексообразующего иона: комплексы с М+3 устойчивы в интервале рН 2, комплексы с М+2 – в интервале рН 5 (ацетатный буферный раствор), комплексы щелочных металлов устойчивы при рН 9 (аммиачный буферный раствор или щелочь). В зависимости от прочности образующегося комплексного соединения реакция титрования на 99,9% проходит при определенном значении рН, что позволяет, варьируя рН раствора, селективно определять ионы металлов в смеси. На рис. 8 показано, при каком минимальном значении рН можно удовлетворительно фиксировать конечную точку титрования различных катионов в отсутствие конкурирующих комплексообразующих реагентов. В методе комплексонометрии точка эквивалентности устанавливается с помощью металлохромных индикаторов, образующих с ионами металла окрашенные комплексы, окраска которых отличается от окраски свободного индикатора. Константа нестойкости комплекса M-Ind должна быть на порядок больше, чем константа нестойкости комплекса MY(+n-4) (рКM-Ind= рКMY – 1). 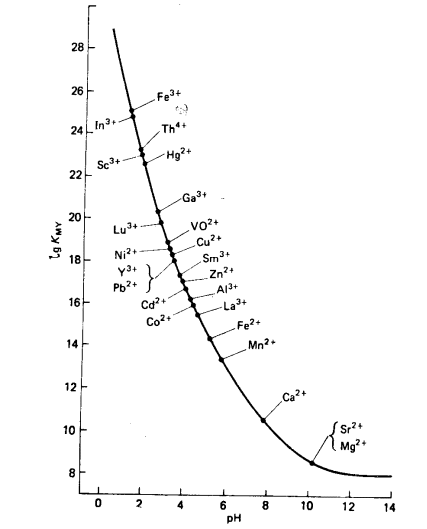 Рис.8. Минимальное значение рН, необходимое для титрования различных катионов ЭДТА Механизм действия металлохромных индикаторов заключается в следующем: до начала титрования трилон Б связывается со свободными ионами [М(H2O)4]2+, при этом раствор приобретает окраску комплексного соединения M-Ind: M2+ + Ind2- M-Ind. Когда все ионы металла, не связанные с индикатором, оттитрованы трилоном Б, титрант начинает вытеснять индикатор из комплексного соединения M-Ind, образуя более прочный комплекс M-ЭДТА, и раствор приобретает окраску свободного индикатора: M-Ind + H2Y2- MY2- +H2Ind. Металлохромные индикаторы применяют в виде раствора определенной концентрации либо в твердом виде в смеси с химически чистым хлоридом калия в соотношении 1:100 (индикаторная смесь). Интервал, в котором индикатор меняет свою окраску: р[Мn+] = pKInd 1. (20) Кривые титрования в комплексонометрии строят в координатах p[M n+] – (VЭДТА), где p[M n+] = -lg[M n+]. |
