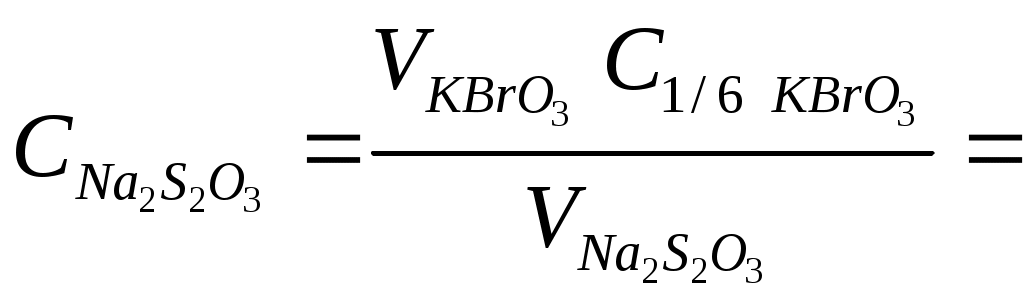МетодКА январь. Лабораторная работа 1 Определение содержания уксусной кислоты 16 в растворе методом кислотноосновного титрования 16
 Скачать 2.03 Mb. Скачать 2.03 Mb.
|
|
Броматометрия При броматометрическом титровании [11] происходит восстановление бромат-ионов в кислой среде до бромид-ионов: BrO3- + 6H+ + 6e- → Br- + 3H2O, Бромат калия в кислой среде является сильным окислителем и способен взаимодействовать с веществами, окислительный потенциал которых меньше. В реакции восстановления до Br- бромат-ион приобретает 6 электронов, поэтому М Раствор KBrO3 является первичным стандартом, поэтому его растворы точно известной концентрации готовят растворением точной навески вещества в мерной колбе. Растворы реагента устойчивы длительное время. Титрантом в методе служит раствор KBrO3 с молярной концентрацией эквивалента 0,1000 моль/дм3. Ряд веществ, таких как мышьяк (III), сурьма (III), железо (III), перекись водорода, алкилсульфиды, дисульфиды, щавелевая кислота, можно определять прямым титрованием стандартным раствором бромата калия в растворе 1 М соляной кислоты. Броматометрическое титрование применяют для анализа веществ и лекарственных препаратов, содержащих мышьяк, – мышьяковистого ангидрида (оксида мышьяка (III)), новарсенола, миарсенола и осарсола. Например, навеску As2O3 растворяют в 2 – 3 см3 10%-ного раствора NaOH, добавляют воду, концентрированную серную кислоту и KBr (в качестве катализатора). Раствор нагревают до кипения и титруют раствором KBrO3 с молярной концентрацией эквивалента 0,1000 моль/дм3. Индикатор метиловый красный. Титрование ведут до обесцвечивания раствора. As2O3 окисляется KBrO3 до As2O5: 3As2O3 + 2KBrO3 = 3As2O5 + 2KBr В точке эквивалентности избыток KBrO3 взаимодействует с KBr и выделяет свободный бром, который обесцвечивает индикатор метиловый красный. BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O Т В бромометрическомтитровании титрантом является раствор брома. Ввиду того, что раствор брома нестоек и токсичен, обычно применяют бромид-броматное титрование. В раствор анализируемого вещества вводят раствор KBr и титруют раствором KBrO3. Выделившийся при взаимодействии KBr и KBrO3 свободный бром обладает свойствами окислителя и способен восстанавливаться до бромид-ионов: KBrO3 + 5 KBr + 6 HCl = 3Br2 + 6 KCl + 3 H2O Br2 + 2е- → 2 Br- ; М Органические соединения реагируют с бромом, образуя продукты замещения либо продукты присоединения. При этом происходит бромирование многих органических соединений, особенно группы фенолов: фенола, резорцина, тимола, салициловой кислоты и др. Например, из фенола при взаимодействии с Br2 количественно образуется трибромфенол и бромоводородная кислота (реакция замещения): 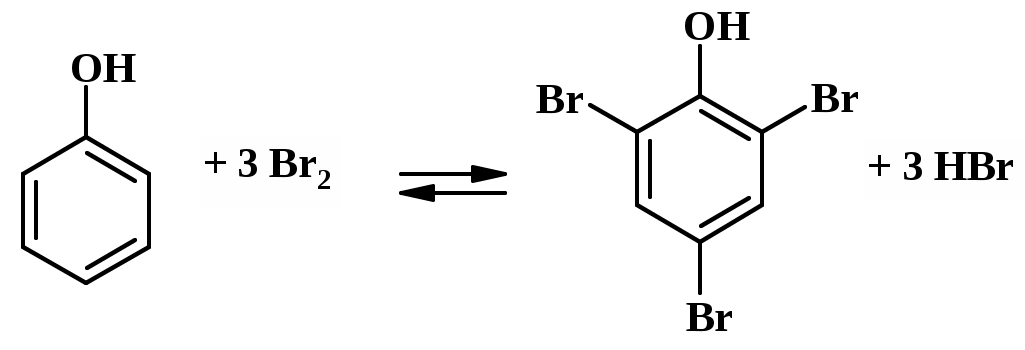 М Этилен реагирует с бромом по реакции присоединения: CH2=CH2 + Br2 CH2Br–CH2Br М Для органических соединений, которые реагируют с бромом быстро, применяют метод прямого титрования. При этом навеску вещества растворяют в воде, добавляют раствор KBr и HCl. Полученную смесь титруют раствором KBrO3 с молярной концентрацией эквивалента 0,1000 моль/дм3 в присутствии метилового оранжевого. Большинство органических соединений реагируют с бромом медленно, поэтому применяется титрование по замещению. Этим способом по Государственной Фармакопее СССР [4, 12, 13] анализируют резорцин и фенол, добавляя к раствору анализируемого вещества определенный объем раствора KBrO3, KBr и HCl. Смесь оставляют в закрытом сосуде на 10 мин, за это время происходит реакция бромирования органического вещества выделившимся свободным бромом.  Избыток непрореагировавшего брома определяют йодометрически, добавляя к смеси раствор KI. Бром количественно вытесняет йод из KI. Br2 + 2KI → 2KBr + I2 Выделившийся йод титруют раствором Na2S2O3. I2 + 2Na2S2O3 = 2NaI + Na2S4O6 Бромо-йодометрия довольно широко применяется в органическом функциональном анализе для количественного определения алкоксильной R'-OR, гидразинной R-NH-NH2, сульфидной R-S-S-R и других групп. Например, сульфидные соединения определяют, добавляя KBrO3 и KBr. Выделившийся бром взаимодействует с веществом, образуя сульфосоединения и бромоводородную кислоту: CH3-S-S-CH3 + 5 Br2 + 6 H2O → 2CH3SO3H + 10HBr Избыток брома, образовавшегося из бромид-броматной смеси, замещают на йод добавлением KI. Выделившееся при этом эквивалентное количество йода титруют раствором Na2S2O3. Таблица 13 Органические соединения, определяемые по реакции замещения
лабораторная работа 6 Определение содержания фенолфталеина в растворе методом бромид-броматометрии с йодОметрическим окончанием Цель работы: 1) закрепление теоретических знаний о методе бромид-броматометрии, йодометрии; 2) практическое применение броматометрического и йодометрического методов титрования для определения массы фенолфталеина в растворе. Реактивы 1. Раствор тиосульфата натрия Na2S2O3 с молярной концентрацией эквивалента 0,1 моль/дм3. Раствор бромата калия KBrO3 с молярной концентрацией эквивалента Раствор гидроксида натрия NaOH с массовой долей 5 % . Раствор бромида калия KBr с массовой долей 30 % . Уксусная кислота CH3COOH концентрированная. Хлороводородная кислота HCl концентрированная. Раствор йодида калия KI с массовой долей 10 % . Раствор крахмала свежеприготовленный с массовой долей 0,1 % Этиловый спирт 96 %. Сущность метода определения фенолфталеина Фенолфталеин (α,α-ди-4-оксифенилфталид, пурген) принадлежит к классу трифенилметановых красителей и является слабительным средством [14]. 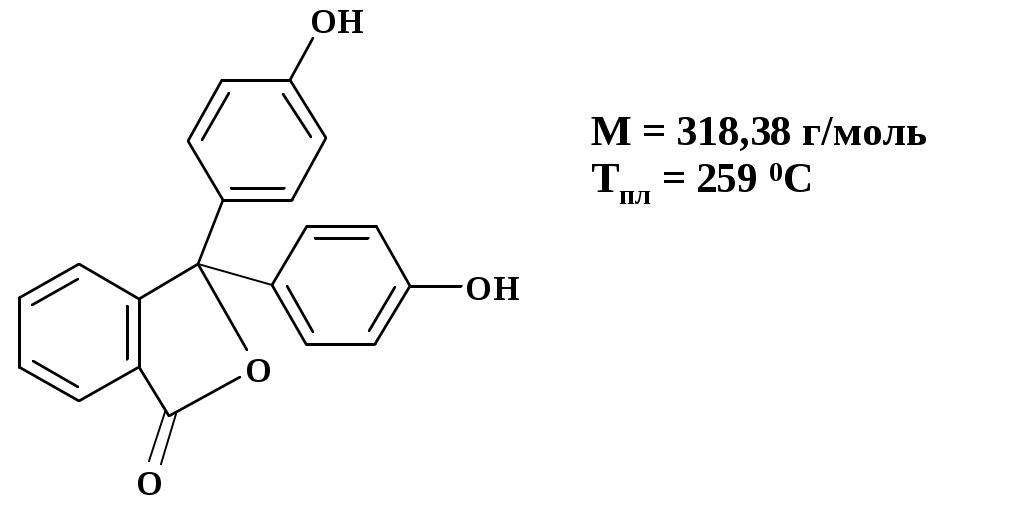 Количественное определение основано на реакции бромирования: 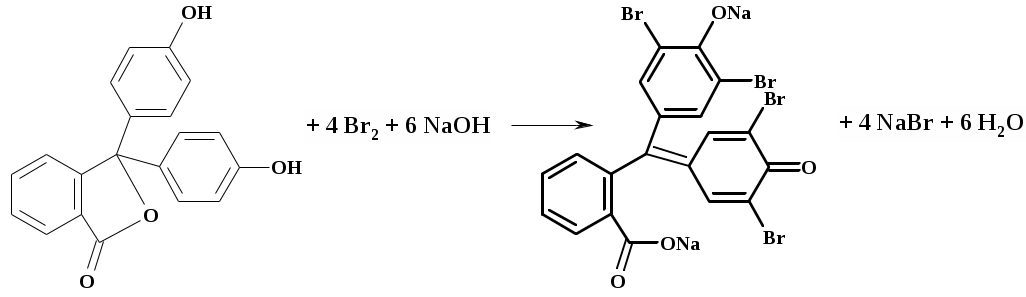 Бром, необходимый для реакции бромирования фенолфталеина, получают по реакции KBrO3 + 5KBr + 6HCl → 3Br2 + 6KCl + 3H2O Количества бромида и бромата калия подбирают таким образом, чтобы выделился избыток брома. Остаток брома, не вступивший в реакцию с фенолфталеином, восстанавливают йодидом калия: Br2 + 2KI → 2KBr + I2 Йод, выделившийся при этом взаимодействии, оттитровывают раствором тиосульфата натрия с крахмалом в качестве индикатора: I2 + 2Na2S2O3 → 2NaI + Na2S4O6 Ход работы: 1. Приготовление стандартного раствора бромата калия. Навеску бромата калия массой 0,3000 г, взвешенную с погрешностью 0,0003 г, количественно переносят в мерную колбу вместимостью 200,00 см3. Полученный раствор имеет молярную концентрацию эквивалента точно 2. Стандартизация рабочего раствора Na2S2O3 (стандартизовать, не разбавляя!) 2.1.Стандартизация рабочего раствора Na2S2O3 по стандартному раствору KBrO3 Схема 12. Стандартизация рабочего раствора Na2S2O3 по раствору KBrO3  В коническую колбу для титрования вместимостью 250 см3 помещают В коническую колбу для титрования вместимостью 250 см3 помещают 1 см3 5% – ного раствора гидроксида натрия, аликвоту 25,00 см3 приготовленного стандартного раствора бромата калия ( к раствору добавляют 10 см3 10% раствора иодида калия и титруют выделившийся йод раствором тиосульфата натрия с молярной концентрацией эквивалента 0,1 моль/дм3 до изменения окраски с бурой на соломенно-желтую. После этого вводят 2–3 см3 свежеприготовленного 0,1 % – ного раствора крахмала и продолжают титровать, до исчезновения синей окраски. Результаты титрования заносят в табл. 14. Концентрацию тиосульфата натрия определяют по закону эквивалентов. Таблица 14 Результаты стандартизации раствора тиосульфата натрия
2.2. Стандартизация тиосульфата натрия может быть проведена по дихромату калия (см. с. 70 – 71, лабораторная работа 5, пункт 1.). 3. Приготовление анализируемого спиртового раствора фенолфталеина Выданный лаборантами анализируемый раствор фенолфталеина в мерной колбе на 50,00 см3 доводят до метки 96% – ным раствором этилового спирта (АККУРАТНО!). 4. Определение содержания фенолфталеина Схема 13. Определение содержания фенолфталеина в растворе:  В коническую колбу для титрования вместимостью 250 см3 помещают 1 см3 5 % раствора гидроксида натрия, аликвоту 25,00 см3 приготовленного стандартного раствора бромата калия ( Таблица 15 Результаты титрования раствора фенолфталеина
Массу фенолфталеина в задаче рассчитывают по формуле М1/z ф/ф = 39,79 г/моль, 5. Статистическая обработка результатов анализа См. лабораторную работу № 1. Вывод: приводят полученные данные в виде |