МетодКА январь. Лабораторная работа 1 Определение содержания уксусной кислоты 16 в растворе методом кислотноосновного титрования 16
 Скачать 2.03 Mb. Скачать 2.03 Mb.
|
0,05 моль/дм3 готовят разбавлением 2,5 М раствора гидроксида натрия дистиллированной водой. кислотно-основноЕ титрованиЕМетоды кислотно-основного титрования основаны на реакциях нейтрализации. Процесс нейтрализации в водных растворах заключается во взаимодействии ионов гидроксония (водорода) с ионами гидроксила, которое сопровождается образованием слабодиссоциированных молекул воды, что описывается уравнением: H3O+ + OH- → 2H2O или H+ + OH- → H2O Методы кислотно-основного титрования позволяют количественно определять вещества, обладающие кислотными или основными свойствами. Для классификации веществ по их кислотно-основным свойствам целесообразно использовать протолитическую теорию кислот и оснований Бренстеда-Лоури. Определение кислот ведут с помощью титрованных растворов щелочей, а основания определяют с помощью титрованных растворов кислот. Применяя специальные приемы титрования, методами нейтрализации можно определять содержание многих солей, дифференцированно титровать смеси сильных и слабых кислот, а также смеси оснований и солей в неводных средах [2]. Следует отметить, что в качестве титранта применяют только растворы сильных кислот или щелочей, а титруемыми веществами могут быть как сильные, так и слабые кислоты и основания и их соли, проявляющие кислотно-основные свойства. В процессе титрования рН титруемого раствора изменяется в зависимости от объема прибавленного титранта (VR). Графическое отображение процесса изменения рН в зависимости от объема титранта называется кривой титрования (рис.1). Построение кривой титрования ведут с таким расчетом, чтобы показать значения рН раствора, соответствующие основным моментам титрования: в начальной точке титрования, в начале скачка титрования, в точке эквивалентности, в конце скачка титрования. Под скачком титрования понимают резкое изменение рН раствора вблизи точки эквивалентности (в интервале от 99,9 до 100,1 % объема добавленного титранта). Значения рН растворов, соответствующие различным моментам титрования, вычисляют по формулам, выражающим значения концентраций ионов водорода в воде, в водных растворах кислот, оснований, гидролизующихся солей и в буферных смесях (табл. 1). Таблица 1 Формулы для вычисления рН растворов электролитов
pKa – показатель константы ионизации слабой кислоты (прил. 1), pKb – показатель константы ионизации слабого основания (прил. 2). Кривые титрования дают возможность проследить изменение рН раствора в различные моменты титрования, рассмотреть влияние концентрации реагирующих веществ на процесс нейтрализации, рассчитать точку эквивалентности и сделать правильный выбор индикатора [3]. Вид кривых титрования зависит от степени диссоциации кислоты или основания, от концентрации реагирующих веществ и от природы образующихся веществ. В процессе титрования сильных кислот или оснований в растворе до точки эквивалентности существует смесь сильной кислоты (основания) и ее (его) соли. В случае, когда концентрация титруемого вещества и титранта одинаковые, кривая титрования является симметричной относительно точки эквивалентности (рис. 1). 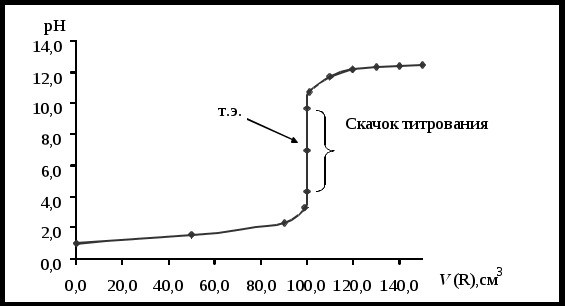 Рис. 1. Кривая титрования 100,00 см3 раствора HCl с С1/z=0,1000 моль/дм3 раствором NaOH с С1/z=0,1000 моль/дм3 В процессе титрования слабых кислот (оснований) в растворе до точки эквивалентности существует смесь слабой кислоты (основания) и ее (его) соли, которая представляет собой буферный раствор. Кривая титрования является асимметричной относительно точки эквивалентности (рис. 2). 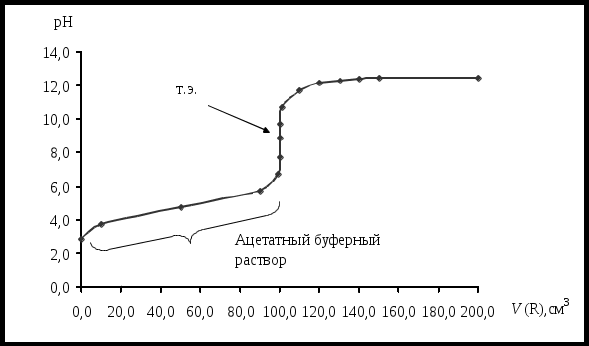 Рис. 2. Кривая титрования 100,00 см3 раствора CH3COOH с С1/z=0,1000 моль/дм3 раствором NaOH с С1/z =0,1000 моль/дм3 Под буферными растворами понимают электролиты, рН которых изменяется незначительно при разбавлении или добавлении к ним небольших количеств сильной кислоты или щелочи. Буферные системы могут быть 3 типов. Слабая кислота и ее анион А-/ НА: ацетатная буферная система СН3СОО-/ СН3СООН в растворе СН3СООNa и СН3СООН, область действия рН =3,8 – 5,8. Слабое основание и его катион В/ ВН+: аммиачная буферная система NH3H2O/ NH4+ в растворе NH3 и NH4Cl, область действия рН = 8,2 – 10,2. Смесь амфолита с сопряженной кислотой (основанием): водородно-гидрокарбонатная буферная система H2CO3/ HCO3- в растворе H2CO3 и NaHCO3, область действия рН =5,4 – 7,4; гидрокарбонатно-карбонатная буферная система HCO3-/ CO3 2- в растворе NaHCO3 и Na2CO3, область действия рН =9,3 – 11,3; дигидрофосфатно-гидрофосфатная буферная система H2PO4-/ HPO4 2- в растворе NaH2PO4 и Na2HPO4, область действия рН =6,2 – 8,2 М  еханизм буферного действия заключается в связывании свободных Н+(ОН-) ионов сопряженной кислотно-основной системой буферного раствора за счет протекания химической реакции и образования эквивалентного количества слабодиссоциированного электролита. еханизм буферного действия заключается в связывании свободных Н+(ОН-) ионов сопряженной кислотно-основной системой буферного раствора за счет протекания химической реакции и образования эквивалентного количества слабодиссоциированного электролита.СH3COOH + OH- CH3COO- + H2O СH3COO- + H+ CH3COOH Способность буферного раствора сохранять рН при добавлении сильной кислоты (щелочи) ограничена величиной буферной ёмкости, которая зависит от концентрации компонентов буферной смеси и их соотношения. Буферную ёмкость измеряют количеством молей сильной кислоты или щелочи, которое необходимо добавить к 1 литру буферного раствора с определенной концентрацией, чтобы изменить его рН на единицу. Кислотно-основные индикаторы представляют собой слабые органические кислоты или основания с определенным рКа (рКb), которые изменяют окраску в зависимости от рН раствора (см. прил. 3). Интервал значений рН, при которых происходит изменение окраски индикатора (рН = рТInd 1), называется интервалом перехода рН, а значение рН, при котором происходит наиболее резкое изменение окраски, называется показателем титрования индикатора (рТ). Интервалы перехода рН индикаторов приведены в справочнике [4], а значение рТ, как правило, находится в середине интервала рН перехода. Существует два способа выбора индикатора (рис.3): по рТ индикатора: значение рТ индикатора должно совпадать с рН в точке эквивалентности (рТ = рНт.э). Чем ближе рТ индикатора находится к рНт.э, тем меньше индикаторная ошибка титрования; по скачку титрования: интервал рН перехода окраски индикатора должен лежать внутри скачка титрования. 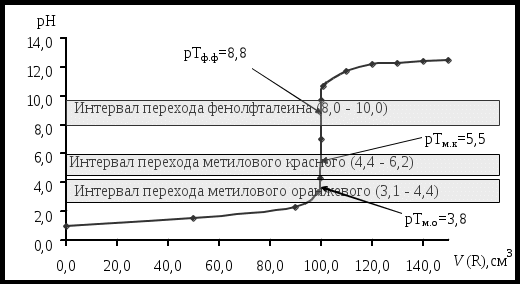 Рис. 3. Кривая титрования 100,00 см3 раствора HCl с С1/z=0,1000 моль/дм3 раствором NaOH с С1/z =0,1000 моль/дм3 (интервалы перехода окраски индикаторов) Правильный выбор индикатора возможен лишь при четком представлении о взаимосвязи скачка титрования и рН точки эквивалентности с константой диссоциации кислот и оснований. Методика анализа сводится к приготовлению, стандартизации титранта и определению концентрации (массы) кислоты или основания в образце методом кислотно-основного титрования. Лабораторная работа 1 Определение содержания уксусной кислоты в растворе методом кислотно-основного титрования Цель работы: 1) освоение приемов работы с мерной посудой и аналитическим оборудованием (аналитические весы); 2) освоение метода кислотно-основного титрования на примере определения массы уксусной кислоты в растворе. Сущность метода (теоретические основы) студенты описывают самостоятельно. Реактивы 1. Янтарная кислота Н2С4Н4О4 (х.ч.) – первичный стандарт. 2. Раствор гидроксида натрия NaOH с молярной концентрацией |
| № опыта | Объем Я.К., см3 | Объем NaOH, см3 | Концентрация NaOH, моль/дм3 | Средняя концентрация NaOH, моль/дм3 |
| 1 | 25,00 | | 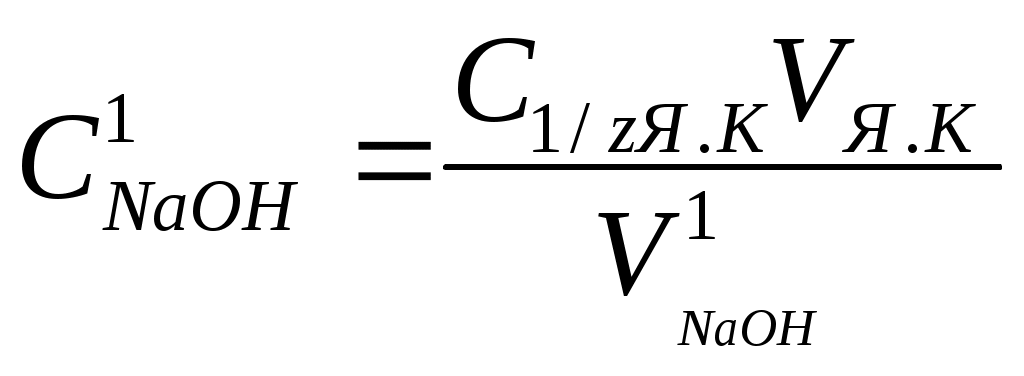 | |
| 2 | 25,00 | | | |
| 3 | 25,00 | | |
Определение содержания уксусной кислоты в исследуемом растворе
Методика определения аналогична стандартизации щелочи.
Основное уравнение титрования:

Индикатор выбирают по кривой титрования уксусной кислоты (У.К.) гидроксидом натрия. Кривую титрования уксусной кислоты гидроксидом натрия студенты строят самостоятельно.
Раствор задачи в мерной колбе доводят до метки дистиллированной водой и тщательно перемешивают.
Схема 2. Определение содержания уксусной кислоты в растворе

В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту 25,00 cм3 исследуемого раствора уксусной кислоты (пипеткой), добавляют 8 – 10 капель индикатора (фенолфталеин), разбавляют водой до
70 – 100 см3 и титруют раствором NaOH с известной концентрацией до слабо-розовой окраски, устойчивой в течение 30 секунд. Результаты титрования заносят в табл. 3.
Таблица 3
Результаты титрования раствора уксусной кислоты
| № опыта | Объем исследованного. раствора HAc, см3 | Объем NaOH, см3 | Содержание HAc в растворе, г |
| 1 | 25,00 | | |
| 2 | 25,00 | | |
| 3 | 25,00 | | |
| 4 | 25,00 | | |
| 5 | 25,00 | | |

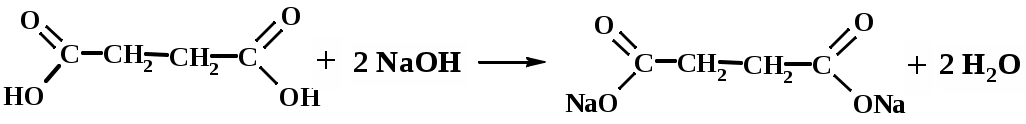
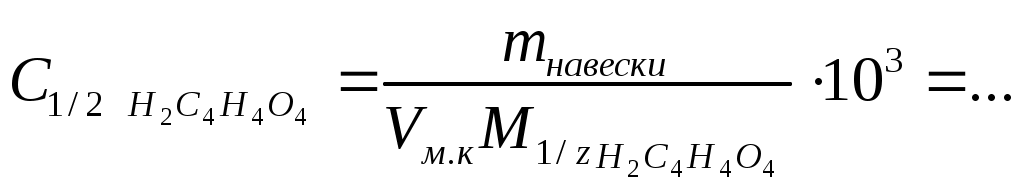
 В колбу для титрования вместимостью 250 см3 помещают аликвоту
В колбу для титрования вместимостью 250 см3 помещают аликвоту