МетодКА январь. Лабораторная работа 1 Определение содержания уксусной кислоты 16 в растворе методом кислотноосновного титрования 16
 Скачать 2.03 Mb. Скачать 2.03 Mb.
|
0,1 моль/дм3 путем разбавления дистиллированной водой в соотношении 1:1.
300 см3 с молярной концентрацией эквивалента |
| № опыта | Объем K2Cr2O7, см3 | Объем Na2S2O3, см3 | Концентрация Na2S2O3, моль/дм3 | Средняя концентрация Na2S2O3, моль/дм3 |
| 1 | 10,00 | | 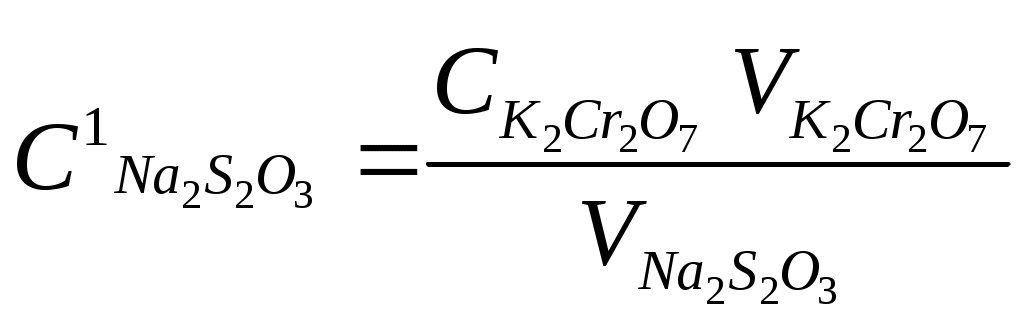 | |
| 2 | 10,00 | | | |
| 3 | 10,00 | | |
2. Определение содержания меди (II) в исследуемом растворе
Кривая титрования I2 раствором Na2S2O3 строится самостоятельно.
ВНИМАНИЕ! Использовать раствор задачи, оставшийся после лабораторной работы № 4.
Схема 11. Определение содержания меди (II) в растворе
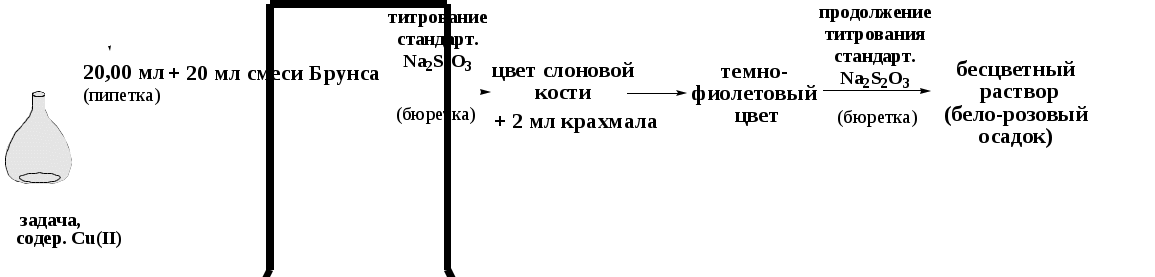
В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту 20,00 см3 исследуемого раствора Сu2+, добавляют 20 см3 смеси Брунса и немедленно! титруют раствором тиосульфата натрия до изменения окраски раствора с осадком от бурой до цвета слоновой кости. Затем добавляют 2 см3 крахмала и продолжают титрование до исчезновения темно-фиолетовой окраски (бело-розовый осадок). Результаты титрования заносят в табл.12.
Таблица 12
Результаты титрования раствора Cu2+
| № опыта | Объем исследуемого раствора меди, см3 | Объем Na2S2O3, см3 | Содержание Cu2+в растворе, г |
| 1 | 20,00 | | |
| 2 | 20,00 | | |
| 3 | 20,00 | | |
| 4 | 20,00 | | |
| 5 | 20,00 | | |
3. Статистическая обработка результатов анализа
См. лабораторную работу № 1.
4. Статистическая обработка результатов определения содержания меди (II) в растворе, полученных двумя методами (комплексонометрия
и йодометрия).
Статистическая обработка позволяет выяснить: «Принадлежат ли две полученные выборки результатов к одной генеральной совокупности?».
Существует несколько методик для этой оценки. Наиболее простая и часто применяемая методика – оценка по t-критерию.
1. Рассчитывают F-критерий (см. прил. 10) для определения равноточности измерений:
где S1 – стандартное отклонение 1–го метода (с большим значением);
S2 – стандартное отклонение 2–го метода (с меньшим значением).
Если FрассчFтабл – результаты, полученные двумя методами, двумя исследователями, двумя лабораториями, неравноточны. Дальнейшее сравнение при этом не проводят.
Если FрассчFтабл –дисперсии однородны, т.е. результаты, полученные двумя методами, двумя исследователями, двумя лабораториями, равноточны и может быть найдена средняя дисперсия по двум рядам измерений.
2. Вычисляют среднюю дисперсию и рассчитывают коэффициент Стьюдента t (см. прил. 9):
Если tрассчtтабл – результаты не принадлежат к одной генеральной совокупности, следовательно в одном из методов присутствует систематическая погрешность.
Если tрассчtтабл – результаты, полученные двумя методами, двумя исследователями, двумя лабораториями, принадлежат к одной генеральной совокупности и их можно объединить и обработать совместно, как одну серию измерений (Х1–Х10).
3. Находят
Вывод: приводят полученные данные в виде
меди (II) в растворе двумя методами делают вывод о принадлежности/ непринадлежности двух полученных выборок результатов к одной генеральной совокупности.
Контрольные вопросы и задачи к лабораторной работе № 5
Теоретические вопросы
Особенности метода йодометрического титрования в сравнении
с перманганатометрией и хроматометрией.
Реакции, лежащие в основе метода йодометрии.
Примеры йодометрического определения веществ для случаев прямого, обратного и титрования по замещению. Напишите уравнения реакций титрования этих веществ.
Почему тиосульфат натрия не может быть использован в качестве первичного стандарта? Как проводится его стандартизация по раствору дихромата калия? К каким последствиям может привести несоблюдение строгого порядка выполнения техники эксперимента при стандартизации тиосульфата натрия?
Считается, что тиосульфат натрия взаимодействует с диоксидом углерода и кислородом, находящимся в атмосфере. Напишите реакции такого взаимодействия и определите, приведет ли это взаимодействие к завышению или занижению результатов анализа.
Какие погрешности могут возникнуть в процессе йодометрического определения меди (II) и как их избежать?
Оказывает ли смесь Брунса влияние на точность йодометрического определения меди (II)? С какой целью она добавляется в раствор? Каково назначение компонентов этой смеси?
Приведите расчетные формулы для определения массовой доли
и массового содержания меди (II) в пробе при её йодометрическом методе определения.
Задачи
На сколько процентов изменится восстановительная способность тиосульфата натрия с молярной концентрацией эквивалента
0,1000 моль/л, если 2 % его разложится под действием диоксида углерода? Сделайте расчет и приведите новое значение молярной концентрации раствора-восстановителя.
Рассчитайте молярную массу эквивалента тиосульфата натрия при его окислении до тетратианата натрия и сульфата натрия.
Поясните, за счет какого процесса смещается равновесие реакции между Cu2+ и I2 , и определите константу равновесия этой реакции с учетом смещения равновесия.
Для стандартизации раствора тиосульфата натрия 0,1510 г дихромата калия растворили в разбавленной серной кислоте, добавили избыток йодида калия и выделившийся йод оттитровали, затратив 46,10 см3 реагента. Рассчитайте молярную концентрацию эквивалента тиосульфата натрия.
Чему равна молярная масса эквивалента свинца при его определении методом йодометрии, основанном на следующих реакциях:
2PbCrO4+2H+ = 2Pb2++Cr2O72- +H2O
6I-+ Cr2O72-+14H+ = 3I2+2Cr 3++7 H2O
I2 +2S2O32- = S4O62- + 2I-
Технический препарат мышьяка массой 1,0000 г растворили
в щелочном растворе и оттитровали 0,2000 М раствором йода, которого пошло на титрование 20,00 мл. После подкисления оттитрованного раствора к нему добавили избыток йодида калия и выделившийся йод оттитровали 40,00 мл 0,1510 М раствора тиосульфата натрия. Основываясь на обратимости реакции AsO33- + I2 + 2OH- AsO43- + 2I- +H2O рассчитайте массовую долю As2O3 и As2О5 в исходном препарате [10].
Навеску 0,2250 г пробы, состоящей только из железа и оксида
железа (III), растворили, железо восстановили до двухвалентного состояния
и оттитровали раствором KMnO4 с молярной концентрацией эквивалента 0,0991 моль/дм. Объем KMnO4 ,затраченный на титрование, равен 18,95 см3. Вычислите процентное содержание Fe и Fe2O3 в пробе.

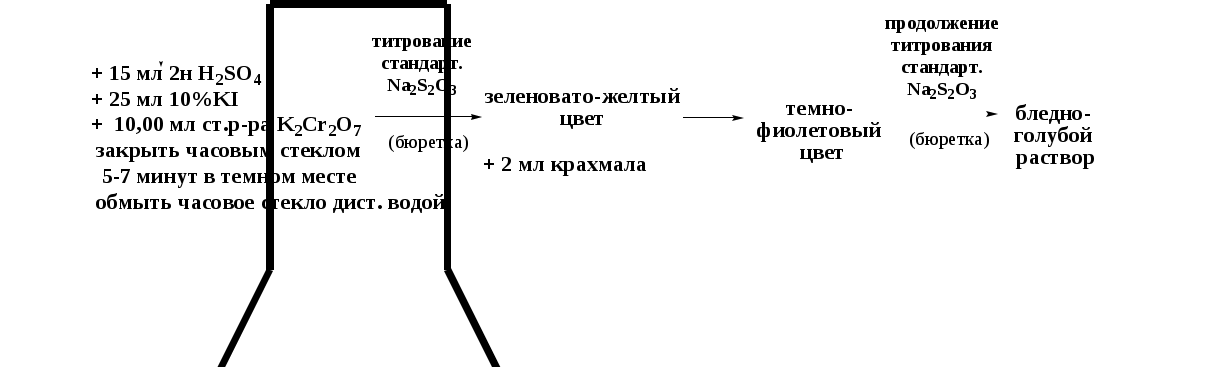 В коническую колбу для титрования вместимостью 250 см3 помещают
В коническую колбу для титрования вместимостью 250 см3 помещают