МетодКА январь. Лабораторная работа 1 Определение содержания уксусной кислоты 16 в растворе методом кислотноосновного титрования 16
 Скачать 2.03 Mb. Скачать 2.03 Mb.
|
|
ВНИМАНИЕ! Раствор задачи оставляют для выполнения лабораторной работы № 5! 3. Статистическая обработка результатов анализа См. лабораторную работу № 1. Вывод: приводят полученные данные в виде Контрольные вопросы и задачи к лабораторным работам № 3 и № 4 Теоретические вопросы Идентичны ли понятия «комплексометрия» и «комплексонометрия»? Ступенчатые и суммарные константы образования комплексных соединений. Почему реакции со ступенчатым комплексообразованием не находят применения в титриметрии? Комплексоны I, II, III. Назовите причины их широкого использования в титриметрическом анализе. Ионное состояние ЭДТА в растворе при различных значениях рH. Влияние концентрации ионов водорода на равновесие реакции комплексообразования ЭДТА с ионами металлов. Как количественно оценивается это влияние? Чем обусловлена необходимость использования буферных растворов при комплексонометрическом титровании? Как это сказывается на равновесии Mn+ + Y4- MY+ n-4? Первичные стандарты в комплексонометрии. Приведите методику стандартизации комплексона III. Характеристика индикаторов, применяемых в комплексоно-метрическом титровании (условия их применения, механизм действия). Расчет кривых комплексонометрического титрования с использованием условных констант устойчивости. Изменится ли величина скачка титрования с изменением pH титруемого раствора? Определение содержания кальция и магния в растворе при их совместном присутствии. Металлоиндикаторы и область pH растворов, в которой они применяются. Если индикатор в своей кислотной форме имеет такой же цвет, как и его комплекс с ионом металла, можно ли использовать этот индикатор при определении данного металла? Задачи Вычислите α4 для ЭДТА при pH=5, если константы ионизации ЭДТА следующие: K1=1,0·10-2, K2=2,1·10-3, K3=6,9·10-7, K4=5,5·10-11. Постройте кривую титрования 25,00 мл 0,020 М раствора никеля 0,010 М раствором ЭДТА при pH=10, если константа устойчивости КNiY = 1018,62. Вычислите p[Ni] после добавления 0,00; 10,00; 25,00; 40,00; 50,00 и 55,00 мл титранта. На титрование 50,00 мл раствора, содержащего ионы кальция и магния, потребовалось 13,70 мл 0,12 М раствора ЭДТА при pH=12 и 29,60 мл при pH=10. Выразите концентрации кальция и магния в растворе в мг/мл. При анализе в 1 л воды найдено 0,2173 г оксида кальция и 0,0927 г оксида магния. Вычислите, какой объём ЭДТА концентрации 0,0500 моль/л был затрачен на титрование. На титрование 25,00 мл стандартного раствора, содержащего 0,3840 г сульфата магния, израсходовано 21,40 мл раствора трилона Б. Вычислите титр этого раствора по карбонату кальция и его молярную концентрацию. На основании констант образования (устойчивости) комплексонатов металлов, приведенных ниже, оцените возможность комплексонометрического титрования ионов металлов при pH = 2; 5; 10; 12.
Для этих значений pH рα4 равна соответственно 13,5; 6,5; 0,45; 0,01. Ваши выводы сделайте с учётом того, что в растворе возможно протекание конкурирующих реакций образования гидроксокомплексов или гидроксидов металлов, произведения растворимости которых соответственно следующие:
При титровании 0,01 М раствора Ca2+ 0,01 М раствором ЭДТА при pH=10 константа устойчивости KCaY = 1010,6. Вычислите, какой должна быть условная константа устойчивости комплекса металла с индикатором [CaInd] при pH=10, если в конечной точке титрования [CaInd]=[Ind]. Константа кислотной ионизации индикатора, используемого при комплексонометрическом титровании, равна 4,8·10-6. Вычислите содержание кислотной [H2Ind] и щелочной [Ind2+] форм индикатора при pH = 4,9, если его общая концентрация в растворе составляет 8,0·10-5 моль/л. Определите возможность использования данного индикатора при титровании раствора с pH=4,9, если цвет его кислотной формы совпадает с цветом комплекса. Для определения содержания алюминия в образце навеску образца 550 мг растворили и добавили 50,00 мл 0,05100 М раствора комплексона III. Избыток последнего оттитровали 14,40 мл 0,04800 М раствором цинка (II). Рассчитайте массовую долю алюминия в образце. При разрушении комплекса, содержащего висмут и йодид-ионы, последние титруют раствором Ag(I), а висмут – комплексоном III. Для титрования раствора, содержащего 550 мг образца, требуется 14,50 мл 0,05000 М раствора комплексона III, а на титрование йодид-иона, содержащегося в 440 мг образца, затрачивается 23,25 мл 0,1000 М раствора Ag(I). Рассчитайте координационное число висмута в комплексе, если йодид-ионы являются лигандом. Образец массой 0,3280 г, содержащий Pb, Zn, Cu, растворили и перевели в мерную колбу на 500,00 см3. Определение вели в три этапа: а) на титрование первой порции раствора объемом 10,00 см3, содержащего Pb, Zn, Cu, затрачено 37,50 см3 0,0025 М раствора ЭДТА; б) во второй порции объемом 25,00 см3 замаскировали Cu, а на титрование Pb и Zn израсходовано 27,60 см3 ЭДТА; в) в третьей порции объемом 100,00 см3 замаскировали Zn и Cu, на титрование Pb затрачено 10,80 см3 ЭДТА. Определите массовую долю Pb, Zn, Cu в образце. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ Окислительно-восстановительные взаимодействия связаны с переносом электронов между реагирующими частицами – молекулами, ионами или комплексами. Окислением называется реакция, связанная с потерей электрона реагирующей частицей, восстановлением – реакция, связанная с приобретением электронов. Частицу, отдающую электрон, называют восстановителем, а принимающую электроны – окислителем. Молярное отношение между окисляющимся веществом и восстанавливающимся веществом должно быть таково, что число электронов, отданных одним веществом, равно числу электронов, принятых другим. Это следует учитывать при составлении окислительно-восстановительных реакций. Любую реакцию можно представить, как сумму полуреакций. 5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O 5  Fe2+ - e → Fe3+ Fe2+ - e → Fe3+ 1 MnO4- + 5e + 8H+ → Mn2+ + 4H2O Мерой движущей силы полуреакции является электродный потенциал окислительно-восстановительной системы, который определяется как ЭДС гальванического элемента, составленного из исследуемой ОВ – системы в паре со стандартным водородным электродом, потенциал которого принят за 0,00 В при любой температуре. Например: (+) Cu | Cu2+ || H+ | H2 (Pt) (–) Cu2+ + 2е « Cu0 H2 – 2е « 2H+ (–) Zn | Zn 2+ || H+ | H2 (Pt) (+) Zn 0– 2е « Zn 2+ 2H+ + 2е « H2 Под равновесным электродным потенциалом понимают потенциал, устанавливающийся на металлическом электроде в растворе своей соли (на инертном электроде, погруженном в раствор, содержащий ОВ – систему) в отсутствие электрического тока. Стандартный электродный потенциал Е0 – это равновесный потенциал, который данная окислительно-восстановительная система имеет в том случае, когда все компоненты, участвующие в полуреакции, находятся в стандартном состоянии, т.е. их активности равны единице ( По соглашению Международного союза по теоретической и прикладной химии (IUPAC) термин «электродный потенциал» относится исключительно к полуреакциям, записанным в форме реакции восстановления. Например: Cu2+ + 2е « Cu0 Zn 2+ + 2е « Zn0 За знак электродного потенциала принимают действительный знак изучаемого электрода относительно стандартного водородного электрода, который указывает направление самопроизвольного протекания процесса. Так, положительный знак медного электрода означает, что реакция Cu2+ + Н2 « Cu0 + 2Н+ при обычных условиях протекает в сторону выделения металлической меди (слева направо). С другой стороны, отрицательный знак электродного потенциала цинка означает, что аналогичная реакция Zn 2+ + Н2 « Zn0 + 2Н+ самопроизвольно протекает в сторону растворения металлического цинка (справа налево). Зависимость между величиной электродного потенциала полуреакции и концентрацией потенциалопределяющих ионов (компонентов ОВ – системы) выражается уравнением Нернста. где Е – потенциал, В; R – газовая постоянная, 8,314 Дж/(моль·К); Т – абсолютная температура, К (273 + t°С); n – число электронов, участвующих в реакции; F – число Фарадея, 96485,3399 0,0024 Кл/моль; [Ox], [Red] – соответственно равновесные концентрации окисленной и восстановленной форм; a, b – стехиометрические коэффициенты. При температуре 25°С и переходе к десятичным логарифмам получаем уравнение в виде В процессе титрования происходит изменение потенциала титруемой системы, так как постоянно меняется соотношение Кривые титрования В редоксметрии кривые титрования строят в координатах Е = f(CR), они иллюстрируют графическое изменение потенциала системы в процессе титрования. До точки эквивалентности потенциал системы рассчитывается по отношению концентраций окисленной и восстановленной форм определяемого вещества (потому что до точки эквивалентности одна из форм титранта практически отсутствует), после точки эквивалентности – по отношению концентраций окисленной и восстановленной форм титранта (потому что после точки эквивалентности определяемое вещество оттитровано практически полностью). Потенциал в точке эквивалентности определяется по формуле где На рис. 10 представлена кривая титрования раствора щавелевой кислоты H2C2O4 раствором перманганата калия KMnO4 в кислой среде ([H+] = 1 моль/дм3). 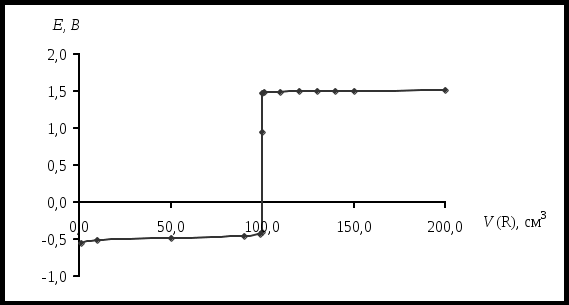 Рис. 10. Кривая титрования 100,00 см3 раствора щавелевой кислоты H2C2O4 с С1/z = 0,1000 моль/дм3 раствором перманганата калия KMnO4 с С1/z = 0,1000 моль/дм3 при Потенциал полуреакции MnO4- + 5e + 8H+ → Mn2+ + 4H2O зависит от рН среды, так как в полуреакции участвуют ионы водорода. Константа равновесия редокс-реакции Рассмотрим окислительно-восстановительное равновесие aARed+ bBOxaAOx+ bBRed, для которого можно записать полуреакции aAOx+ne aARed bBOx+ne bBRed , где n – число электронов, участвующих в ОВ–реакции. Если компоненты этой системы находятся в химическом равновесии, то электродные потенциалы полуреакций равны (ЕА = ЕВ). Выразим электродные потенциалы полуреакций из уравнения Нернста, тогда при равновесии 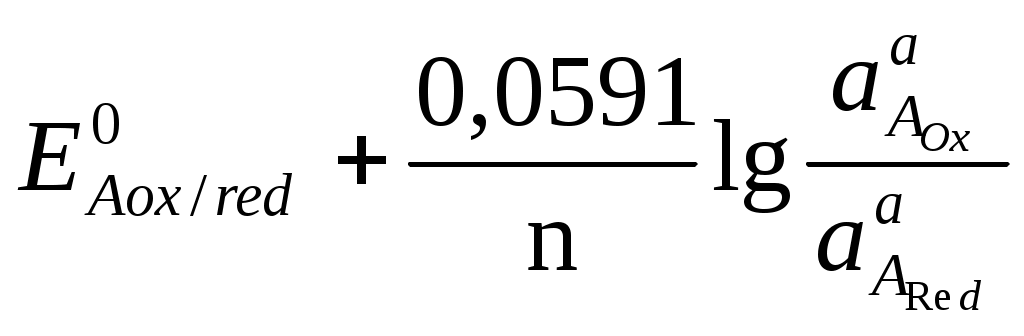 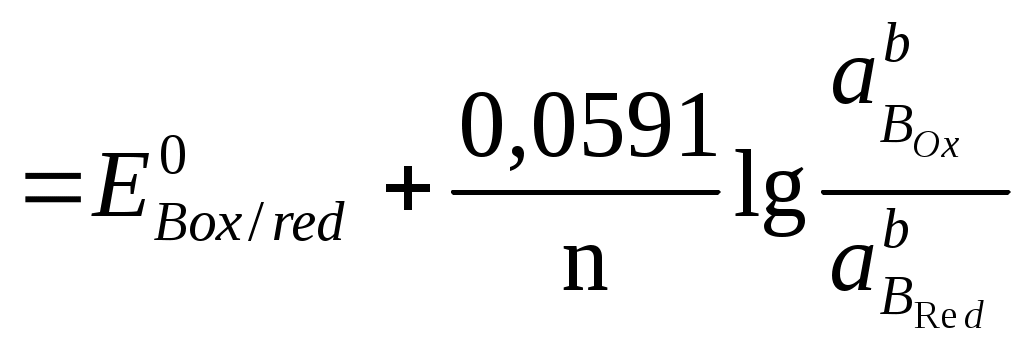 , ,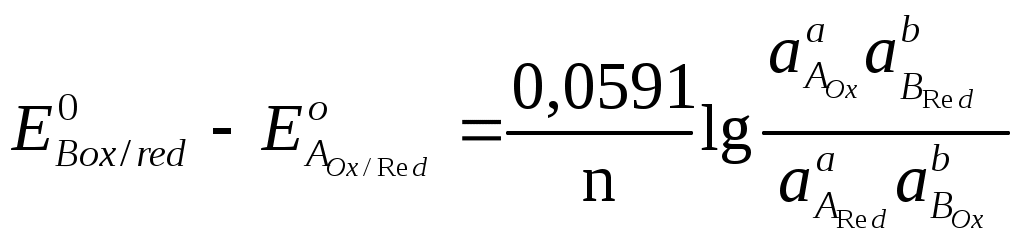 , , , ,где n – число электронов, участвующих в ОВ – реакции. Для аналитических целей используются реакции, которые протекают на 99,9 %, то есть: Кравн = В случае одноэлектронного перехода, когда n1 = n2 = 1, необходимая минимальная разность потенциалов для протекания реакции на 99,9 % следующая: В методах окислительно-восстановительного титрования в качестве титрантов – окислителей используют растворы брома, йода, солей церия (IV), перманганата калия (KMnO4), бихромата калия (K2Cr2O7), бромата (BrO3–), йодата (IO3–), в качестве титрантов – восстановителей применяют растворы солей Fe2+,Cr2+ , Sn2+ ,Ti3+, арсенит натрия (NaH2AsO3), оксалат – ион (C2O42-), аскорбиновую кислоту (C6H8O6). Название окислительно-восстановительного метода титриметрического анализа зависит от названия реагента, используемого в качестве титранта. Классификация методов окислительно-восстановительного титрования Перманганатометрия: титрант KMnO4. Основное уравнение: MnO4- +8H+ + 5e = Mn2+ + 4H2O, Дихроматометрия: титрант K2Cr2O7. Основное уравнение: Cr2O72-+14H++6e=2Cr3++7H2O, Иодометрия: титранты I2, Na2S2O3. Основные уравнения: I2 +2e 2I-, 2S2O32- – 2e S4O62-, Броматометрия: титрант KBrO3. Основное уравнение: BrO3- +6H+ +6e = Br- +3H2O, Нитритометрия: титрант NaNO2. Основное уравнение для определения восстановителей: NO2- + 1e + 2H+ = NO + H2O, Основное уравнение для определения окислителей: NO2- – 2e + H2O = NO3- + 2H+, Основное уравнение взаимодействия с первичными аминами: R-NH2 + NaNO2 + 2HCl [R-N+≡N]Cl- + 2H2O + NaCl |
