|
|
МетодКА январь. Лабораторная работа 1 Определение содержания уксусной кислоты 16 в растворе методом кислотноосновного титрования 16
Контрольные вопросы и задачи к лабораторной работе № 6
Теоретические вопросы
Что является титрантом в броматометрии?
Чему равен эквивалент бромата калия? Докажите, написав уравнения реакции.
Какие вещества анализируют броматометрическим методом?
Охарактеризуйте бромид-броматное титрование. Напишите уравнения реакции. Почему его называют бромометрическим титрованием?
Объекты для анализа бромид-броматного титрования. Приведите примеры.
Охарактеризуйте бромид-броматометрию с йодометрическим окончанием. Напишите уравнения реакций.
Запишите уравнения реакций при определении фенолфталеина. Расчетные формулы.
Задачи
Определите процентное содержание фенолфталеина в образце, если навеску фенолфталеина массой 0,0500 г растворили в этиловом спирте в колбе на 50,00 мл. К аликвоте 10,00 мл добавили 1 мл 5 % – ного раствора NaOH, 20,00 мл раствора KBrO3 с 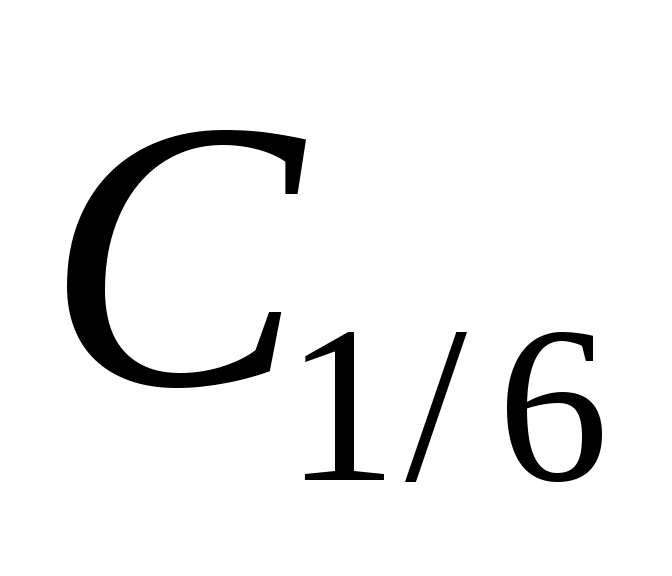 KBrO3 = 0,0539 моль/л, 10 мл 30 % KBr, 18 мл CH3COOH (конц.), 5 мл HCl (конц.) и 10 мл 10 % – ного раствора KI. Выделившийся йод оттитровали 8,15 мл Na2S2O3 с молярной концентрацией эквивалента 0,1017 моль/дм3. KBrO3 = 0,0539 моль/л, 10 мл 30 % KBr, 18 мл CH3COOH (конц.), 5 мл HCl (конц.) и 10 мл 10 % – ного раствора KI. Выделившийся йод оттитровали 8,15 мл Na2S2O3 с молярной концентрацией эквивалента 0,1017 моль/дм3.
Постройте кривые титрования 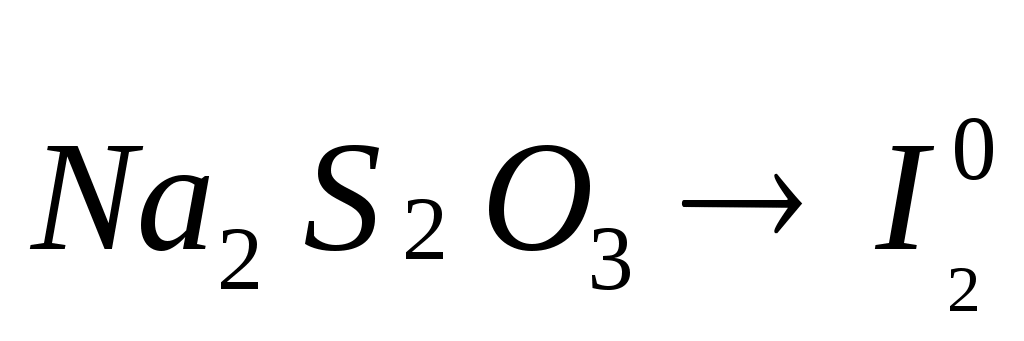 , , 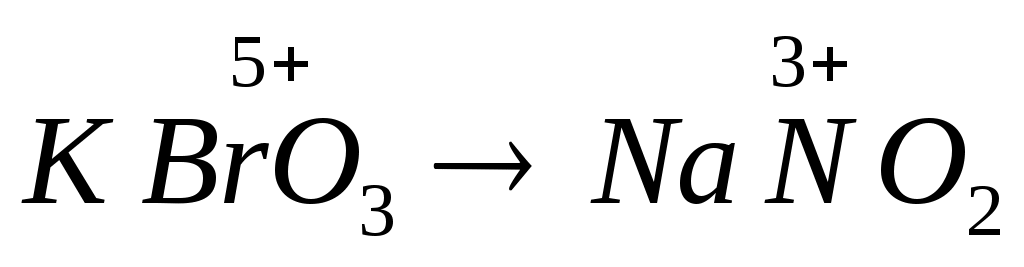 . .
Рассчитайте массу навески KIO3 для приготовления 500,00 см3 раствора с молярной концентрацией эквивалента 0,05000 моль/л.
Рассчитайте массу навески KBrO3 для приготовления 250,00 см3 раствора с молярной концентрацией эквивалента 0,1500 моль/л.
Для стандартизации раствора Na2S2O3 0,1510 г K2Cr2O7 растворили
в разбавленной соляной кислоте, добавили избыток KI и выделившийся йод оттитровали, затратив 41,60 см3 раствора Na2S2O3. Рассчитайте молярную концентрацию эквивалента раствора Na2S2O3.
На титрование 3,0600 г средства для укладки волос израсходовали 24,70 см3 раствора йода с молярной концентрацией эквивалента 0,1028 моль/дм. Рассчитайте процентное содержание тиогликолевой кислоты в образце
(М= 92,10 г/моль). При титровании протекает реакция
2HSCH2COOH + I2 HOOC–CH2–S–S– CH2–COOH + 2HI.
Для определения содержания этилмеркаптана в смеси встряхивают пробу массой 1,6500 г с 50,00 см3 раствора I2 с молярной концентрацией эквивалента 0,1190 моль/дм в плотно закрытой колбе.
2С2H5SH + I2 С2H5S–SC2H5 + 2H+ + 2I-
На титрование избытка йода затратили 16,70 см3 раствора Na2S2O3
с молярной концентрацией эквивалента 0,1320 моль/дм. Рассчитайте содержание этилмеркаптана в смеси.
Нитритометрия
Нитриты обладают свойствами окислителей и используются для количественного определения восстановителей Sn2+, Fe2+, As2O3 и др. При этом нитриты восстанавливаются до оксида азота (II) (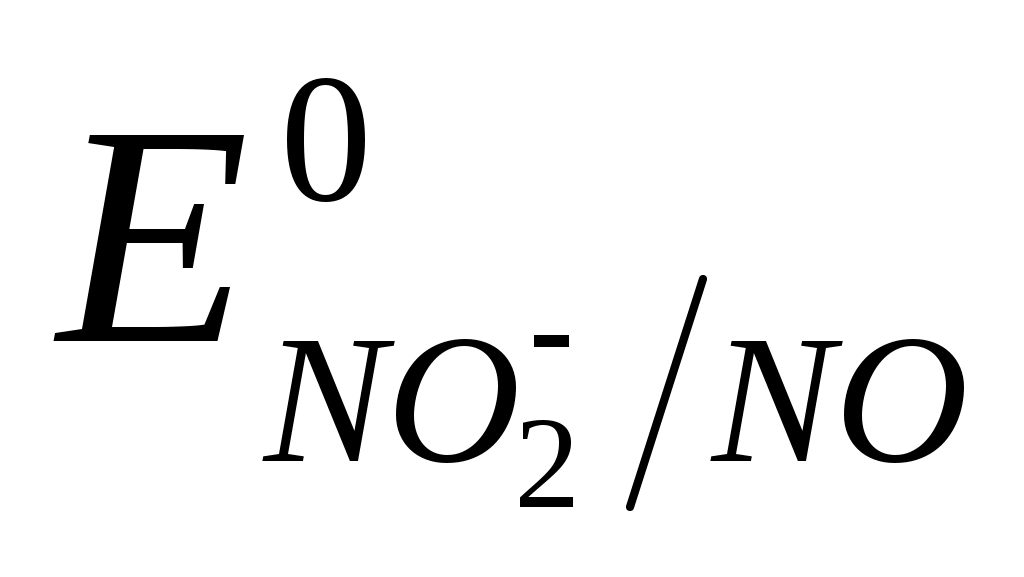 = +1,20 В): = +1,20 В):
2NaNO2 + 2FeSO4 + 2H2SO4 Fe2(SO4)3 + 2NO + Na2SO4 + 2H2O
Кроме того, NaNO2 вступает (в кислой среде) в реакцию с органическими ароматическими аминами, образуя соли диазония:
R-NH2 + NaNO2 + 2HCl [R-N+≡N]Cl- + 2H2O + NaCl
Реакция диазотирования органических соединений проходит количественно и широко используется в анализе органических соединений и лекарственных препаратов [15, 16], имеющих первичную аминогруппу, – стрептоцида, сульфацила, норсульфазола и др. В кислой среде NaNO2 также вступает в реакцию нитрозирования вторичных аминов, образуя нитрозосоединения:
R2NH + HNO2 → R2–N–N=O + H2O
Нитрозоамины затем могут быть восстановлены водородом до аминов или гидразинов и затем оттитрованы кислотой или KIO3.
Титрантами в методе нитритометрии являются 0,1 М или 0,5 М растворы NaNO2. Водные растворы NaNO2 с концентрацией 0,1 М и выше устойчивы
в течение четырёх недель. Нитрит натрия в связи с особенностями химического поведения не является первичным стандартом, поэтому приготовленные растворы требуют стандартизации. Титр раствора NaNO2 устанавливают
по стандарту – сульфаниловой кислоте, высушенной предварительно
до постоянной массы.
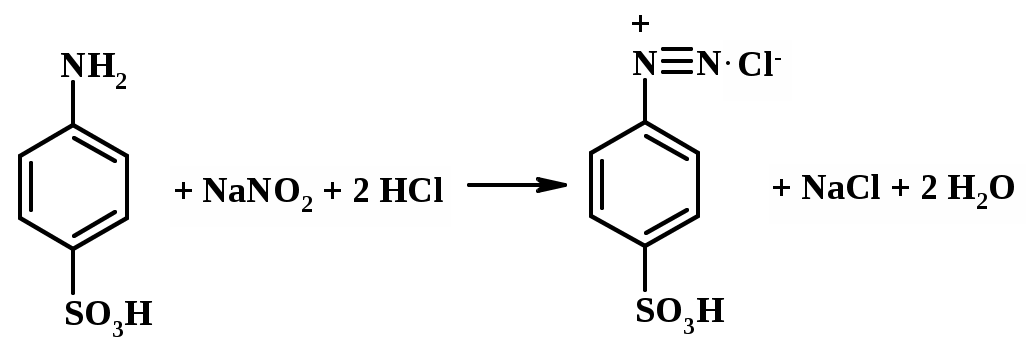
Навеску сульфаниловой кислоты растворяют в воде в присутствии
5% – ного раствора NaHCO3 [17, 18] (АККУРАТНО! : образуется водорастворимая соль сульфаниловой кислоты и бурно выделяется CO2), добавляют HCl, KBr и титруют 0,1 М раствором NaNO2, добавляя в раствор
в качестве индикатора 2–3 капли тропеолина 00 и 1–2 капли метиленового синего (нейтральный светофильтр).
ВНИМАНИЕ! Определение выполняют при температуре не выше
18–20°С. Скорость титрования должна быть замедленной: в начале
2,00 см3 в 1 минуту, в конце титрования – 0,05 см3 в 1 минуту.
Реакция диазотирования проходит медленно, для ускорения ее
к реакционной смеси добавляют KBr. Молярная масса эквивалента сульфаниловой кислоты М1/z =173,20 г/моль.
Кроме того, для установки титра раствора NaNO2 применяют титрованный раствор KMnO4:
5NaNO2 + 2KMnO4 + 3H2SO4 5NaNO3 + 2MnSO4 + 3H2O + K2SO4
Однако прямое титрование невозможно, так как в кислой среде нитрит натрия разлагается:
2 NaNO2 + H2SO4 NO +NO2 + Na2SO4 + H2O
Определение титра раствора NaNO2 ведут в присутствии серной кислоты способом обратного титрования. В колбу для титрования помещают рассчитанное количество стандартного раствора KMnO4, серную кислоту для создания среды и аликвоту NaNO2 (0,1 М) с таким расчетом, чтобы KMnO4 после протекания реакции остался в избытке. Остаток раствора KMnO4 можно определить двумя способами:
1) йодометрическим определением:
– к реакционной смеси прибавляют 30 мл 10 % – ного раствора KI:
2KMnO4 + 10KI + 8H2SO4 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Выделившийся I2 титруют стандартным раствором Na2S2O3:
I2 + 2Na2S2O3 Na2S4O6 + 2NaI;
При использовании растворов KMnO4 и Na2S2O3 с молярной концентрацией эквивалента 0,1000 моль/дм3
TNa2S2O3/NaNO3 = 0,00345 г/см3;
2) использованием стандартного раствора оксалата натрия.
Реакция взаимодействия избытка раствора перманганата калия с оксалатом натрия описывается уравнением
2KMnO4 + 5Na2C2O4 + 8H2SO4 = 2MnSO4 + K2SO4 + 10CO2 + 5Na2SO4 + 8H2O
Однако при прямом титровании затруднена регистрация точки эквивалентности, т.е. необходимо заметить исчезновение розовой окраски раствора перманганата калия, поэтому в данном случае используют способ титрования по остатку. В имеющуюся реакционную массу вводят точно измеренный объем стандартного раствора оксалата натрия. Объем раствора оксалата натрия на 10–15 см3 должен превышать объем раствора перманганата калия, оставшийся от взаимодействия с нитритом натрия. Избыточный объем оксалата натрия оттитровывают стандартным раствором перманганата калия. Расчет концентрации нитрита натрия проводят по формуле

где  – суммарный объем KMnO4, введенный в реакционную смесь – суммарный объем KMnO4, введенный в реакционную смесь
и затраченный на титрование остатка Na2C2O4
В нитритометрии [6] применяют внешние и внутренние индикаторы.
В качестве внешнего индикатора используют йодкрахмальную бумагу. Для этого полоску фильтровальной бумаги пропитывают раствором KI, наносят слой крахмала и высушивают. Бумага бесцветна. В конце титрования вещества в растворе появляется избыток NaNO2, который в кислой среде взаимодействует с KI, содержащимся в йодкрахмальной бумаге, с выделением I2:
2 NaNO2 + 2 KI + 4HCl 2 NaCl + 2KCl + I2 + 2NO + 2H2O
Йодкрахмальная бумага – внешний индикатор, в титруемый раствор опускать её нельзя. В ходе титрования каплю титруемого раствора время
от времени наносят на йодкрахмальную бумагу. В точке эквивалентности бумага синеет. Параллельно проводят контрольный опыт.
В качестве внутренних индикаторов в методе нитритометрии могут быть использованы редокс-индикаторы – тропеолин 00, смесь тропеолина 00
с метиленовым синим, который используют в качестве внутреннего светофильтра.
При применении тропеолина 00 окраска раствора изменяется от красной
к жёлтой, смеси тропеолина 00 с метиленовым синим – от красно-фиолетовой
к сине-зеленой.

тропеолин 00
Анализ веществ нитритометрическим методом проводят аналогично определению сульфаниловой кислоты. Например, аминосоединение – новокаин определяют титрованием раствора точной его навески 0,1 М NaNO2
в присутствии разведенной HCl и KBr и индикатора тропеолина 00 или смеси тропеолина 00 и метилового синего. Параллельно проводят контрольный опыт (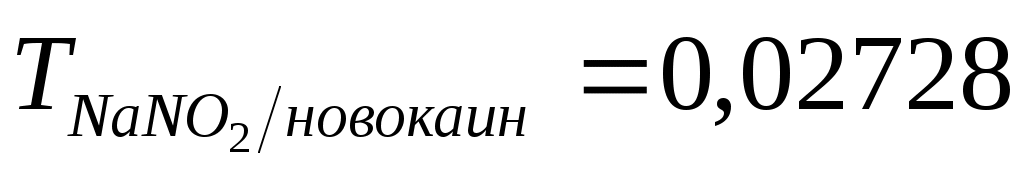 г/см3). г/см3).
Точку эквивалентности в нитритометрии можно определять также потенциометрически с использованием pH-метра с платиновым электродом.
Нитритометрия – метод, широко применяющийся на практике в анализе сульфаниламидных препаратов (САП), к которым относится группа соединений с общей формулой
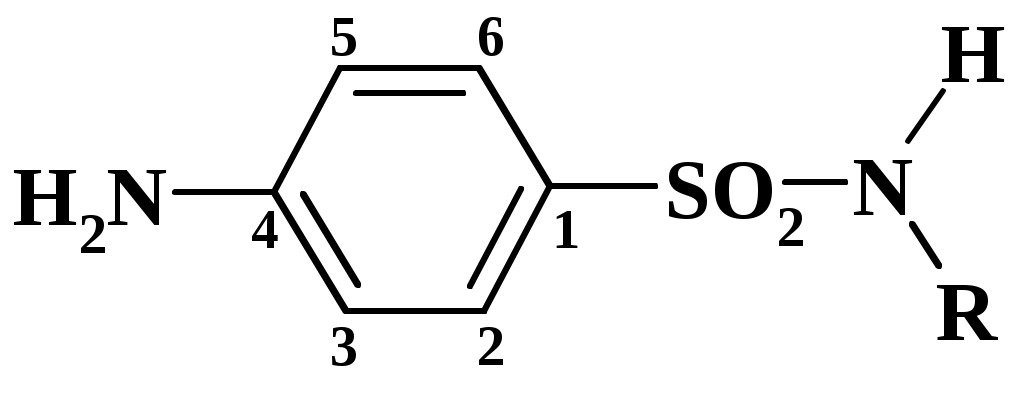
В качестве объекта исследования могут быть предложены порошки или таблетки следующих препаратов:
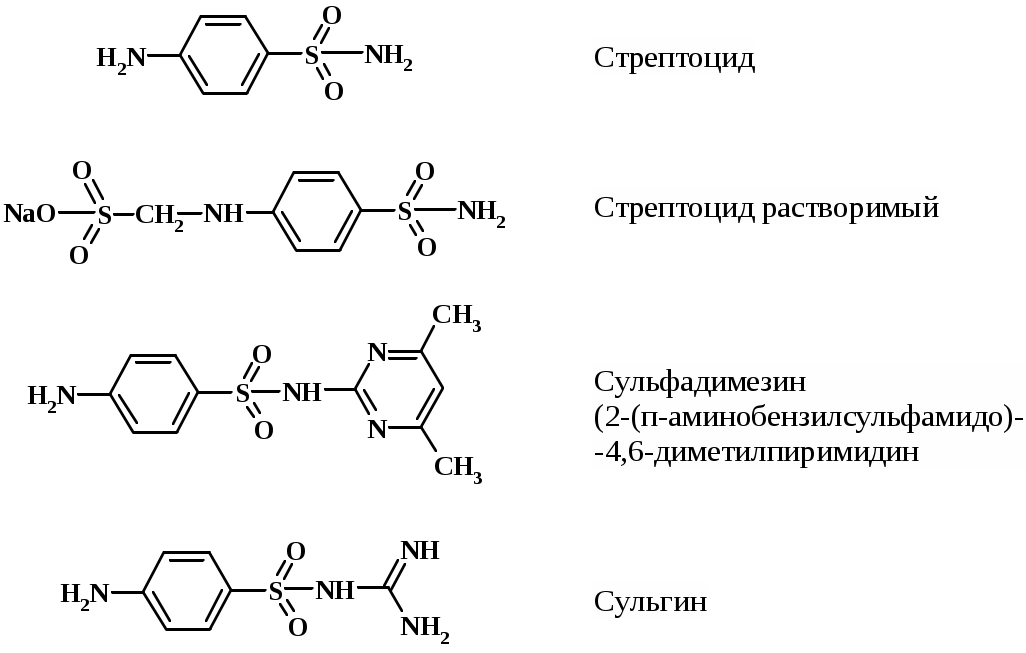
и другие.
САП образуют с нитритом натрия в кислой среде соли диазония. Взаимодействие САП с нитритом натрия упрощенно можно представить следующей схемой:
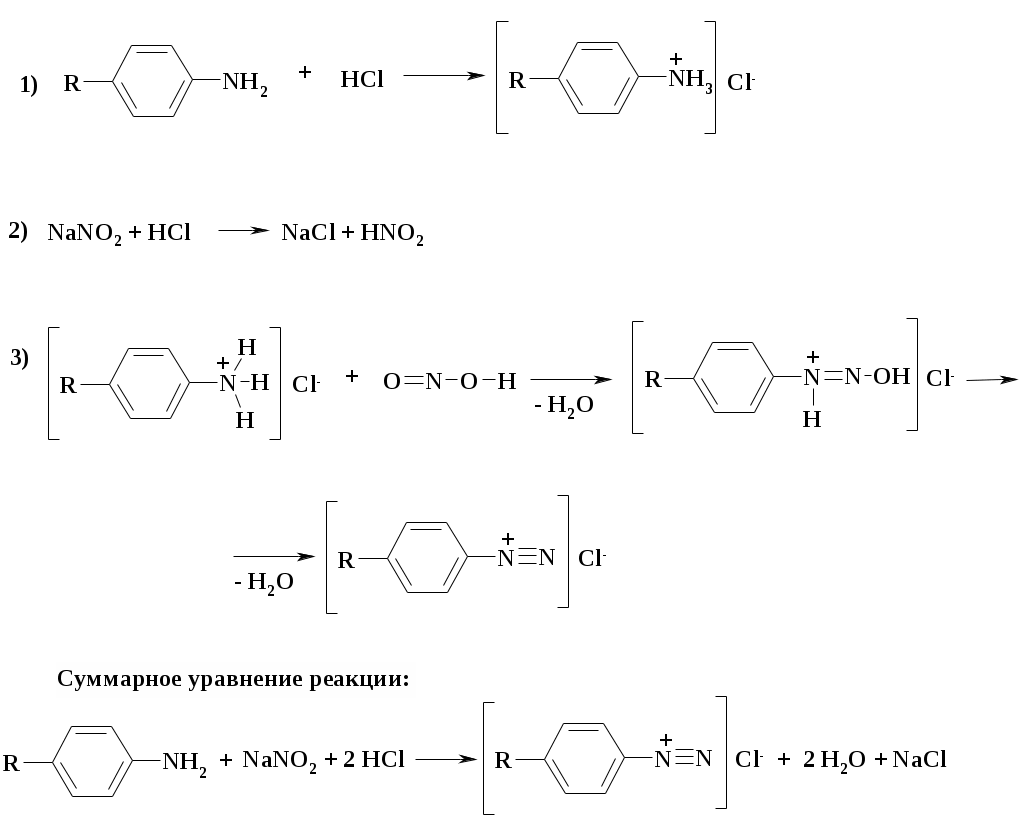
Между САП и нитритом натрия идет реакция со стехиометрическими коэффициентами 1:1. Титрование прямое, следовательно:
 , ,
где 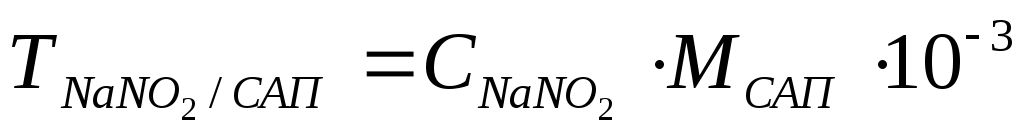 . .
лабораторная работа 7
Анализ лекарственных препаратов производных п-аминобензолсульфаниламида методом нитритометрии
Цель работы:
1) закрепление теоретических знаний о методе нитритометрии;
2) практическое применение данного метода титрования для определения массы сульфаниламида в препарате на примере растворимого стрептоцида.
Реактивы
1. Раствор оксалата натрия Na2C2O4 с молярной концентрацией эквивалента 0,1000 моль/дм3 – первичный стандарт.
Сульфаниловая кислота C6H4NH2SO3H, высушенная до постоянной массы, – первичный стандарт.
Раствор KMnO4 с молярной концентрацией эквивалента 0,1 моль/дм3.
Раствор серной кислоты H2SO4 с молярной концентрацией 2 моль/дм3.
Дистиллированная вода.
Раствор нитрита натрия NaNO2 с молярной концентрацией 0,1 М (молярная концентрация эквивалента 0,2 моль/дм3).
Раствор гидрокарбоната натрия NaHCO3 с массовой долей 5 %.
Раствор соляной кислоты HCl, разбавленной 1:3.
Бромид калия KBr кристаллический.
Раствор метиленового синего c массовой долей 0,2 % (нейтральный светофильтр).
Раствор тропеолина 00 с массовой долей 0,1 % (индикатор).
Ход работы:
1. Стандартизация раствора NaNO2.
1.1. Стандартизации раствора NaNO2 по раствору KMnO4
Раствор KMnO4 не является первичным стандартом, поэтому его стандартизуют по оксалату натрия.
1.1.1. Приготовление стандартного раствора Na2C2O4
Раствор оксалата натрия готовят объёмом 200,00 см3 с молярной концентрацией эквивалента 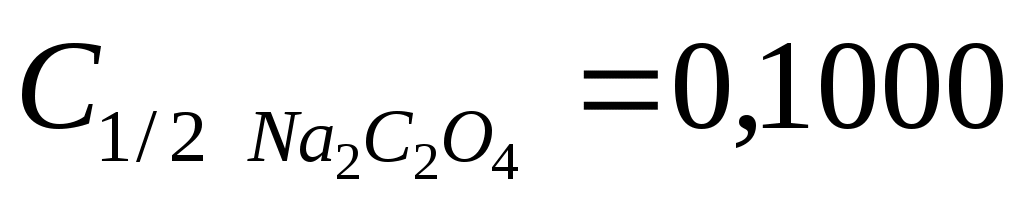 моль/дм3. моль/дм3.
Расчет массы навески, г: 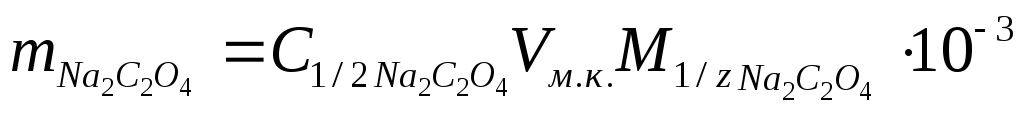 (масса берется с точностью до четвертого знака после запятой). (масса берется с точностью до четвертого знака после запятой).
C2O4 2- - 2e 2CO2
M1/z (Na2C2O4) = М(Na2C2O4 )/2 = 67,00 г/моль/
Взятие навески (взвешивание):
Масса часового стекла (стакана) 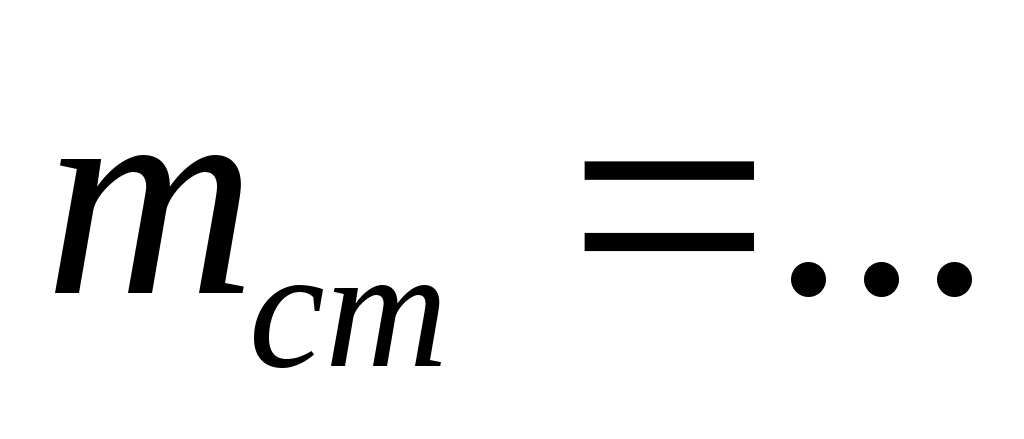
Масса часового стекла (стакана) с навеской 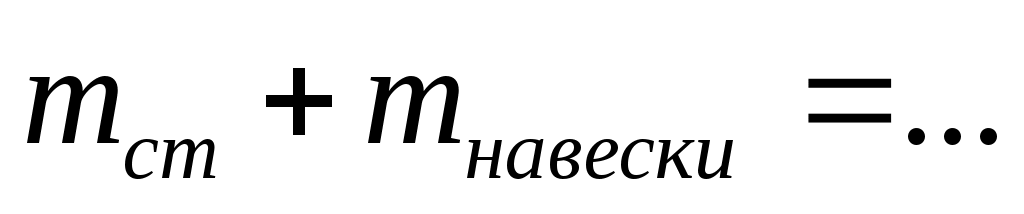
Масса навески 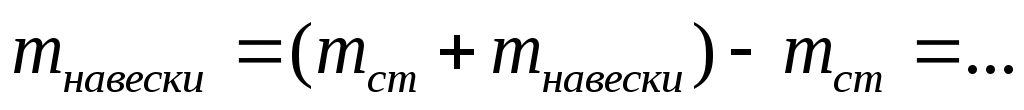
Навеску количественно переносят в мерную колбу (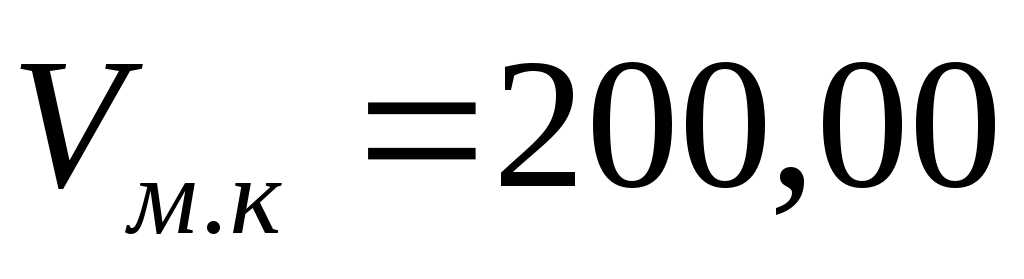 см3), добавляют 50 – 70 см3 дистиллированной воды, перемешивают до полного растворения оксалата натрия, доводят до метки дистиллированной водой см3), добавляют 50 – 70 см3 дистиллированной воды, перемешивают до полного растворения оксалата натрия, доводят до метки дистиллированной водой
и тщательно перемешивают.
1.1.2. Стандартизация раствора KMnO4
Кривую титрования Na2C2O4 раствором KMnO4 при [Н+]=1 строят самостоятельно.
Раствор KMnO4 применяется с молярной концентрацией эквивалента
0,1 моль/дм3.
Схема 14. Стандартизация раствора KMnO4 по раствору Na2C2O4

В коническую колбу для титрования вместимостью 250 см3 помещают 25,00 см3 раствора Na2C2O4 с молярной концентрацией эквивалента
0,1000 моль/дм3, прибавляют 15 см3 раствора серной кислоты с молярной концентрацией 2 моль/дм3, разбавляют горячей дистиллированной водой
(
70 см3) и титруют раствором KMnO4 до появления устойчивой слабо-розовой окраски от одной капли. Результаты титрований заносят в табл. 16. Концентрацию KMnO4 рассчитывают по закону эквивалентов:
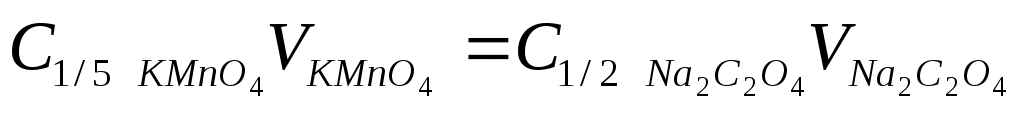 . .
Таблица 16
Результаты стандартизации раствора KMnO4 по Na2C2O4
№ опыта
|
Объем
Na2C2O4, см3
|
Объем
KMnO4,
см3
|
Концентрация
KMnO4, моль/дм3
|
Средняя концентрация KMnO4, моль/дм3
|
1
|
25,00
|
|
|
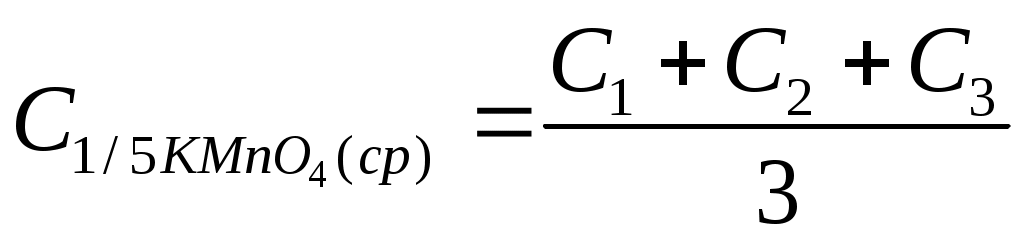
|
2
|
25,00
|
|

|
3
|
25,00
|
|
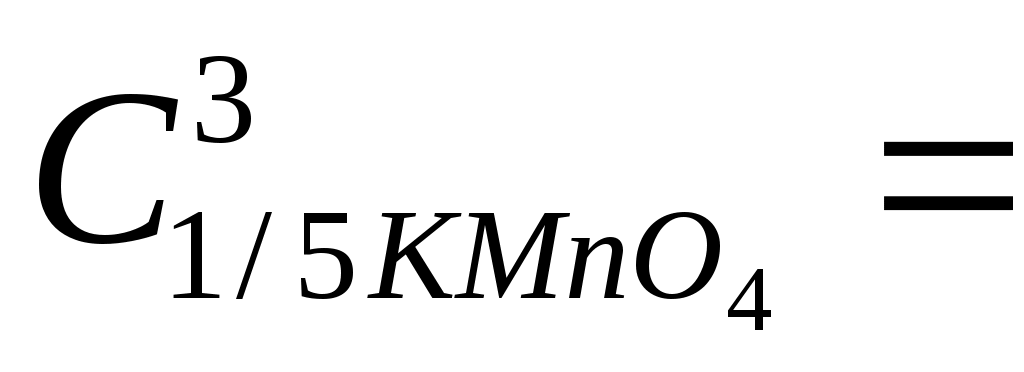
|
1.1.3. Приготовление и стандартизация раствора NaNO2
Раствор NaNO2 применяется 0,1 М (с молярной концентрацией эквивалента 0,2 моль/дм3).
Схема 15. Стандартизация раствора NaNO2 по раствору KMnO4 и Na2C2O4

В коническую колбу для титрования вместимостью 250 см3 помещают 30,00 см3 стандартного раствора KMnO4 ( = 0,1000 моль/дм3), прибавляют 20 см3 серной кислоты с молярной концентрацией 2 моль/дм3, 10,00 см3 NaNO2 (раствор перемешивают) и 25,00 см3 стандартного раствора Na2C2O4. К раствору приливают 70 см3 горячей дистиллированной воды. Избыток щавелевой кислоты (горячий раствор) оттитровывают стандартным раствором KMnO4 до появления устойчивой слабо-розовой окраски от одной капли. = 0,1000 моль/дм3), прибавляют 20 см3 серной кислоты с молярной концентрацией 2 моль/дм3, 10,00 см3 NaNO2 (раствор перемешивают) и 25,00 см3 стандартного раствора Na2C2O4. К раствору приливают 70 см3 горячей дистиллированной воды. Избыток щавелевой кислоты (горячий раствор) оттитровывают стандартным раствором KMnO4 до появления устойчивой слабо-розовой окраски от одной капли.
Концентрацию нитрита натрия рассчитывают по формуле
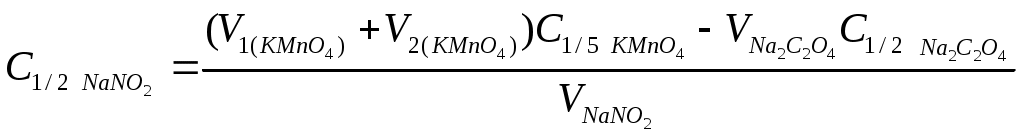 , ,
где V1 (KMnO4) – введенный в реакционную смесь объем титранта перманганата калия, см3;
V2 (KMnO4) – объем титранта перманганата калия, затраченный на титрование Na2S2O3, см3.
Результаты параллельных титрований заносят в табл. 17.
Таблица 17
Результаты стандартизации раствора NaNO2 по KMnO4
№ опыта
|
Введено
KMnO4,
V1,
см3
|
Объем раствора
NaNO2, см3
|
Объем раствора
Na2C2O4, см3
|
Объем
KMnO4,
V2,
см3
|
Концентрация NaNO2,
моль/дм3
|
Средняя концентра-ция NaNO2,
моль/дм3
|
1
|
30,00
|
10,00
|
25,00
|
|
C1=
|
|
2
|
30,00
|
10,00
|
25,00
|
|
C2=
|
3
|
30,00
|
10,00
|
25,00
|
|
C3=
|
1.2.Стандартизации раствора NaNO2 по сульфаниловой кислоте
Сульфаниловую кислоту предварительно высушивают при температуре 105°С до постоянной массы.
1.2.1. Приготовление стандартного раствора сульфаниловой кислоты
Раствор сульфаниловой кислоты готовят объёмом 100,00 см3 с молярной концентрацией 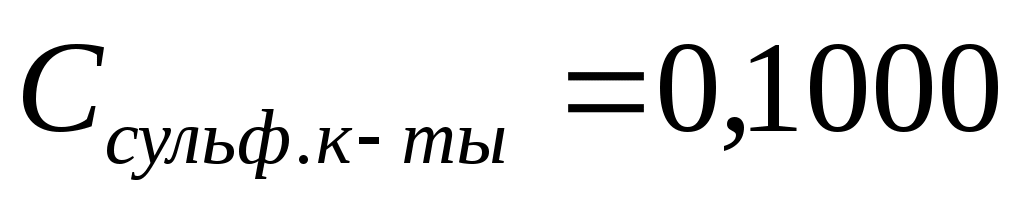 моль/дм3. моль/дм3.
Расчет массы навески, г: 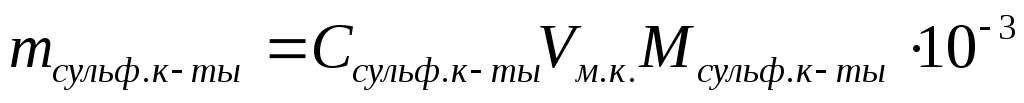 (масса берется с точностью до четвертого знака после запятой). (масса берется с точностью до четвертого знака после запятой).
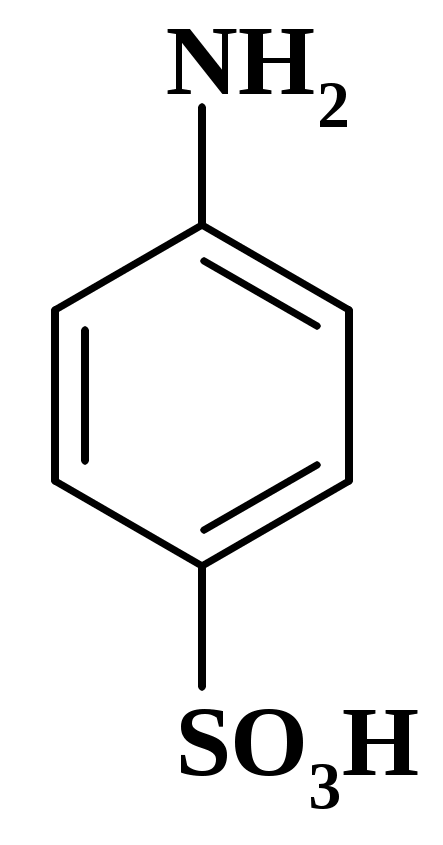
М1/z (сульфаниловой кислоты) = М (сульфаниловой кислоты)=173,20 г/моль.
Взятие навески (взвешивание):
Масса часового стекла (стакана) 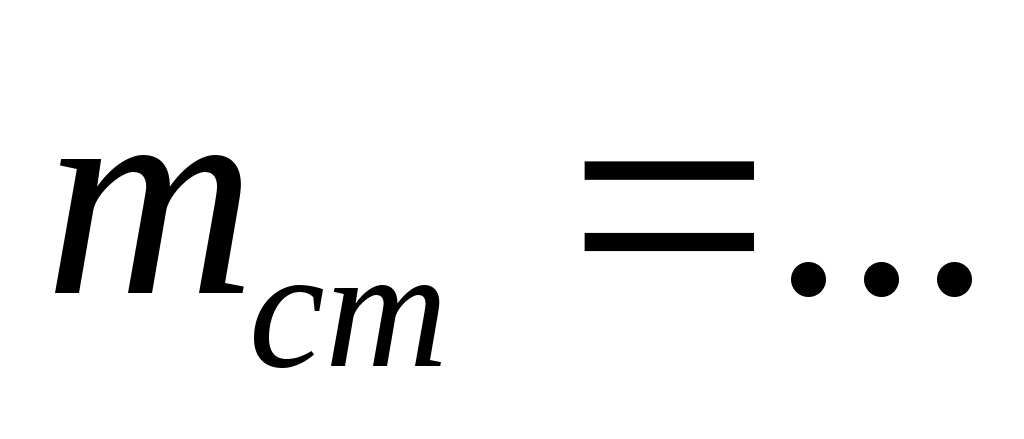
Масса часового стекла (стакана) с навеской 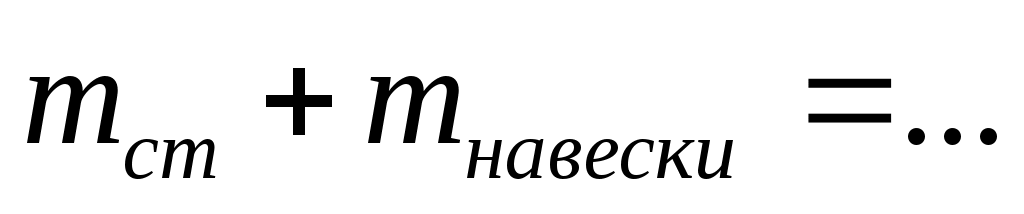
Масса навески 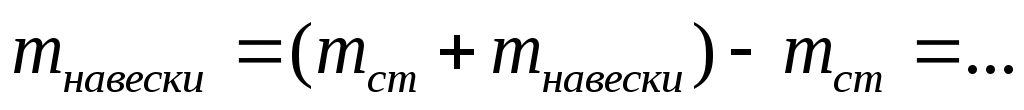
Навеску сульфаниловой кислоты растворяют в воде в присутствии
5 % –ного раствора NaHCO3 (АККУРАТНО! : образуется водорастворимая соль сульфаниловой кислоты и бурно выделяется CO2), количественно переносят в мерную колбу, доводят водой до метки и перемешивают.
Схема 16. Стандартизация раствора NaNO2 по раствору сульфаниловой кислоты

В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту сульфаниловой кислоты 20,00 см3, добавляют 10 мл HCl (1:3), кристаллы KBr, 2 капли тропеолина 00 и 1 каплю метиленового синего
и титруют 0,1 М NaNO2.
|
|
|
 Скачать 2.03 Mb.
Скачать 2.03 Mb.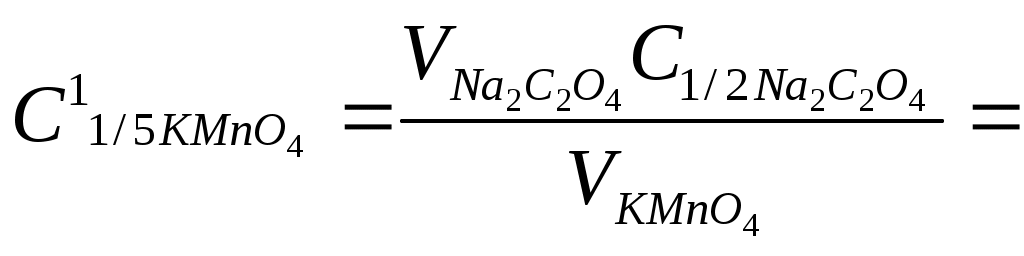

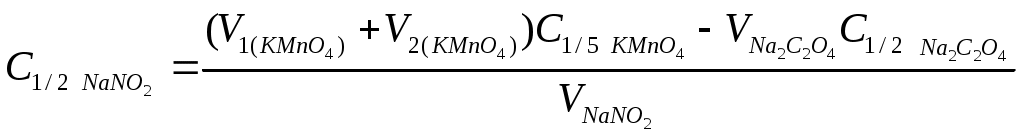 ,
,









