МетодКА январь. Лабораторная работа 1 Определение содержания уксусной кислоты 16 в растворе методом кислотноосновного титрования 16
 Скачать 2.03 Mb. Скачать 2.03 Mb.
|
10 см3 аммиачного буферного раствора с рН Расчетные формулы для построения кривых титрования в комплексонометрии До точки эквивалентности [Mn+]=(CMVM – CЭДТАVЭДТА )/(VМ +VЭДТА). (21) В точке эквивалентности [Mn+] = После точки эквивалентности[Mn+] = На рис. 9 показаны кривые титрования иона кальция в буферных растворах с различными значениями рН. Видно, что титрование Са2+ возможно только при рН 8. Классификация методов комплексонометрического титрования Метод прямого титрования. Применяют для анализа ионов металлов, быстро реагирующих с ЭДТА, при наличии подходящего индикатора. Титрование ведут стандартным раствором ЭДТА при определенном значении рН (буферный раствор) с выбранным металлохромным индикатором. Этим методом определяют Cu2+, Cd2+, Pb2+, Ni2+, Fe3+, Zn2+, Ca2+, Mg2+ и некоторые другие катионы (около 25 катионов). 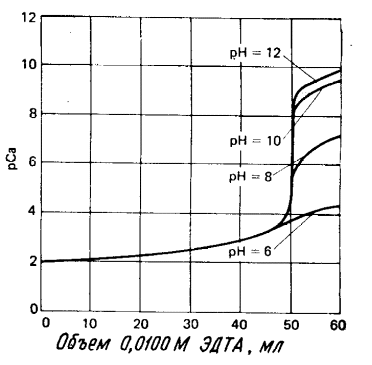 Рис. 9. Кривые комплексонометрического титрования ионов кальция раствором ЭДТА при разных рН раствора Метод обратного титрования. Метод обратного титрования применяют в тех случаях, когда реакция комплексообразования протекает медленно или отсутствует подходящий индикатор. В этом случае к анализируемому раствору прибавляют точно измеренный объем стандартного раствора ЭДТА, нагревают до кипения для завершения реакции и затем «на холоду» оттитровывают избыток ЭДТА титрованным раствором Mg2+, Zn2+ или Cu2+. Для установления точки эквивалентности применяют металл-индикатор, реагирующий на ионы магния, цинка или меди. Метод титрования заместителя. Метод основан на том, что ионы Mg2+ дают с ЭДТА менее устойчивое комплексное соединение (рКMgY2- = 8,7), чем подавляющее большинство других катионов. В связи с этим, если к катиону определяемого металла добавить комплексонат магния, произойдет реакция обмена и выделение эквивалентного количества ионов магния, которые титруют стандартным раствором ЭДТА. Sn4+ + MgY2- → SnY + Mg2+ Данный метод используется для высокозарядных ионов, гидролизующихся при рН > 1,5 (Bi3+, Sn4+, Th4+). Например, при определении ионов висмута (Bi3+) в анализируемый раствор при рН=1– 1,5 предварительно вводят комплексонат магния MgY2-, а затем выделившиеся ионы Mg2+ оттитровывают стандартным раствором ЭДТА при рН=10. лабораторная работа 3 Определение содержания кальция (II) и магния (II) в растворе при совместном присутствии методом комплексонометрии Цель работы: освоение метода комплексонометрического титрования; практическое применение метода комплексонометрии для определения массы кальция (II) и магния (II) в растворе при совместном присутствии. Реактивы 1. Раствор ЭДТА с молярной концентрацией 0,05 моль/дм3. 2. Н2О дистиллированная. 3. Стандартный раствор Mg (II) с молярной концентрацией 0,0250 моль/дм3. 4. Аммиачный буфер с рН = 9,5. 5. Раствор гидроксида калия КОН с массовой долей 5%. 6. Эриохром черный Т, индикаторная смесь3. 7. Калькон, индикаторная смесь. Теоретические основы метода: Метод основан на взаимодействии ионов Са2+и Мg2+ с динатриевой солью этилендиаминтетрауксусной кислоты (Na2H2Y2 или Na-ЭДТА) с образованием прочных комплексов в молярном отношении M:L=1:1 в определённом интервале рН. Для фиксирования точки эквивалентности при определении Са2+и Мg2+ используют калькон и эриохром черный Т. Определение Са2+ проводят при рН ≈ 12, при этом Mg2+ находится в растворе в виде осадка гидроксида магния и не титруется ЭДТА. Mg2+ + 2OH- = Mg(OH)2↓ Са2+ + Y4- CaY2- При рН ≈ 10 (аммиачный буферный раствор) Мg2+ и Са2+ находятся в растворе в виде ионов и при добавлении ЭДТА титруются совместно. Ca2+ + HY3- CaY2- + H+ Mg2+ + HY3- MgY2- +H+ Для определения объема ЭДТА, затраченного на титрование Mg2+, из суммарного объёма, пошедшего на титрование смеси при рН ≈ 10, вычитают объём, пошедший на титрование Са2+ при рН ≈ 12. Для создания рН ≈ 12 применяют 5% – ный раствор KOH, для создания рН ≈ 10 используют аммиачный буферный раствор (NH3H2O + NH4Cl). Ход выполнения работы: 1. Стандартизация титранта – раствора ЭДТА (Na2H2Y) Раствор ЭДТА готовят приблизительной концентрации 0,025 М из ≈ 0,05 М раствора, разбавляя его дистиллированной водой в 2 раза. Для стандартизации ЭДТА применяют стандартный раствор MgSO4 c концентрацией 0,02500 моль/дм3. Схема 5. Стандартизация титранта – раствора ЭДТА  В коническую колбу для титрования вместимостью 250 см3 помещают 20,00 cм3 стандартного раствора MgSO4 c концентрацией 0,02500 моль/дм3 , добавляют В коническую колбу для титрования вместимостью 250 см3 помещают 20,00 cм3 стандартного раствора MgSO4 c концентрацией 0,02500 моль/дм3 , добавляют |
| № опыта. | Объём MgSO4, см3 | Объём ЭДТА, см3 | Концентрация ЭДТА, моль/дм3 | Средняя концентрация ЭДТА, моль/дм3 |
| 1 | 20,00 | | | |
| 2 | 20,00 | | | |
| 3 | 20,00 | | |
2. Определение содержания Са2+
Кривые титрования Са2+ раствором ЭДТА при рН=10 и рН=12 строят самостоятельно.
Раствор задачи в мерной колбе доводят до метки дистиллированной водой и тщательно перемешивают.
Схема 6. Определение содержания Са2+ в растворе
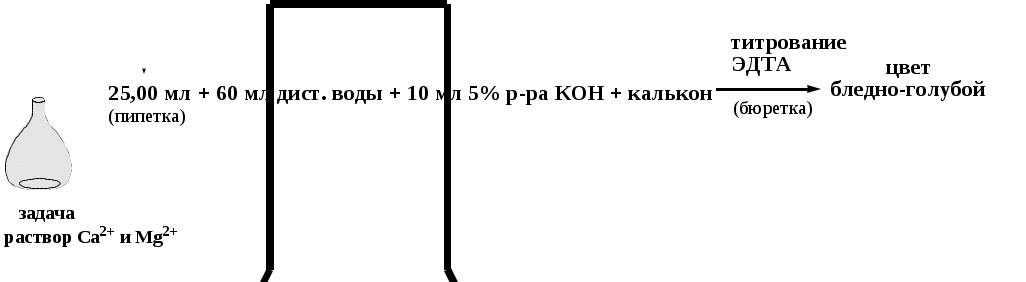 В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту исследуемого раствора 25,00 см3, содержащую кальций и магний, добавляют 60 см3 воды, 10 см3 5% – ного раствора КОН. После выпадения аморфного осадка Mg(OH)2↓ в раствор вносят индикатор калькон около 0,05 г (на кончике шпателя) и медленно титруют раствором ЭДТА до перехода окраски из розовой в бледно-голубую. Результаты титрования (V1) заносят в табл.7.
В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту исследуемого раствора 25,00 см3, содержащую кальций и магний, добавляют 60 см3 воды, 10 см3 5% – ного раствора КОН. После выпадения аморфного осадка Mg(OH)2↓ в раствор вносят индикатор калькон около 0,05 г (на кончике шпателя) и медленно титруют раствором ЭДТА до перехода окраски из розовой в бледно-голубую. Результаты титрования (V1) заносят в табл.7.Таблица 7
Результаты титрования раствора, содержащего кальций и магний
| № опыта | Объем исследуемого раствора, см3 | Объем ЭДТА, см3 | Содержание Са2+ в растворе, г |
| 1 | 25,00 | | |
| 2 | 25,00 | | |
| 3 | 25,00 | | |
| 4 | 25,00 | | |
| 5 | 25,00 | | |
3. Определение содержания Mg2+
Кривую титрования Mg2+ раствором ЭДТА при рН=10 строят самостоятельно.
Схема 7. Определение содержания Mg2+ в растворе

В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту 25,00 см3 исследуемого раствора, содержащую кальций и магний, добавляют 60 см3 дистиллированной воды, 10 см3 аммиачного буферного раствора с рН 9,5–10 и вносят индикатор эриохром чёрный Т около 0,05 г
(на кончике шпателя). При этом раствор окрашивается в винно-красный цвет. Раствор в колбе медленно титрируют раствором ЭДТА до перехода окраски из винно-красной в зелёную. Результаты титрования (V2) заносят в табл. 8.
Таблица 8
Результаты титрования раствора, содержащего кальций и магний
| № опыта | Объем исследуемого раствора, см3 | Объем ЭДТА, V∑, см3 | Содержание Mg2+ в растворе, г |
| 1 | 25,00 | | |
| 2 | 25,00 | | |
| 3 | 25,00 | | |
| 4 | 25,00 | | |
| 5 | 25,00 | | |
4. Статистическая обработка результатов анализа
См. лабораторную работу № 1.
Вывод: приводят полученные данные в виде
лабораторная работа 4
Определение содержания меди(II) в растворе
методом комплексонометрии
Цель работы:
закрепление теоретических знаний о методе комплексонометрии;
практическое применение метода комплексонометрического титрования для определения массы меди (II) в растворе.
Реактивы
Раствор ЭДТА с молярной концентрацией 0,05 моль/дм3.
Стандартный раствор Cu(II) с титром 2,0010-3 г/дм3.
Н2О дистиллированная.
Аммиачный буфер с рН 8 – 8,5.
Мурексид, индикаторная смесь.
Сущность метода (теоретические основы)
Метод определения меди (II) в растворе основан на образовании комплексного соединения меди (II) с ЭДТА при определенном значении рН, которое создается введением аммиачного буфера.
Ход выполнения работы:
1. Стандартизация титранта - раствора ЭДТА (Na2H2Y).
Раствор ЭДТА готовят приблизительной концентрации 0,025 моль/дм3 из 0,05 М раствора, разбавляя его дистиллированной водой. Для стандартизации ЭДТА применяют стандартный раствор Cu2+ c титром Т = 2,0010-3 г/дм3, приготовленный из точной навески катодной меди, с массовой долей основного вещества 99,99 %.
Схема 8. Стандартизация титранта – раствора ЭДТА

В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту 10,00 см3 стандартного раствора Сu2+, добавляют 70 – 80 см3дистиллированной воды, 10 см3 аммиачного буферного раствора (рН 8 – 8,5) и вносят индикатор мурексид около 0,05 г (на кончике шпателя). Раствор перемешивают и титруют до перехода окраски от желто-зеленой до фиолетовой (лиловой). Результаты титрования заносят в табл. 9. Рассчитывают молярную концентрацию раствора ЭДТА и
Таблица 9
Результаты стандартизации раствора ЭДТА
| № опыта | Объем Сu(II) ( cм3 | Объем ЭДТА ( | Концентрация раствора ЭДТА, моль/дм3 | Средняя концентрация ЭДТА ( |
| 1 | 10,00 | | | |
| 2 | 10,00 | | | |
| 3 | 10,00 | | |
2. Определение содержания меди (II) в растворе.
Методика определения идентична стандартизации ЭДТА.
Кривую титрования Cu2+ раствором ЭДТА при рН = 8–8,5 строят самостоятельно.
Раствор задачи в колбе доводят до метки дистиллированной водой
и тщательно перемешивают.
Схема 9. Определение содержания Cu2+ в растворе

В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту 10,00 см3 анализируемого раствора Сu2+, добавляют 70 – 80 см3дистиллированной воды, 10 см3 аммиачного буферного раствора с рН8 – 8,5 и вносят индикатор мурексид около 0,05 г (на кончике шпателя). Раствор перемешивают и титруют до перехода окраски от желто-зеленой до фиолетовой (лиловой). Результаты титрования заносят в табл. 10.
Таблица 10
Результаты титрования раствора, содержащего Cu(II)
| № опыта. | Объем исследуемого раствора, см3 | Объем раствора ЭДТА ( | Содержание меди (II) в растворе, г |
| 1 | 10,00 | | или |
| 2 | 10,00 | | |
| 3 | 10,00 | | |
| 4 | 10,00 | | |
| 5 | 10,00 | | |
