Рабочая лекционная тетрадь по Контролю качества. Лекарственные средства, производные спиртов Спирт этиловый
 Скачать 1.99 Mb. Скачать 1.99 Mb.
|
Лекарственные средства, производные лактонов ненасыщенных полиоксикарбоновых кислотКислота аскорбиноваяAcidum ascorbinicum Vitaminum C Ascorbic acid * 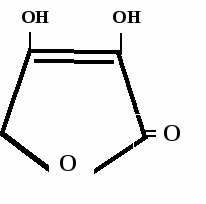 H | HO – CH | CH2 - OH γ-лактон-2,3-дегидро-L-гулоновой кислоты Свойства Белый кристаллический порошок, без запаха, кислого вкуса. Легко растворим в воде, спирте, нерастворим в эфире, хлороформе, бензоле. Водные растворы имеют кислую реакцию. На свету легко окисляются и желтеют в присутствии металлов. 1. кислотные св-ва → замещение на металл  ОН ОН ОNa ОН ОН ОН ОNa ОН+ NaOH → + Н2О  ОН ОН [O] О О ОН ОН [O] О О→ ендиольная форма кето-форма аскорбиновая к-та дегидроаскорбиновая к-та Подлинность
 ОН ОН О О ОН ОН О О+ 2 AgNO3 → + 2 Ag↓ + 2 HNO3
 ОН ОН О О ОН ОН О О+ I2 → + HI Экспресс-анализ
 ОН ОН О О ОН ОН О О+ 2 FeCl3 → + 2 FeCl2 + 2 HCl
 ОН ОН О О ОН ОН О О+ KMnO4 → + Mn2+
 ОН ОН Cl О О ОН ОН Cl О О+ O N OH→ + Cl синий  Cl Cl+ HO NH OH Cl Бесцветный
 ОН ОН COONa О О COONa ОН ОН COONa О О COONat0 + 2 HC – O → + Cu2O↓ + HC - OH \ | Cu HC -OH / | HC – O COOK | COOK
       О О     Н ОН Н ОН      t0 О О t0 О О + 2 [Ag(NH3)2]OH → + 2 Ag↓ + 4 NH3↑ + 2 H2O + 2 [Ag(NH3)2]OH → + 2 Ag↓ + 4 NH3↑ + 2 H2O
 ОН ОН О О ОН ОН О О+ K2[HgI4] + 2 KOH → + Hg↓ + 4 KI + 2 H2O (Реакции 5,6,7 – их нельзя использовать, если есть глюкоза)
 ОН ОН О О ОН ОН О О2 + 4 K3[Fe(CN)6] → 2 + 3 К4[Fe(CN)6] + H4[Fe(CN)6] 3 К4[Fe(CN)6] + 4 FeCl3 → Fe4[Fe(CN)6]3 + 12 КCl Количественное определение По ГФ Метод йодатометрии, способ прямого титрования Метод основан на восстановительных свойствах пр-та за счет ендиольной группировки. Методика: Тн пр-та растворяют в воде + разведенная HCI + р-р KI + крахмал, титруют 0,1 н р-ром КIО3 до слабо синего окрашивания.  ОН ОН О О ОН ОН О О3 + КIО3 → 3 + КI + 3 Н2О 1 моль 1 экв. KIO3 + 5 KI + 6 HCl → I2 + 6 KCl + 3 H2O fэкв = 1 М1/z = М Экспресс-анализ
Метод основан на восстановительных свойствах препарата за счет ендиольной группировки. Методика: Тн пр-та растворяют в воде + разведенная HCI и титруют 0,1 н р-ром йода до желтого окрашивания. (NB! При титровании растворов аскорбиновой кислоты для инъекций следует учитывать восстановительную способность стабилизатора – гидросульфита натрия – поэтому перед началом титрования к такому раствору добавляют формалин, который будет связывать стабилизатор.) ( NaHSO3 + HCOH → HO-CH2- O-SO2Na )  ОН ОН О О ОН ОН О О+ I2 → + HI 1 моль 1 экв. fэкв = 1 М1/z = М
Метод основан на кислотных свойствах препарата за счет подвижного атома водорода в третьем положении. Методика: Тн пр-та раств в воде + ф/ф и титруют 0,1 н р-ром NaOH до слабо розового окрашивания.           ОН ОН ОН ОН      ОNa ОН ОNa ОН  + NaOH → + Н2О + NaOH → + Н2Омоль экв. fэкв = 1 М1/z = М Применение Профилактика, лечение цинги, инфекционные заболевания, интоксикации, авитаминоз. ФВ: таблетки, порошок, ампульные растворы. Хранение В ХУТ, в защищенном от света месте. Лекарственные средства, производные ароматических кислот Кислота бензойная Acidum benzoicum  С6Н5- СООН С6Н5- СООНСвойства: Бесцветные игольчатые кристаллы или белый мелкокристаллический порошок. Мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, эфире¸ хлороформе, растворим в жирных маслах. При нагревании возгоняется, перегоняется водяным паром. Ароматические к-ты мало растворимы в воде, но легко растворимы в органических растворителях. Они сильнее карбоновых кислот жирного ряда, т.к бензойная кислота сильнее уксусной в 4 раза. Подлинность
  Реакция выполняется в слабо щелочной среде, т.к. в кислой среде осадок комплексной соли будет растворятся, а при избытке будет выпадать Fe(OH)3. Количественное определение Метод нейтрализации, вариант замещения, способ прямого титрования Метод основан на кислотных свойствах препарата за счёт карбоксильной группы. Методика: Тн пр-та раств в нейтральном по фенолфталеину спирте и титруют 0,1 н раствором NaOH с этим же индикатором до слабо розового окрашивания.  моль экв. fэкв. = 1 M1/z = М Применение Как мягкий антисептик в мазях и для консервирования продуктов питания. Действует как отхаркивающее средство, но внутрь не применяется, т.к обладает раздражающим действием на слизистую желудка. Хранение В ХУТ, т.к бензойная кислота летуча Натрия бензоат Natrii benzoas Natrium benzoicum  Натриевая соль бензойной кислоты С6Н5СООNa Натриевая соль бензойной кислоты С6Н5СООNaСвойства Белый кристаллический порошок, без запаха или с очень слабым запахом, сладковато- солёного вкуса. Получают нейтрализацией бензойной кислоты. Подлинность
А) (ГФ XII) Na+ + K[Sв(OH)6] Na[Sв(OH)6]↓ + K+ белый осадок Б) «сухим путем» – желтое окрашивание пламя горелки В) (ГФ XI) Zn(UO2)3(CH3COO)8 + Na+ + CH3COOH + 9 H2O NaZn[(UO2)3(CH3COO)9]9H2O↓ + H+ осадок желтого цвета Г) МКС) с пикриновой кислотой→ желтые игольчатые кристаллы, выходящие из одной точки. 2. Реакции на бензоат-ион
 Б) с азотной кислотой→ бензойная кислота  Количественное определение Метод нейтрализации, вариант вытеснения, способ прямого титрования. Метод основан на вытеснении слабой карбоновой кислоты более сильной минеральной кислотой. Методика: Тн препарата растворяют в воде + эфир для растворения и извлечения бензойной кислоты + индикатор метиловый оранжевый и метиленовый синий и титруют 0,5 н раствором HCI до появления сиреневой окраски в водном слое.  моль экв. fэкв. = 1 M1/z = М Применение Как отхаркивающее средство при кашле в порошках, таблетках, микстурах. Обладает меньшим раздражающим действием, чем бензойная кислота. Хранение в ХУТ. Лекарственные средства, производные фенолокислот. Кислота салициловая Acidum salicylicum  Свойства Белые мелкокристаллические кристаллы или лёгкий кристаллический порошок, без запаха, летуч с водяным паром, при нагревании возгоняется. Мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, эфире, трудно растворим в хлороформе. Подлинность

 CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Количественное определение: Метод нейтрализации, вариант вытеснения, способ прямого титрования. Метод основан на вытеснении слабой карбоновой кислоты более сильной минеральной кислотой. Методика: Тн пр-та растворяют в нейтрализованном по ф/ф спирте и титруют с тем же индикатором 0,1 н р-ром NaOH до слабо розового окрашивания.  - СООН - COONa + NaOH → + Н2О \ \ ОН ОН моль экв. fэкв. = 1 M1/z = М Применение Наружно, как антисептик, противогрибковое действие. Кератолитическое действие для разрушения ороговевших тканей. В мазях 1-10%, в пастах 1% и 2%, спиртовых растворах, присыпках. Хранение В ХУТ, предохраняющей от действия света. Натрия салицилат Natrii salicylas Natrium salicylicum  Натриевая соль салициловой кислоты Натриевая соль салициловой кислоты Свойства Белый кристаллический порошок или мелкие чешуйки, без запаха, сладковато- солёного вкуса. Порошок растворим в воде, легко в глицерине, растворим в спирте, практически нерастворим в эфире. Подлинность
А) (ГФ XII) Na+ + K[Sв(OH)6] Na[Sв(OH)6]↓ + K+ белый осадок Б) «сухим путем» – желтое пламя горелки В) (ГФ XI) Zn(UO2)3(CH3COO)8 + Na+ + CH3COOH + 9 H2O NaZn[(UO2)3(CH3COO)9]9H2O↓ + H+ желтый осадок Г) МКС) с пикриновой кислотой→ желтые игольчатые кристаллы, выходящие из одной точки. 2. На салицилат-ион А) На фенольный гидроксил – с FeCI3 → сине-фиолетовое окрашивание, которое исчезает при добавлении разведенной хлороводородной кислоты. Б) с азотной кислотой → образуется салициловая кислота  - СООNa - COOН - СООNa - COOН+ HNO3 → ↓ + NaNO3 \ \ ОН ОН Количественное определение Метод нейтрализации, вариант вытеснения, способ прямого титрования. Метод основан на вытеснении слабой карбоновой кислоты более сильной минеральной кислотой. Методика: Тн препарата растворяют в воде + эфир + индикатор метиловый оранжевый и метиленовый синий и титруют 0,5 н раствором HCI до появления сиреневого окрашивания в водном слое.  белый белый 1 моль 1 экв. fэкв. = 1 M1/z = М Применение Противовоспалительное, противоревматическое, жаропонижающее средство. Применяют внутрь в порошках. Хранение В ХУТ, предохраняющей от действия света, в сухом месте, т. к фенольный гидроксил может окисляться. Кислота ацетилсалициловая Acidum acetylsalicylicum Aspirinum  Салициловый эфир уксусной кислоты Салициловый эфир уксусной кислотыСвойства Бесцветный кристаллический или белый кристаллический порошок, без запаха или со слабым запахом, слабо кислого вкуса. Препарат устойчив в сухом воздухе, во влажном гидролизуется с образование уксусной и салициловой кислот. Мало растворим в воде, легко в спирте, растворим в хлороформе, эфире, растворах щелочных металлов. Получение: взаимодействие салициловой кислоты с уксусным ангидридом при нагревании.  Подлинность
 При добавлении серной кислоты выпадает в осадок салициловая кислота (серная кислота вытесняет слабую органическую кислоту из ее соли).  Наличие салициловой кислоты подтверждается по фиолетовому окрашиванию с раствором FeCI3. Наличие уксусной кислоты подтверждается по образованию уксусно-этилового эфира. 2. с формальдегидом → образуется продукт конденсации розового цвета.  Образующуюся салициловую кислоту определяют по фиолетовому окрашиванию. 3. чистота (УФ, ИК, t плавления) |
