Струков Патологическая анатомия. Литература для студентов медицинских институтов А. И. Струков В. В. Серов Патологическая анатомия Издание второе
 Скачать 16.97 Mb. Скачать 16.97 Mb.
|
|
Изменения периферической лимфоидной ткани, возникающие при нарушениях иммуногенеза Наиболее характерны изменения периферической лимфоидной ткани при антигенной стимуляции и наследственной ее недостаточности. 1. При антигенной стимуляции (сенсибилизации) организма изме- нения периферической лимфоидной ткани однозначны и выражаются м а - крофагальной реакцией, гиперплазией ретикулярных кле- ток и лимфоцитов с последующей плазмоцитарной их трансформацией. Эти изменения дополняются повышением проницае- мости микрососудов, отеком интерстиция и накоплением в нем белково-поли- сахаридных (ШИК-положительных) веществ (тканевой диспротеиноз). Степень макрофагально-плазмоцитарной трансформации лимфоидной ткани отражает напряженность иммуногенеза и прежде всего уровень выработки ан- тител (иммуноглобулинов) клетками плазмоцитарного ряда. Особенно ярко изменения при антигенной стимуляции проявляются в лимфатических узлах (прежде всего регионарных к месту поступле- ния антигена) и селезенке. В лимфатических узлах (рис. 92), которые увеличиваются, стано- вятся полнокровными и отечными, в корковом их слое, в светлых центрах  фолликулов и мозговом слое появляет- ся большое число плазмобластов и плазматических клеток. Они вытесняют лимфоциты. Отмечаются пролифера- ция и десквамация клеток синусов, об- разование большого количества макро- фагов и белково-полисахаридных ве- ществ в строме. Селезенка (рис. 93) увеличивается, выглядит полнокровной и сочной, на ее разрезе хорошо видны большие фолликулы. Отмечаются рети- кулярная гиперплазия и плазматизация как красной пульпы, так и особенно фолликулов селезенки, периферическая зона которых сплошь состоит из плаз- мобластов и плазматических клеток. В красной пульпе наряду с плазмо- бластами много макрофагов. Рис. 92. Ретикулоплазмоцитарная трансфор- мация ткани лимфатического узла при анти- генной стимуляции. Если в ответ на антигенную стимуляцию развиваются преимущественно клеточные им- мунные реакции, то в лимфатических узлах и селезенке пролиферируют в основном сенсибили- 148   Рис. 93. Ретикулоплазмоцитарная трансфер- Рис. 94. Макрофагально-плазмоцитарная ин- мация фолликулов селезенки при антигенной фильтрация легких при антигенной стиму- стимуляции. ляции. зированные лимфоциты, а не плазмобласты и плазматические клетки. При этом происходит рас- ширение Т-зависимых зон. Те же изменения в виде ретикулярной гиперплазии и макрофагально-плаз- моцитарной трансформации, а в ряде случаев и миелоидной метаплазии обна- руживаются в костном мозге, портальных трактах и синусоидах пе- чени, в альвеолярных перегородках, периваскулярной и перибронхиальной ткани легких (рис. 94), в интерстиции почек поджелудочной же- лезы, кишечника, в межмышечных прослойках, жировой ткани и т. д. 2. Наследственная недостаточность периферической лимфоид- ной ткани характеризуется изменениями как селезенки, так и особенно лимфа- тических узлов. Вселезенке размеры фолликулов значительно уменьшены, светлые центры и плазматические клетке отсутствуют. Влимфатических узлах отсутствуют фолликулы и коркввыи слой (В-зависимые зоны), сохра- нен лишь околокорковый слой (Т-зависимая зона). Эти изменения характерны для наследственных иммунодефицитных синдромов, связанных с дефектом гу- морального иммунитета (см. с. 156). Реакции гиперчувствительности Реакции гиперчувствительности это местные иммунные (ал- лергические) реакции, совершающиеся в сенсибилизированном организме. Механизм развития реакций гиперчувствительности различен. Выделяют пять механизмов, с которыми связаны реакции гиперчувствительности. Первый механизм связан с аллергическими антителами, или реагина- ми (IgE), которые фиксируются на поверхности клеток (лаброциты, базо- филы). Выброс медиаторов при соединении антител с клеткой (антигеном) ве- дет к развитию острого воспаления — анафилактических реакций немедленнного типа. Второй механизм представлен цитотоксическим и цитолитическим действием на соответствующие клетки циркулирующих антител и (или) комп- 149 лемента — цитотоксические реакции. Цитолиз может быть обуслов- лен либо комплементом (цитотоксичность, опосредованная комплемен- том), который активируется при соединении антител с антигеном, либо анти- телами (цитотоксичность, опосредованная антителами), которые связаны с клетками — К-клетки и NK-клетки (схема IX). 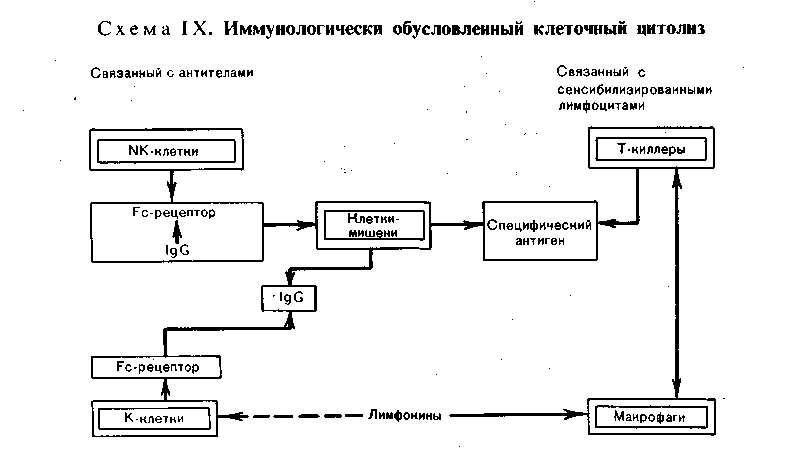 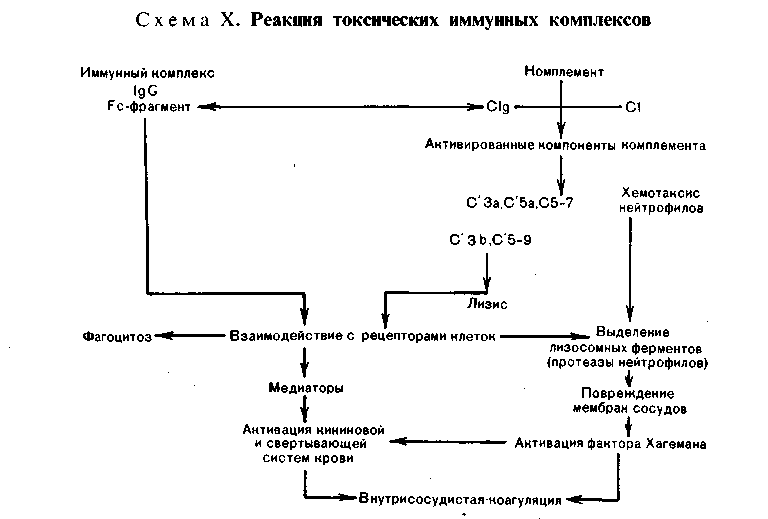 150 Третий механизм связан с токсическим действием на клетки и ткани циркулирующих иммунных комплексов, что ведет к активации компонентов комплемента и развитию острого воспаления — реакции токсических иммунных комплексов (схема X). 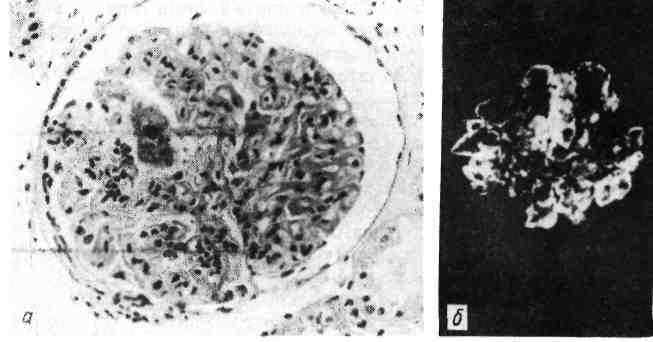 Рис. 95. Реакция гиперчувствительности немедленного типа. а — фибриноидное набухание и фибриноидный некроз капилляров почечного клубочка при системной красной волчанке; б—в участках фибриноида фиксация IgG. Иммунолюминесцентное исследование. Четвертый механизм обусловлен действием на ткани эффекторных клеток — лимфоцитов-киллеров и макрофагов. Развиваются цито- лиз, обусловленный л и м ф о ц и т а м и, и воспалительная реакция. Пятый механизм — гранулематоз (см. с. 132). Следовательно, одни иммунологические механизмы являются проявлением гуморального иммунитета (антитела, компоненты комплемента, циркулирую- щие комплексы антиген — антитело), другие — клеточного иммунитета (лимфо- циты, макрофаги). Это определяет характер реакций гиперчувствительности и принципы их классификации. Реакции, связанные с иммунопатологическими механизмами, являющимися проявлением гуморального иммунитета, назы- вают реакциями гиперчувствительности немедленного т и - п а (ГНТ), а связанные с иммунопатологическими механизмами, являющими- ся проявлением клеточного иммунитета — реакциями гиперчувстви- тельности замедленного типа (ГЗТ). Кроме того, выделяют реакции трансплантационного иммунитета (реакции от- торжения). Морфологическая характеристика. 1. Реакция гиперчувствитель- ности немедленного типа (ГНТ). Для этой реакции характерна мор- фология острого иммунного воспаления (А. И. Струков), которо- му свойственны быстрота развития, преобладание альтеративных и сосудис- то-экссудативных изменений, медленное течение репаративных процессов. Аль- теративные изменения касаются преимущественно стенок сосудов, основного вещества и волокнистых структур соединительной ткани. Они представлены плазматическим пропитыванием, мукоидным и фибриноидным набуханием (рис. 95). Крайним выражением альтерации является характерный для ГНТ фибриноидный некроз. С ярко выраженными плазморрагическими и сосуди- сто-экссудативными реакциями связано появление в очаге иммунного воспа- ления грубодисперсных белков, фибриногена (фибрина), нейтрофилов, «пере- варивающих» иммунные комплексы, и эритроцитов. В связи с этим наиболее характерным для ГНТ становится фибринозный или фибринозно- геморрагический экссудат. Пролиферативно-репаративные реакции при ГНТ развиваются позже и выражены слабее. Они проявляются пролифе- рацией клеток эндотелия и перителия (адвентиции) сосудов и во времени со- 151 впадают с появлением мононуклеарно-гистиоцитарных элементов, что отра- жает элиминацию иммунных комплексов и начало репаративных процессов. Оценка морфологических изменений при ГНТ, их принадлежность к иммун- ной реакции требуют доказательств с помощью иммуногистохимического ме- тода (см. рис. 95). Наиболее типично динамика морфологических изменений при ГНТ пред- ставлена при феномене Артюса, который возникает у сенсибилизиро- ванных животных при локальном введении разрешающей дозы антигена. В патологии человека ГНТ составляет сущность многих бактериальных ин- фекций, аллергических заболеваний и процессов, протекая с преобладанием альтеративных или сосудисто-экссудативных изменений. Проявления ГНТ с преобладанием альтерации (казеозный некроз) постоянны при туберкулезе, сифилисе, они лежат в основе сосудистых изменений (фибриноидный некроз) при системной красной волчанке, гломерулонефрите, узелковом периартерии- те и др. Сосудисто-экссудативные проявления ГНТ ярко выражены при крупозной пневмонии; к ним относятся полисерозиты и артриты при ревматизме, туберкулезе, бруцеллезе и других болезнях. Реакциям ГНТ подобны так называемые реагиновые реакции, т. е. реакции, в которых участвуют аллергические антитела, или реагины (IgE), фиксированные на клетках. Они отличаются поверхностной альтерацией кле- ток и тканей, что объясняют отсутствием участия комплемента в реакции и преобладанием сосудисто-экссудативных изменений, связанных с массивной дегрануляцией лаброцитов и выбросом гистамина. Примером реагиновой ре- акции могут служить изменения при атопической бронхиальной астме (см. «Бронхиальная астма»). 2. Реакция гиперчувствительности замедленного типа (ГЗТ). В этой реакции участвуют два вида клеток — сенсибилизиро- ванные лимфоциты и макрофаги. Лимфоцитарная и макрофагаль- ная инфильтрация в очаге иммунного конфликта является выражением хро- нического иммунного воспаления; лежащего в основе ГЗТ (А. И. Струков). Разрушение клетки-мишени, т. е. иммунологически обуслов- ленный клеточный цитолиз, связано с активацией лизосомных ферментов лимфоцитов-киллеров (см. схему IX). Макрофаги вступают в специфическую реакцию с антигеном при помощи медиаторов клеточного иммунитета — лимфокинов и цитофильных антител, ад- сорбированных на поверхности этих клеток. При этом между лимфоцитами и макрофагами появляются контакты в виде ц и т о- плазматических мостиков, которые, по-видимому, служат для обме- на информацией между клетками об антигене. Доказательством участия Т-лимфоцитов в ГЗТ является тот факт, что у тимэктомированных в период новорожденности животных ГЗТ не разви- вается и трансплантат не отторгается. С помощью сенсибилизированных лим- фоцитов возможна передача ГЗТ. Воспаление в виде лимфогистиоцитарной и макрофагальной инфильтрации ткани в сочетании с сосудисто-плазморрагическими и паренхиматозно-дистро- фическими процессами может считаться иммунным, т. е. отражающим ГЗТ, лишь при наличии доказательств связи клеток инфильтрата с сенсибили- зированными лимфоцитами. Эти доказательства могут быть найдены при ги- стохимическом и электронно-микроскопическом исследовании (повышение ак- тивности кислой фосфатазы и падение активности дегидрогеназ в лимфоци- тах, увеличение объема их ядер и ядрышек, увеличение числа полисом, гипертрофия комплекса Гольджи). К клинико-морфологическим проявлениям ГЗТ огно- 152 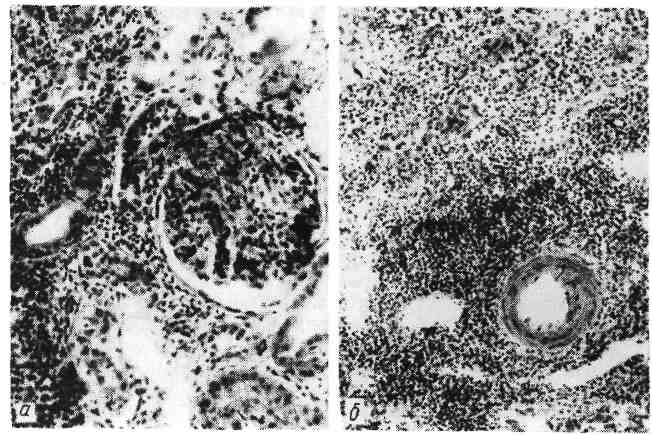 Рис. 96. Реакция отторжения аллотрансплантата почки от живого донора. а — гнездная перивасхулярная и перигломерулярная лимфоцитарная инфильтрация через 14 сут после операции; 6 — диффузная лимфоцитарная инфильтрация через 23 сут после операции. с я т: реакцию туберкулинового типа в коже в ответ на введение антигена, кон- тактный дерматит (контактную аллергию), аутоиммунные болезни, иммуни- тет при многих вирусных и некоторых бактериальных (туберкулез, бруцеллез, туляремия) инфекциях. Морфологическим проявлением ГЗТ служит гранулематоз (см. с. 132), который, однако, может быть выражением иммунопатологических про- цессов различного содержания. О причастности гранулемы к ГЗТ можно гово- рить в тех случаях, когда она предназначена для резорбции продуктов иммун- ной реакции и распада в очагах иммунного повреждения. Примером такой гранулемы может служить характерная для ревматизма макрофагальная гранулема Ашоффа-Талалаева. К ГЗТ могут быть отнесены и гранулемы, ха- рактерные для специфического воспаления (при туберкулезе, сифилисе, лепре), хотя они и являются гранулемами не столько иммунного фагоцитоза (незавершенный фагоцитоз возбудителя гигантскими клетками), сколько гра- нулемами отграничения. Для определения ГЗТ в клинике и эксперименте разработан ряд критериев и тестов. In vivo ГЗТ определяют при помощи внутрикожной пробы с антигеном, путем пассивного переноса ГЗТ от одного животного другому клетками лимфоидных органов, а также с помощью реакции ис- чезновения макрофагов из брюшной полости при подкожном введении антигена сенсибилизиро- ванным животным. Для определения ГЗТ in vitro используют: реакцию бласттрансформации лимфоцитов под действием антигена или неспецифического антигенного раздражителя, феномен цитопатического действия лимфоцитов на нормальные фибробласты в культуре ткани в присутствии антигена, реакцию угнетения макрофагов под действием антигена и реакцию адсорбции на лимфоцитах аутоэритроцитов, нагруженных антигеном. Эти тесты специфичны в отношении используемого в реакции антигена. Реакции ГНТ и ГЗТ нередко сочетаются или сменяют друг друга, отражая динамику иммунопатологического процесса. 3. Проявления трансплантационного иммунитета пред- ставлены реакцией организма реципиента на генетически чужеродный транс- плантат донора, т. е. реакцией отторжения трансплантата. Анти- 153 гены трансплантата индуцируют выработку специфических антител, которые циркулируют в крови, и продукцию сенсибилизированных лимфоцитов, осу- ществляющих клеточную инвазию трансплантата. Основную роль в реакции отторжения играют сенсибилизированные лимфоциты, поэтому проявле- ния трансплантационного иммунитета подобны ГЗТ. Морфологические проявления реакции отторжения сводятся к нарастаю- щей инфильтрации трансплантата в основном лимфоцитами, а также гистио- цитами в результате инвазии этих клеток и размножения их на месте (рис. 96). Клеточная инфильтрация сопровождается расстройством кровообращения и отеком трансплантата. В финале среди клеток инфильтрата появляется много нейтрофилов и макрофагов. Считают, что иммунные лимфоциты, раз- рушая клетки трансплантата, способны насыщаться его антигенами, поэтому гуморальные антитела, направленные против трансплантационных антигенов, не только связываются с клетками трансплантата, но и лизируют лимфоциты. Высвобождающиеся из активированных лимфоцитов ферменты разрушают клетки трансплантата, что ведет к высвобождению новых транспланта- ционных антигенов. Так осуществляется все нарастающая ферментатив- ная деструкция трансплантата. Реакция отторжения может быть подавлена с помощью ряда иммуно- депрессивных средств. Это позволяет при пересадке органов и тканей пользоваться не только изотрансплантатом (реципиент и донор — близнецы), но и аллотрансплантатом (реципиент и донор чужеродны) как от живого че- ловека, так и от трупа. Аутоиммунные болезни Аутоиммунные болезни — группа заболеваний, основным механизмом раз- вития которых является реакция аутоантител и сенсибилизированных лимфоци- тов против нормальных антигенов собственных тканей. Аутоиммунизация тесно связана с понятием иммунологической толерантности (от лат. tolerare — переносить, терпеть). Оно характеризуется состоянием ареактивности («терпи- мости») лимфоидной ткани по отношению к тем веществам антигенной природы, которые в обычных условиях вызывают развитие иммунного ответа. В период созревания лимфоидной ткани возникает иммунологическая толерантность к антигенам всех органов и тканей, кроме тканей глаза, щитовидной железы, семенников, надпочечников, головного мозга и нервов. Счи- тается, что антигены этих органов и тканей отграничены от лимфоидной ткани специальными физиологическими барьерами, что и объясняет отсутствие к ним толерантности иммунокомпе- тентной системы. В основе развития аутоиммунных заболеваний лежит агрессия аутоанти- тел, циркулирующих иммунных комплексов, содержащих аутоантигены, и эф- фекторных иммунных клеток (лимфоцитов-киллеров) в отношении антигенов собственных тканей организма. Поэтому аутоиммунные болезни называют также аутоагрессивными. Среди этиологических факторов ведущее значение придается хронической вирусной инфекции и генетическим наруше- ниям, о чем свидетельствует повышенная частота обнаружения опреде- ленных антигенов HLA при аутоиммунных заболеваниях. В основе патогенеза аутоиммунизации могут лежать три разных механизма: 1) нарушение физиологической изоляции органов и тканей, по отношению к которым иммунологическая толерантность отсутствует; 2) пер- вичные нарушения в иммунокомпетентной системе, ведущие к потере способ- ности различать «свои» и «чужие» антигены; 3) появление в организме новых, чужеродных антигенов. По механизму развития аутоиммунизации различаются три группы ау- 154 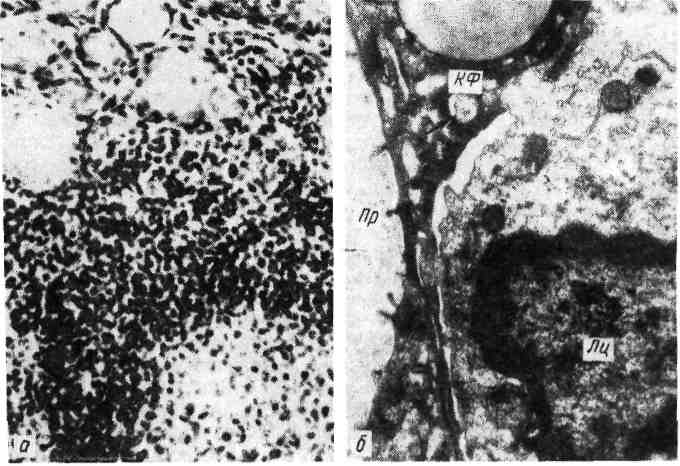 Рис. 97. Струма Хашимото (истинная аутоиммунная болезнь). а — микроскопическая картина: инфильтрация лимфоцитами ткани щитовидной железы, разрушение паренхиматозных элементов; б — электронограмма: миграция лимфоцита (Лц) междy клетками фоллику- ла (КФ); множественные контакты и переплетения цитоплазматических отростков лимфоцита и фол- ликулярных клеток (показано стрелкой); Пp— просвет фолликула, х 10000 (по Ирвину и Муру). тоиммунных заболеваний. В первую группу их входят: струма (болезнь) Хашимото (рис. 97), энцефаломиелит, полиневрит, рассеянный склероз, «идиопатическая» аддисонова болезнь, асперматогения, симпатическая оф- тальмия. Это— органоспецифические аутоиммунные болезни, воз- никновение которых провоцирует инфекция, особенно вирусная, хроническое воспаление и другие факторы. Аутоиммунизация развивается в связи с по- вреждением физиологических барьеров иммунологически обособленных ор- ганов, что позволяет иммунной системе реагировать на их неизмененные ан- тигены выработкой аутоантител и сенсибилизированных лимфоцитов. При этом в органах развиваются морфологические изменения, характерные преиму- щественно для ГЗТ — ткань органов инфильтрируется лимфоцитами, паренхи- матозные элементы погибают (см. рис. 97), в финале развивается склероз. Ко второй группе аутоиммунных заболеваний относят: ревматизм, системную красную волчанку, ревматоидный артрит, системную склеродер- мию, дерматомиозит (группа ревматических болезней, вторичную гемолити- ческую пурпуру (болезнь Мошковича). Ведущими при этих органонеспе- цифических аутоиммунных заболеваниях являются нарушения контроля иммунологического гомеостаза лимфоидной системой, которые могут возни- кать в связи с генетическими факторами, вирусной и бактериальной инфекций, действием радиации. Аутоиммунизация развивается по отношению к антигенам многих органов и тканей, не обладающих органной специфичностью и не спо- собных вызывать продукцию антител при парентеральном введении. В орга- нах и тканях при этих заболеваниях развиваются морфологические изменения, характерные для реакций гиперчувствительности как замедленного, так и осо- бенно немедленного типов. Существуют аутоиммунные болезни, близкие заболеваниям первой или 155 второй группы — аутоиммунные заболевания промежуточно- го типа. Это миастения гравис, синдромы Шегрена и Гудпасчера и др. В третью группу аутоиммунных заболеваний включают: опреде- ленные формы гломерулонефрита, гепатита, хронического гастрита и энтери- та, цирроз печени, ожоговую болезнь, аллергические анемии, агранулоцитоз, лекарственную аллергию. Появление аутоантигенов при этих заболеваниях связывают с изменением антигенных свойств тканей и органов — денатура- цией тканевых белков при ожоге, облучении, травме, хроническом воспале- нии, вирусной инфекции. Образование аутоантигена возможно при воздей- ствии бактериального антигена, особенно перекрестно реагирующего, как это наблюдается, например, при гломерулонефрите, ревматизме. В образовании аутоантигена большое значение придается гаптенному механизму, причем в роли гапгена могут выступать как продукты обмена тела, так и микроорга- низмы, токсины и лекарственные средства. Аутоиммунизация в этих условиях определяет не возникновение заболевания, а прогрессирование характерных для него локальных (органных) изменений, которые отражают морфологию реакций гиперчувствительности замедленного и немедленного типов. Как видно из изложенного, к аутоиммунным болезням следует относить лишь заболевания первой и второй групп. Аутоиммунизация при заболева- ниях третьей группы не является основным их содержанием. Возникая вторич- но в связи с основным процессом, аутоиммунизация в таких случаях опреде- ляет прогрессирование болезней и их исход. Такие заболевания принято называть в последнее время не аутоиммунными, а болезнями с аутоим- мунными нарушениями. Иммунодефицитные синдромы Иммунодефицитные синдромы являются крайним проявлением недо- статочности иммунной системы. Они могут быть первичными, обусловленными недоразвитием (гипоплазия, аплазия) иммунной системы — наследственные и врожденные иммунодефицитные син- дромы, или вторичными, возникающими в связи с болезнью или про- водимым лечением,—приобретенные иммунодефицитные синдромы. Первичные иммунодефицитные синдромы Первичные иммунодефицитные синдромы могут быть выражением недо- статочности: 1) клеточного и гуморального иммунитета; 2) клеточного имму- нитета; 3) гуморального иммунитета. Синдромы недостаточности клеточного и гуморально- го иммунитета называют комбинированными. Они встречаются у детей и новорожденных, наследуются по аутосомно-доминантному типу (агаммаглобулинемия швейцарского типа, или синдром Гланцманна и Рини- кера; атаксия-телеангиэктазия Луи-Бар). При этих синдромах находят гипо- плазию как тимуса, так и периферической лимфоидной ткани (табл. 4), что и определяет дефект клеточного и гуморального иммунитета. В связи с несо- стоятельностью иммунитета у таких детей часты инфекционные заболевания, которые имеют рецидивирующее течение и дают тяжелые осложнения (пнев- мония, менингит, сепсис), отмечается задержка физического развития. При комбинированных иммунодефицитных синдромах часто возникают пороки развития и злокачественные мезенхимальные опухоли (атаксия-телеангиэкта- зия Луи-Бар). Синдромы недостаточности клеточного иммунитета в одних случаях наследуются обычно, по аутосомно-доминантному типу (им- 156 Таблица 4 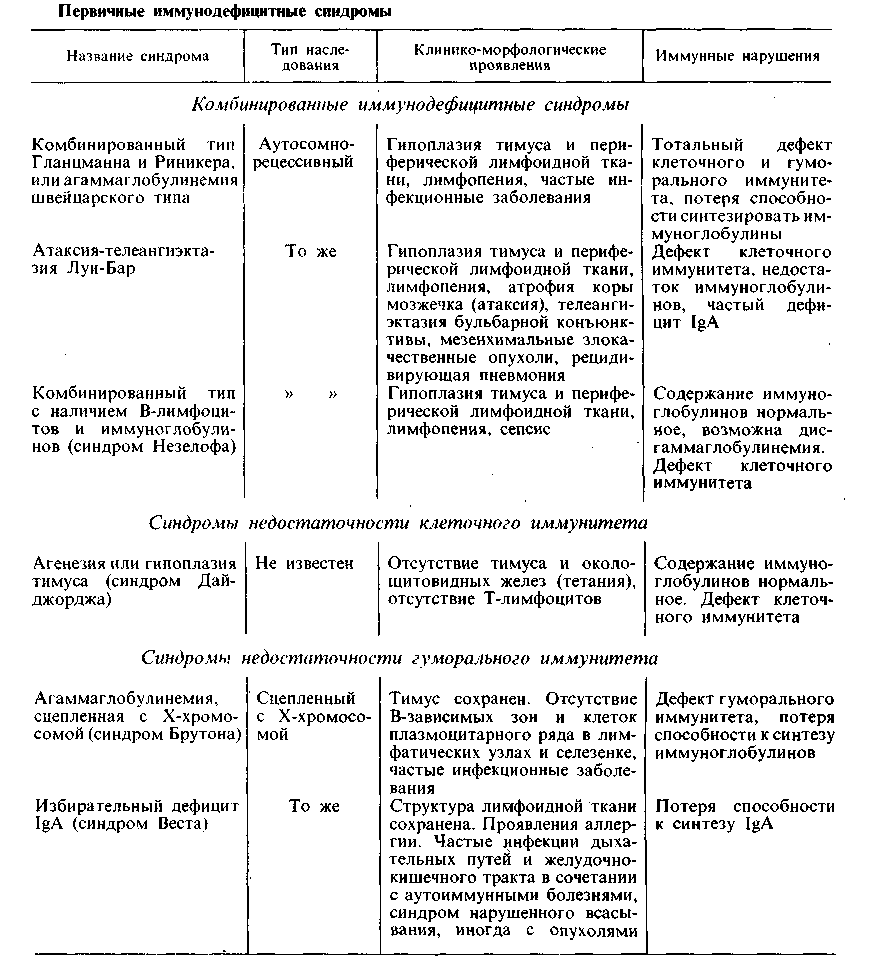 мунодефицит с ахондроплазией, или синдром Мак-Кьюсика), в других являются врожденными (агенезия или гипоплазия тимуса, или синдром Дай- джорджа). Помимо агенезии или гипоплазии тимуса и Т-зависимых зон пери- ферической лимфоидной ткани, что определяет дефицит клеточного иммуни- тета, для этих синдромов характерны множественные пороки развития (см. табл. 4). Дети погибают от пороков развития либо от осложнений инфек- ционных заболеваний. Синдромы недостаточности гуморального иммунитета имеют наследственную природу, причем установлена сцепленность их с X- 157 хромосомой (см. табл. 4). Болеют дети первых пяти лет жизни. Для одних синдромов (агаммаглобулинемия, сцепленная с Х-хромосомой, или синдром Брутона) характерна потеря способности к синтезу всех иммуноглобулинов, что морфологически подтверждается отсутствием В-зависимых зон и клеток плазмоцитарного ряда в периферической лимфоидной ткани, прежде всего в лимфатических узлах и селезенке. Другим синдромам свойствен дефицит одного из иммуноглобулинов (например, избирательный дефицит IgA, или синдром Веста), тогда структура лимфоидной ткани остается сохранной. Од- нако при всех синдромах недостаточности гуморального иммунитета разви- ваются тяжелые бактериальные инфекции с преобладанием гнойно-деструк- тивных процессов в бронхах и легких, желудочно-кишечном тракте, коже, ЦНС, нередко заканчивающихся сепсисом. Помимо иммунодефицитных, известны синдромы недостаточно- сти системы моноцитарных фагоцитов, среди которых наиболее изучена так называемая хроническая гранулематозная болезнь. Вторичные иммунодефицитные синдромы Вторичные (приобретенные) иммунодефицитные синдромы в отличие от первичных возникают в связи с болезнью или определенным видом лечения; встречаются они, как правило, у взрослых. Среди заболеваний, ведущих к развитию вторичной недостаточности иммунной системы, наиболее часты лейкозы, злокачественные лимфомы (лим- фогранулематоз, лимфосаркома, ретикулосаркома), тимома, вирусные инфек- ции, саркоидоз. При этих заболеваниях возникает недостаточность гуморально- го и клеточного иммунитета в результате дефекта популяции как В-, так и Т- лимфоцитов, а возможно, и их предшественников. Среди видов лечения, ведущих к вторичной недостаточности иммун- ной системы, наибольшее значение имеют лучевая терапия, применение кор- тикостероидов и иммунодепрессантов, антилимфоцитарной сыворотки, тимэк- томия, дренирование грудного протока и ряд других. Недостаточность иммунной системы, развивающаяся в связи с лечением той или иной болезни, рассматривается как патология терапии. При вторичных, как и первичных, иммунодефицитных синдромах часто на- блюдаются гнойные инфекции, обострение туберкулезного процесса, сепсис. |
