ЛЕКЦИИ 50 лекций по хирургии под редакцией академика B.C. Савельева. ЛЕКЦИИ 50 лекций по хирургии под редакцией академика B.C. Савель. Media medica 2003 п од редакцией академика B. C. Савельева
 Скачать 9.44 Mb. Скачать 9.44 Mb.
|
|
Доброкачественные опухоли и кисты пищевода Доброкачественные новообразования пищевода встречаются редко. Они составляют 0,5—5 % от всех опухолей пищевода. По характеру роста доброкачественные новообразования пищевода делят на внутрипросветные (полипообразные) и внутри-стеночные, по происхождению и гистологическому строению - на эпителиальные: аденоматозные полипы, папилломы; кисты и неэпителиальные (мезенхимальные): лейомиомы, рабдомиомы, липомы, фибромы, гемангиомы, хондромы и др. Доброкачественные опухоли пищевода примерно в половине случаев протекают бессимптомно. При внутрипросветных опухолях ведущим симптомом является дисфагия, обычно незначительно или умеренно выраженная. Другими симптомами могут быть тупые боли и ощущение инородного тела за грудиной, тошнота, слюнотечение. Иногда при регургита-ции опухоли на ножке, расположенной в шейном отделе пищевода, может возникнуть асфиксия. Наиболее часто встречающейся доброкачественной опухолью пищевода (60-70%) является лейоми-ома. Длительное время лейомиомы протекают бессимптомно. При больших размерах опухоли или при циркулярном росте возникают явления дисфагии, реже встречается "компрессионный синдром", связанный со сдавлением органов средостения. Кисты занимают второе место по частоте среди всех доброкачественных новообразований пищевода. Большинство кист являются врожденными. Наиболее часто они локализуются в нижней трети пищевода. Клиническая картина кист соответствует клинической картине других доброкачественных новообразований пищевода. Нередко наблюдается изъязвление и кровотечение в просвет кисты, при инфицировании кисты могут нагнаиваться. Описана злокачественная трансформация кист, что наблюдается и при других доброкачественных новообразованиях пищевода у 10% больных. Прочие виды доброкачественных опухолей встречаются исключительно редко. Объективное исследование, как правило, не выявляет специфических симптомов доброкачественных новообразований пищевода. Основными способами инструментальной диагностики являются рентгенография пищевода, эзофагоскопия, компьютерная или магнитно-резонансная томография. При рентгенологическом исследовании внутрипросветные опухоли определяются в виде локального утолщения одной из складок или округлого дефекта наполнения на широком основании или на ножке. При внутристеночных опухолях складки слизистой сохранены, опухоль дает краевой дефект наполнения с ровными контурами, перистальтика и эластичность пищевода в зоне проекции новообразования сохранены. Всем больным с подозрением на опухоль пищевода необходима эзофагоскопия. При внутрипросветных опухолях выполняют прицельную биопсию с последующим морфологическим исследованием материала. Для внутристеночных опухолей характерно наличие образования, выступающего в просвет пищевода, слизистая оболочка над ним, как правило, не изменена. При изъязвлении опухоли можно обнаружить дефект слизистой оболочки. При наличии неизмененной слизистой оболочки над новообразованием биопсию выполнять не следует. Лечение доброкачественных опухолей пищевода только оперативное в связи с возможностью злокачественного перерождения, кровотечения и других осложнений. Внутрипросветные опухоли, располагающиеся на ножке, могут быть удалены с помощью эндоскопа электроэксцизией. Полипы на широком основании иссекают через стенку пищевода с последующим ее послойным ушиванием. При интрамуральных опухолях и кистах пищевода показана органосохраняющая операция, заключающаяся в вылущивании (энуклеации) опухоли без вскрытия слизистой оболочки с рассечением только мышц. При повреждении слизистой оболочки образовавшийся дефект ушивают, затем накладывают швы на мышечную оболочку пищевода. Видеоэндохирургический доступ к доброкачественным опухолям пищевода осуществляют в зависимости от локализации патологического процесса. При расположении опухоли в абдоминальном отделе пищевода операцию производят из лапароскопического доступа, если новообразование локализуется в грудном отделе пищевода, оперативное вмешательство выполняют торакоскопически. Независимо от доступа пищевод обнажают только >над доброкачественным новообразованием, рассекают мышечную оболочку над опухолью, когтис- 155 торакальная хирургия   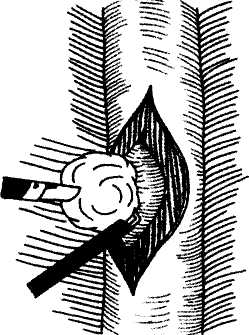 Рис. 11. Видеоэндоскопическая энуклеация лейомиомы. тым зажимом опухоль фиксируют и частично тупым путем, частично при помощи электрохирургических инструментов выделяют из мышечного слоя и удаляют (рис.11). Видеоэндоскопическая техника в связи с увеличением объекта операции в 8-10 раз способствует хорошей визуализации тканей, что позволяет удалить новообразование без повреждения слизистой оболочки. Мышечную оболочку ушивают отдельными швами на атравма-тической игле. Плевральную или брюшную полость дренируют через один из разрезов. Грыжи пищеводного отдела диафрагмы Грыжа пищеводного отверстия диафрагмы -смещение какого-либо органа брюшной полости, покрытого брюшиной, через пищеводное отверстие диафрагмы в заднее средостение. Выделяют аксиальные (скользящие) и параэзофагеальные грыжи. Аксиальные грыжи пищеводного отверстия диафрагмы могут быть пищеводными, карди-альными, кардиофундальными, субтотальными и тотальными желудочными. Параэзофагеальные грыжи подразделяют на фундальные (встречаются наиболее часто), антральные, кишечные, кишеч-но-желудочные и сальниковые. Причиной образования приобретенных грыж пищеводного отверстия диафрагмы являются инволюционные процессы в связочном аппарате пищеводного отверстия диафрагмы, в результате чего последнее расширяется и образуются своего рода грыжевые ворота. Эти изменения наиболее часто встречаются у стариков, беременных, больных, страдающих ожирением. Непосредственной причиной, вызывающей возникновение грыж пищеводного отверстия диафрагмы, является повышение внутрибрюшного давления. Грыжи пищеводного отверстия диафрагмы часто сочетаются с язвенной болезнью желудка и двенадцатиперстной кишки, хроническим холециститом, дивертикулезом толстой кишки, дивертикулами пищевода, ахалазией кардии и кардиоспазмом. Клиническая картина грыж пищеводного отверстия диафрагмы очень разнообразна. В 5-40% случаев клинические проявления отсутствуют, в основном при грыжах небольших размеров. Симптомами грыж пищеводного отверстия диафрагмы могут быть изжога, боль, отрыжка, регургита-ция, дисфагия, икота. Изжога наблюдается обычно после еды, при перемене положения тела, чаще возникает в ночное время. Боли за грудиной появляются и усиливаются при горизонтальном положении. При наклоне туловища вперед боли часто сопровождаются регургитацией желудочного содержимого ("симптом шнурка"). У больных с грыжами пищеводного отверстия диафрагмы нередко возникает рефлекторная стенокардия. Боли могут локализовываться также в подложечной и межлопаточной областях. Тяжелый рефлюкс-эзофагит часто сопровождается дисфагией. Нередко при грыжах пищеводного отверстия диафрагмы возникает кровотечение, обычно незначи^ тельное. Основным методом диагностики грыж пищеводного отверстия диафрагмы является рентгенологическое исследование. Рентгенологические симптомы определяются типом грыжи. При аксиальной грыже в грудную полость смещен весь желудочно-пищевод-ный переход, и часть желудка пролабирует в заднее средостение. Кардия находится над диафрагмой. В случае параэзофагеальной грыжи пищеводно-желу-дочный переход располагается в брюшной полости, а часть желудка выходит через пищеводное отверстие диафрагмы в грудную полость рядом с пищеводом. Большие грыжи распознаются сравнительно легко, для выявления небольших грыж необходимо исследование как в вертикальном, так и в горизонтальном положении больного, а также в положении Тренде-ленбурга. Рентгенологическое исследование играет важную роль в распознавании осложнений хиаталь-ной грыжи и прежде всего рефлюкс-эзофагита. Эндоскопическое исследование является весьма важным, позволяет выявить симптомы недостаточности кардии, оценить тяжесть эзофагита, выявить осложнения и сопутствующие заболевания. Ценным функциональным методом диагностики скользящих грыж пищеводного отверстия диафрагмы является эзофагоманометрия, позволяющая определить зону повышенного давления в области пищеводно-же-лудочного перехода, смещенного выше уровня диафрагмы. Лечение аксиальных грыж пищеводного отверстия диафрагмы необходимо начинать с консервативных мероприятий. При сформировавшейся пептической стриктуре на фоне проводимых мероприятий выполняют буксирование пищевода, чаще всего в качестве предоперационной подготовки. Оперативное вмешательство необходимо проводить при осложненных формах и безуспешности предшествующих медикаментозных мероприятий. Наиболее целесообразной операцией является фундопликация по Ниссену в различных модификациях. При протяженных стриктурах выполняют резекцию пищевода. Параэзофагеальные грыжи подлежат оперативному вмешательству в связи с опасностью тяжелых осложнений. Производят низведение грыжевого содержимого в брюшную полость, крурорафию. Операцию завершают фундопликацией. Основной используемый доступ при видеоэндо-хирургическом лечении грыж пищеводного отверстия диафрагмы - лапароскопический. Левую долю печени отводят ретрактором. Разделяют пече-ночно-желудочную порцию сальника, рассекают брюшину, покрывающую абдоминальный отдел пищевода, низводят грыжевое содержимое в брюшную полость, производят выделение правой 156 торакальная хирургия      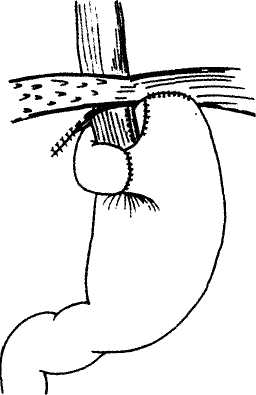 Рис. 12. Видеоэндоскопическая фундопликация. Рис. 12. Видеоэндоскопическая фундопликация.Рис. 13. Торакоскопическая экстирпация пищевода. 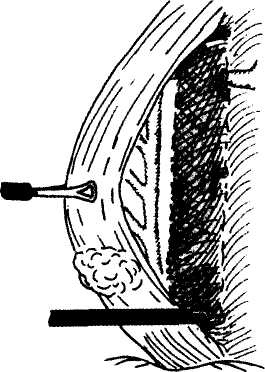   стенки пищевода. Затем, при отведении пищевода вправо, выделяют левую стенку пищевода. Ретро-эзофагеальную клетчатку тупо разделяют при трак-ции пищевода кпереди и влево. После создания окна ножки диафрагмы сводят отдельными узловыми швами из нерассасывающего материала на атрав-матической игле с предварительно введенным в желудок толстым зондом. Затем выполняют мобилизацию дна желудка и верхней части большой кривизны для фундопликации. Короткие желудочные артерии в этой области клипируют и пересекают. После мобилизации дна желудка производят непосредственно фундопликацию. Стенку желудка захватывают введенным позади пищевода зажимом и протягивают слева направо вперед, образуя циркулярную манжетку. Задний лоскут подшивают 2-3 узловыми швами к дну желудка, выведенному спереди от пищевода с обязательным захватыванием в шов стенки пищевода для предотвращения соскальзывания созданной манжетки (рис. 12). стенки пищевода. Затем, при отведении пищевода вправо, выделяют левую стенку пищевода. Ретро-эзофагеальную клетчатку тупо разделяют при трак-ции пищевода кпереди и влево. После создания окна ножки диафрагмы сводят отдельными узловыми швами из нерассасывающего материала на атрав-матической игле с предварительно введенным в желудок толстым зондом. Затем выполняют мобилизацию дна желудка и верхней части большой кривизны для фундопликации. Короткие желудочные артерии в этой области клипируют и пересекают. После мобилизации дна желудка производят непосредственно фундопликацию. Стенку желудка захватывают введенным позади пищевода зажимом и протягивают слева направо вперед, образуя циркулярную манжетку. Задний лоскут подшивают 2-3 узловыми швами к дну желудка, выведенному спереди от пищевода с обязательным захватыванием в шов стенки пищевода для предотвращения соскальзывания созданной манжетки (рис. 12).Видеоэндохирургические экстирпации и резекции пищевода Показанием к выполнению торакоскопичес-кой экстирпации пищевода являются рак, руб-цовые стриктуры пищевода, ахалазия кардии и кардиоспазм IV степени. Операцию производят из правостороннего тора-коскопического доступа в положении больного на левом боку под эндотрахеальным наркозом с раздельной интубацией бронхов. После введения троакаров рассекают легочно-диафрагмальную связку в режиме электрокоагуляции, легкое высвобождают из спаек и отводят кпереди. Сначала рассекают медиастинальную плевру над нижней третью пищевода вверх до дуги непарной вены, а затем выше. Стенку пищевода захватывают зажимом Бэбкокка и, выполняя тракцию пищевода вправо и влево, мобилизуют его на всем протяжении, освобождая от фасциальных отрогов спереди и сзади (рис.13)- Выделение пищевода при раке обязательно производится с удалением средо-стенных лимфатических узлов в объеме F2. После мобилизации выше и ниже дуги непарной вены пищевод захватывают ниже дуги и, осуществляя тракцию в краниокаудальном направлении, рассекают фасциальные отроги, соединяющие дугу непарной вены и пищевод. Выделение пищевода в месте пересечения его дугой непарной вены является наиболее ответственным этапом операции. В ряде случаев (при расположении опухоли в средней трети грудного отдела пищевода, наличии хронического склерозирующего медиастинита вследствие пери-эзофагита при Рубцовых стриктурах) дугу непарной вены необходимо пересекать после предварительной интракорпоральной перевязки и наложения двух рядов титановых скрепок, для этой цели может быть использован также линейный сшивающий аппарат. При торакоскопическом выделении пищевода обычно не отмечается массивных кровотечений. Затем больного укладывают на спину, выполняют верхнесрединную лапаротомию. При раке пищевода производят лимфаденэктомию, идентичную лимфаденэктомии, выполняемой при раке карди-ального отдела желудка. Выкраивают трансплантат из большой кривизны желудка и отсекают пищевод от желудка (при раке пищевода производится также удаление кардиального отдела и дна желудка). Пищевод удаляют через разрез на шее по переднему краю левой грудиноключично-сосцевидной мышцы. Выкроенный трансплантат из большой кривизны желудка помещают в заднее средостение и выводят на шею, где соединяют с шейным отделом пищевода анастомозом конец в конец двухрядным швом. Плевральную полость дренируют в VII -VIII межреберье, обязательно производят дренирование брюшной полости и шейной раны. Операционные раны ушивают. Торакоскопическая резекция пищевода Обычно резекцию пищевода производят несколько ниже дуги непарной вены. Показаниями к выполнению данной операции являются рак желудка с переходом на пищевод и ограниченные рубцовые стриктуры нижней трети пищевода. Оперативное вмешательство производят из правостороннего торакоскопического доступа. Рассекают легочную связку, легкое отводят кпереди, визуализируют пищевод и рассекают медиастинальную плевру от диафрагмы до дуги непарной вены. Стенку пищевода захватывают зажимом и, осуществляя тракции в разные стороны, освобождают пищевод со всех сторон в режиме монополярной и биполярной коагуляции. 157 торакальная хирургия   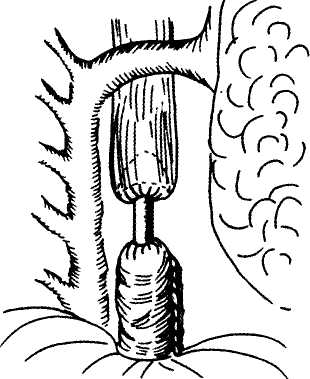 Рис. 14. Торакоскопическая экстирпация пищевода. Электрохирургическими ножницами пересекают пищевод. В оставшуюся часть пищевода вводят головку циркулярного сшивающего аппарата диаметром 21 или 25 мм, накладывают и затягивают кисетный шов. Бригада хирургов, оперирующая в брюшной полости, выделяет абдоминальный отдел пищевода и подготавливает желудок или тонкую кишку (в зависимости от объема вмешательства) к наложению анастомоза. Рабочую часть степлера вводят в просвет желудка или тонкой кишки через отдельный разрез и соединяют с головкой аппарата в заднем средостении под торакоскопическим контролем (рис.14). Наложение анастомоза является наиболее ответственным этапом операции. Отдельный разрез желудка или кишки ушивают. Ниже анастомоза желудок (тонкую кишку) фиксируют отдельными узловыми швами к диафрагме. Плевральную полость дренируют. Послеоперационное ведение больных При видеоэндохирургическом лечении доброкачественных заболеваний пищевода пациенты могут подниматься с постели вечером в день операции или на следующий день. После резекций и экстирпаций пищевода больные нуждаются в пребывании в палате интенсивной терапии. В послеоперационном периоде сохраняется введенный во время операции назогастральный зонд, обеспечивающий декомпрессию и позволяющий проводить энтеральное питание. Кормление пациентов per os возможно на 2-3-х сутки, а при наложении швов на стенку пищевода -с 5-7-х суток после операции (предварительно выполняют контрольную рентгенографию пищевода с контрастом). До начала питания пациенты нуждаются в комплексной терапии, направленной на коррекцию водно-электролитных, белковых нарушений. Антибактериальная терапия целесообразна после экстирпаций и резекций пищевода, а также после операций, сопровождающихся вскрытием его просвета. В послеоперационном периоде применение наркотических анальгетиков требуется обычно только после резекций и экстирпаций пищевода. Конверсия в эндохирургии пищевода При выполнении эндохирургических операций иногда хирургам приходится отказываться от эн-дохирургического метода и переходить к открытому, традиционному. Этот переход получил название «конверсия». Показаниями к конверсии являются:
Успех видеоэндохирургического лечения больных с заболеваниями пищевода зависит от четкого соблюдения показаний и противопоказаний и своевременного перехода к открытым операциям. Перспективы развития видеоэндохирургии пищевода Внедрение видеоэндоскопической техники в хирургию пищевода открывает новые горизонты в лечении больных этой сложной и разнообразной патологией. И если при лечении пациентов с доброкачественными заболеваниями пищевода видео-эндохирургия во многих случаях является операцией выбора, то при резекциях и экстирпациях пищевода остается еще много сложных и порой трудноразрешимых проблем. Решению этих задач будет способствовать создание более совершенных инструментов и сшивающих аппаратов. При выполнении видеоэндохирургических операций хирург лишен возможности пальпировать ткани. С этой задачей успешно могли бы справиться миниатюрные гибкие ультразвуковые датчики, которые позволят дифференцировать нормальные и патологические ткани. Внедрение сшивающих аппаратов с изменяющейся геометрией рабочей части значительно облегчит выполнение резекций пищевода и йаложение анастомозов в труднодоступных зонах. Разработка и внедрение роботов и компьютеров сделают видеоэндохирургические операции на пищеводе менее травматичными и опасными и более доступными для хирургов, занимающихся проблемой лечения больных с заболеваниями пищевода. Литература
7. Cuschieri A., Shimi S., Banting S. Endoscopic oesophagectomy through a right thoracoscopic approach. J R Coll Edinb. 1992.- Vol. 37,- P. 7-11. 158 торакальная хирургия
ence with a new approach for the treatment of achalasia. Ann Surg. 1992- Vol. 216.- P. 291-6. 10. Shimi S., Nathanson L. K., Cuschieri A. Laparoscopic cardiomyotomy for achalasia. JR Coll Edinb. 1991.-Vol. 36.-P. 152-4.  Радикальное хирургическое лечение рака грудного отдела пищевода Радикальное хирургическое лечение рака грудного отдела пищеводаА. Ф. Черноусое, Д.В.Ручкин  Злокачественные опухоли пищевода составляют 1,5—2% всех новообразований человеческого организма. Рак пищевода (РП) в структуре онкологических заболеваний желудочно-кишечного тракта занимает 7-е место, его доля составляет 5-7%. За последние два десятилетия тенденции к снижению заболеваемости РП не отмечено, в России она составляет в среднем 7 случаев на 100 тыс. населения. В связи с совершенствованием технического обеспечения вмешательств, успехами анестезиологии и реаниматологии тактика лечения РП за последние 10-15 лет существенно изменилась - значительно расширились показания к радикальным и реконструктивным вмешательствам, а многоэтапные операции на пищеводе уступили место одномоментным. Как альтернатива внутриплевраль-ным резекциям пищевода широко применяется (суб)тотальная эзофагопластика. Вмешательства на пищеводе относятся к одному из сложнейших разделов хирургии. Их выполнение требует не только знания сложной анатомии этого органа, но и владения современными принципами и приемами оперирования. Сегодня считаются практически решенными основные технические и тактические аспекты эзофагопластики: выбор трансплантата, пути его проведения, способ формирования пищеводного или глоточного соустья. Современные исследования направлены на оптимизацию и стандартизацию объема радикальных вмешательств при РП. Дальнейшее улучшение результатов хирургического лечения больных РП связывают не только с внедрением новых способов его ранней диагностики, например эндоскопической ультрасонографии, но и с разработкой оперативных методик, повышающих радикальность вмешательств, каковой и является расширенная регионарная лимфаденэктомия (ЛАЭ). История хирургии пищевода Хирургия пищевода весьма сложна и интересна, по количеству накопленного опыта являет собой одну из богатейших страниц истории мировой хирургии. Ее родоначальником по праву считается русский хирург И.И. Насилов, разработавший технику дорсальной медиастинотомии и опубликовавший в 1888 г. свою известную работу "Эзофаготомия и иссечение пищевода внутри груди". В 1895 г. итальянский хирург Biondie доложил об иссечении кардиального отдела желудка вместе с нижним отрезком пищевода с прямым эзофагофундоанас-томозом у собаки. В 1896 г. Levy разработал в эксперименте методику шейно-медиастинального туннелирования - выделения пищевода со стороны шеи и через разрез в диафрагме. Этот метод впервые с благоприятным исходом был применен в СССР К.П. Сапожковым в 1929 г. За рубежом в 1933 г. Turner сообщил о первой успешной экстирпации пищевода из абдоминоцервикаль-ного доступа. Дальнейшее внедрение трансхиаталь-ных вмешательств проведено А.Г. Савиных (1949), который выполнял широкую диафрагмотомию и удалял пищевод вплоть до шеи. В 1900 г. опубликована статья томского хирурга ВДДобромыслова, в которой он предложил разработанные в эксперименте чресплевральный доступ к пищеводу и методику его резекции. В1908 г. Voelcker впервые произвел успешную трансабдоминальную резекцию кардии. В1913 г. Torek впервые в клинических условиях успешно выполнил удаление грудного отдела пищевода при раке. Стоит заметить, что способы эзофагопластики создавались практически одновременно с методиками резекций пищевода и развивались в дальнейшем параллельно с ними. На протяжении XX столетия четко прослеживаются четыре основных направления реконструктивной хирургии пищевода, соответствующие используемому пластическому материалу - коже, тонкой и толстой кишке, желудку. Bircher в 1894 г. создал на передней грудной стенке кожную трубку от шеи до эпигастральной области, дистальный конец которой вшил в желудок. Операция осталась незавершенной , так как пациент погиб от прогрессирования опухоли. Позднее кожная вставка использовалась при недостаточной длине трансплантата. Сегодня от этого вида пластики полностью отказались в связи с частым рубцеванием и малигнизацией кожных фрагментов. Тонкокишечная эзофагопластика была последовательно разработана тремя известными хирургами - Roux (1907), П.А. Герценом (1907) и С.С. Юдиным (1928) - и с тех пор носит их имя. Эта операция, широко распространенная в 40-50-х годах, в настоящее время находит применение лишь в тех случаях, когда для создания нового пищевода невозможно использовать желудок или толстую кишку. Основными недостатками тонкой кишки являются ее низкая устойчивость к гипоксии, сложность сосудистой архитектоники, исходное наличие избыточных петель, трудоемкость формирования трансплантата. Первую попытку осуществить толстокишечную эзо-фагопластику у больной с РП предпринял в 1911 г. Kelling. В 1913 г. успешную пластику пищевода толстой кишкой выполнил Hacker. Разработкой этого 159 торакальная хирургия вида вмешательств занимались Orsoni, Toupet (1950), П.ИАндросов (1957), БАПетров (1957), В.И.Попов (1957). В настоящее время колоэзофагопластика достаточно широко распространена. Мы не рассматриваем ее как альтернативу желудочной пластике, а применяем при непригодности желудка или в качестве загрудинного шунта при нерезектабельном РП. Экспериментальная идея создания антиперистальтической трубки из большой кривизны желудка в виде питательной стомы с основанием в области кар-диофундального отдела принадлежит Depage, Beck и Carrel (1905). В 1911 г. Hirsch предложил использовать желудочную трубку для создания искусственного пищевода. В 1912 г. Jianu и Ю.Я. Гальперн независимо друг от друга предложили формировать антиперистальтическую трубку из большой кривизны желудка с питанием на левой желудочно-сальниковой артерии. Именное название эта операция приобрела после того, как была усовершенствована Gavriliu (1951) и Heimlich (1955). Антиперистальтическая желудочная эзофагопластика исключает возможность удаления кардии и малой кривизны желудка, поэтому ее применение ограничено как несоответствующей принципам онкологического радикализма. В 1920 г. Kirschner предложил создавать пищевод за счет предгрудинного перемещения всего желудка с одномоментным соустьем его дна с шейной частью пищевода. Доработка этой операции произведена Nakaiama (1974). Очевидно, что более перспективной оказалась идея использования расщепленного желудочного лоскута с основанием в антральном отделе, принадлежащая Rutkowski (1923). Тремя десятилетиями позже Lortat-Jacob (1949) поместил эту трубку в заднее средостение и соединил с резецированным пищеводом. Boerema (1951) доказал возможность формирования соустья между желудочным трансплантатом и собственным пищеводом на любом уровне вплоть до глотки. Но тогда эта операция широкого распространения не получила из-за отсутствия сшивающих аппаратов и необходимости накладывать большое количество ручных швов. Значительной вехой в развитии желудочной эзофа-гопластики явилось внедрение трансторакальных резекций пищевода. Последовательно Ohsawa (1933), Garlock (1937) и Sweet (1942) выполнили многочисленные успешные резекции грудного отдела пищевода из левостороннего чресплеврального доступа с одномоментной эзофагогастростомией. В1946 г. Lewis по поводу РП произвел успешную серию резекций комбинированным доступом - из лапаротомии и правосторонней торакотомии. McManus в 1950 г. предложил выполнять эту операцию одномоментно. Совершенствование способов одномоментных резекций пищевода в 50-е годы неразрывно связано с именами представителей российской школы хирургов: ААРусанова, С.С.Юдина, Б.В.Петровского, П.ИАн-дросова, АГ.Савиных, ЕЛ.Березова. В России первую успешную резекцию кардии и нижней трети пищевода с одномоментным наложением внутриплевраль-ного пищеводно-желудочного соустья выполнил Б.В.Петровский в 1946 г. В.И.Казанский первым среди отечественных хирургов в 1945 г. успешно экстирпи-ровал пищевод по Добромыслову-Тореку. Развитие желудочной эзофагопластики в 60-70 годах продолжено трудами многих отечественных и зарубежных хирургов: В.И. Попова и В.И.Филина (1965); Э.Н.Ван-цяна и О.К.Скобелкина (1975); Matsumoto (1965); Kakegawa (1973); Akiyama (1974), доказавших на практике возможность одномоментного пластического замещения пищевода после его (суб)тотальной резекции. Применение в 40-60 годах травматичных вмешательств при РП ознаменовалось высокой летальностью, достигавшей 30-40%, и низкой пятилетней выживаемостью - 6-8%. Объяснимо внимание хирургов к таким малотравматичным вмешательствам, как трансхиатальная эзофагэктомия, дающим неплохие непосредственные результаты. Законченный вариант экстирпации пищевода с одномоментной пластикой желудочной трубкой явился логическим завершением предложенных ранее методик Kirschner-Nakaiama и Rutkowsky-Boerema. Он был технически доработан и внедрен в отечественную клиническую практику В.С.Сильвестровым и АФ. Черноусовым в конце 70-х начале 80-х годов. Наибольшим опытом применения данного вмешательства за рубежом обладали Stelzner (1981) и Oringer (1983). История хирургии пищевода неразрывно связана с историей ЛАЭ, т.е. методики удаления регионарных лимфоузлов. В 1894 г. Halsted сообщил о первых положительных результатах радикальной мастэктомии с удалением подмышечных и надключичных лимфоузлов. Miles в 1908 г. впервые предложил выполнять ЛАЭ в хирургии органов брюшной полости - брюш-но-промежностной экстирпации прямой кишки. Еще в 1916 г. Moynihan утверждал, что точное знание лимфатической системы органов является основой оперативного лечения опухолей и во многом определяет его успех. Некоторых больных с метастазами удавалось излечить путем хирургического удаления пораженных лимфоузлов. О первом таком больном, благополучно перенесшем одномоментную эзофагэкто-мию с эзофагогастроанастомозрм, доложили Adams и Phemister в 1938 г. Пациент прожил более 15 лет. С момента основания Японского общества по изучению болезней пищевода (JSED) в 1965 г. и публикации в 1969 г. "Руководства по клиническому и патологическому изучению рака пищевода" ЛАЭ при эзофа-гэктомии стала применяться в Японии. В других странах эта методика вплоть до середины 80-х годов не была широко распространена, что объяснялось ее технической сложностью и угрозой тяжелых послеоперационных осложнений. Но Nakayama (1962) и Logan (1963) уже тогда отстаивали важность медиас-тинальной и чревной ЛАЭ при РП. Logan впервые сообщил о выполнении резекции "en bloc" при дисталь-ном РП и кардии. Он достиг пятилетней выживаемости 16% при высокой послеоперационной летальности-21%. В конце 70-х годах широкое распространение сначала в Японии, а затем в США и в странах Западной Европы получили различные методики расширенных хирургических вмешательств при РП, включающих ЛАЭ. Тогда же, по данным JSED, резектабельность достигла 68%, а летальность снизилась до 6,8% при возросшей до 26% пятилетней выживаемости. Только с начала 80-х годов в европейских клиниках стали улучшаться результаты хирургического лечения РП, что выражалось в снижении послеоперационной летальности с 29 до 13% и повышении пятилетней выживаемости с 4% до 20%. Положительную роль в этом процессе сыграла дальнейшая разработка Skinner (1983Д991) приемов трансторакальной резекции пищевода "en bloc". Эта методика предполагала иссе- 160 торакальная хирургия чение клетчатки средостения единым блоком с пораженным пищеводом. Таким образом, ликвидировались не только пораженные лимфоузлы, но и пери-эзофагеальные ткани с микроскопическими опухолевыми эмболами. Технические приемы этой операции легли в основу современной методики медиасти-нальной ЛАЭ. В 1976 г. Kinoshita сообщил о значении лимфоузлов вдоль возвратных нервов и области шейно-грудного перехода как зоны интенсивного метастазирования. Основополагающей работой по методике ЛАЭ явилась публикация Akiyama (1981) "Принципы хирургического лечения рака пищевода", в которой были описаны приемы двухзональной (торакоабдоминальной) ЛАЭ, выполнявшейся авторами с 1973 г. Был четко определен стандартный объем ЛАЭ в животе и доказано улучшение выживаемости после ее выполнения. В период с 1962 по 1981 г. в Японии рутинной процедурой являлось удаление вместе с пищеводом средних и нижних медиастинальных и абдоминальных лимфоузлов. Пятилетняя выживаемость достигала 20%. В 1982 г., пЪсле изучения данных лимфосцинти-графии пищевода и характера рецидивов, зона ЛАЭ была расширена и на верхнее средостение. Sannohe в 1981 г. сообщил о первых результатах трехзональной (цервикоторакоабдоминальной) ЛАЭ, выполняемой им в течение 5 лет. Эта публикация поменяла взгляд на шейное метастазирование как на отдаленное и неизбежно приводящее к фатальному исходу. С этого момента шейная ЛАЭ стала применяться как стандартная методика. Так, Nashimaki выполняет трехзо-нальную ЛАЭ при РП с 1982 г., Isono и Koide - с 1983п, Akiyama - с 1984 г., Ando - с 1986 г. Среди европейских ученых расширенную ЛАЭ практикуют Lerut (1991); Collard (1995); Fraunberger (1996); Meyer (1996); Altorki и Skinner (1997); Jakab (1997). Более чем 20-летний опыт использования методики ЛАЭ в Японии свидетельствует, что при раннем выявлении опухоли с последующей радикальной операцией пятилетняя выживаемость достигает 70-80%. Тем не менее методика широкой ЛАЭ имеет своих оппонентов, указывающих на ее высокую трудоемкость и травматичность, а также бесперспективность в плане продления жизни пациентов (Orringer, 1993). Дискуссия по этому вопросу не утратила свой актуальности и сейчас. Патогенез рака пищевода . Этиология Мужчины болеют РП чаще женщин в соотношении 5:1. Помимо известных факторов риска РП, таких как наследственность, возраст старше 50 лет, особенности питания (острая, горячая и грубая пища), вредные привычки (курение, алкоголь), хронические заболевания пищевода (ожоговые и пеп-тические рубцовые стриктуры, кардиоспазм, грыжи пищеводного отверстия диафрагмы, дивертикулы) особое внимание уделяют патологическому состоянию, именуемому "пищеводом Барретта". Сегодня под пищеводом Барретта понимают приобретенное состояние, являющееся осложнением рефлюкс-эзофагита и развивающееся в результате замещения разрушенного плоского эпителия нижней части пищевода специализированным цилиндрическим эпителием. Специализированный цилиндрический эпителий представляет собой морфологический субстрат пищевода Барретта и является результатом метаплазии субмукозных стволовых клеток в пищеводе, которые трансформируются в цилиндрические клетки после выраженного повреждения слизистой оболочки. Пищевод Барретта, в отличие от других доброкачественных осложнений рефлюкс-эзофагита, имеет иной прогноз. Трансформация цилиндрического эпителия в рак представляет собой единый неопластический процесс, последовательно проходящий стадии метаплазии, дисплазии и аденокарциномы. По разным данным, частота развития аденокарциномы на фоне пищевода Барретта возрастает в 30-125 раз. Современная классификация Стадирование РП в настоящее время проводится в соответствии с действующими патологоанатоми-ческим и клиническим вариантами TNM-класси-фикации Международного Противоракового Союза (UICC) от 1989 г. Современная техническая оснащенность ведущих клиник позволяет на диагностическом этапе дифференцировать "ранний" и "поздний" РП на основании критерия местной распространенности опухолевого процесса - глубины инвазии - и определять адекватную тактику хирургического лечения. Ранним считают внутрислизистый РП, который во всей группе оперированных нами больных был выявлен только в 1% случаев. Опухоли, выходящие за пределы слизистой оболочки, относят к позднему РП. Так, у 99% наших больных диагностирован поздний рак, причем у 1/3 из них опухоль распространялась за пределы пищевода и прорастала соседние органы и структуры (III—IV стадия). Сегодня назрела необходимость пересмотра действующей TNM-классификации РП. Мы разделяем мнение зарубежных коллег, что глубокие шейные лимфоузлы следует считать регионарными для грудного отдела пищевода также как чревные, входящие сегодня в М-компо-нент. Основанием этому служит одинаковая выживаемость пациентов с метастатическим поражением данных узлов и без такового после радикального вмешательства с трехзональной ЛАЭ. Хотя прогноз при поражении шейных и глубоких забрю-шинных узлов остается неблагоприятным. Неясно, может ли считаться радикальной операция, выполненная по поводу РП с М^-компонентом, и показана ли она вообще в таком случае? На самом деле, отдаленное метастазирование не всегда считают противопоказанием к проведению радикального вмешательства. Операция, дополненная расширенной регионарной ЛАЭ с удалением пораженных чревных узлов, может соответствовать всем критериям радикальности. Поэтому на практике перигастральные и чревные лимфатические коллекторы мы рассматриваем как регионарные для грудного отдела пищевода. Канцерогенез (локализация, распространенность, гистологическое строение, метастазирование) У подавляющего большинства больных (80%) опухоли локализуются в средне- и нижнегрудном отделах пищевода. Частота шейного РП не превышает 10-15%. В 5-8% случаев опухоли переходят на кардиальный отдел и малую кривизну желудка. В -.90% случаев - это плоскоклеточный рак различных степеней дифференцировки, в 5% - аденокар- 161 торакальная хирургия цинома, располагающаяся, как правило, в нижней трети пищевода. Редко находят диморфные опухоли, лейомиосаркомы, лимфомы. Заслуживает внимания классификация морфологических типов (форм) РП (Akiyama,1992), имеющих прогностическое значение: I тип — экзофит-ный; II тип - изъязвление с ровными краями; III тип - изъязвление с неровными краями; IV тип - поверхностный; V тип - эндофитный; VI тип - эндо-фитное образование. Кроме того, выделяют соли-тарный РП в виде единичного опухолевого очага и мулътифокалъный рак, представленный несколькими первичными фокусами опухолевого роста. Отдаленные метастазы поражают печень (32%), легкие (21%) и кости (8%). Общая частота лимфогенного метастазирова-ния РП колеблется в интервале от 34 до 85%. Метастатическое поражение регионарных лимфоузлов при РП - основной прогностический фактор, оказывающий большее влияние на отдаленные результаты лечения, чем протяженность опухоли или глубина инвазии стенки органа. Выделяют три анатомических региона лимфо-оттока пищевода - цервикальный, медиастиналь-ный и абдоминальный. Под регионарными лимфоузлами понимают группу узлов, в которые наряду с прямым лимфооттоком происходит прямое лим-фогенное метастазирование опухоли. Метастазы в абдоминальных лимфоузлах при РП обнаруживаются с частотой 40-50%, в медиастинальных — 60-65%, в шейных - 25-30%. Особенность лимфатической системы пищевода состоит в том, что в подслизистом и адвентициаль-ном слоях органа располагаются крупные лимфатические коллекторы, обеспечивающие преобладание продольного лимфооттока над сегментарным. Отсюда раннее, активное и часто интраму-ральное (до 30%) метастазирование РП. Частоту лимфогенного метастазирования в большей степени определяет не размер опухоли, а глубина инвазии стенки пищевода. По мере прорастания стенки органа частота поражения регионарных лимфоузлов растет. Лишь при внутриэпи-телиальном РП не находят метастазов, но при врастании опухоли в слизистый и подслизистыи слои лимфоузлы вовлекаются в 14 и 58% случаев соответственно. Несмотря на то что лимфогенное метастазирование у пациентов с подслизистым распространением РП представляет собой раннюю фазу опухолевой диссеминации, экстрамедиастинальные узлы живота и шеи поражаются при этом достаточно часто. При изучении лимфогенного метастазирования РП появление отсевов зарегистрировано уже при опухолях, врастающих в собственную мышечную пластинку слизистой оболочки. Основная направленность и интенсивность метастазирования детерминирована локализацией первичного очага. Тем не менее специальные исследования показали, что регионы лимфооттока едины для всего пищевода и могут вовлекаться при любой локализации опухоли, т.е. отсутствует последовательность и избирательность их поражения. При раке нижнегрудного отдела пищевода метастазы в лимфоузлах шее выявляются в 15-20% наблюдений. Парадоксальный характер лимфогенной диссеминации РП состоит в преимущественном поражении не ближайших к первичному очагу узлов, а удаленных от него. Свидетельством тому является высокая частота "прыгающего" метастазирования, достигающая 30%. Поэтому нет порядкового разделения регионарных лимфоузлов по мере их удаления от основного очага, как при раке желудка. В настоящее время во многих клиниках мира при РП используют классификацию регионарных и отдаленных групп лимфоузлов, принятую JSED (1978). Алгоритм диагностики рака пищевода Стандартный алгоритм инструментальной диагностики РП включает:
При поражении грудного отдела пищевода на уровне бифуркации трахеи и выше показана бронхоскопия с целью исключения инвазии трахео-бронхиального дерева. В ряде случаев полезная информация о распространенности РП может быть получена при компьютерной томографии, которая выявляет медиастинальную инфильтрацию и поражение лимфоузлов в 66-80% случаев. Весьма перспективным представляется внедрение в клиническую практику эндоскопической улъ-трасонографии, представляющей собой внутри-просветное УЗИ стенки пищевода при помощи специального датчика, закрепленного на эндоскопе. Эта диагностическая методика широко распространена за рубежом и позволяет точно определять глубину инвазии стенки в 83-86% и поражение медиастинальных лимфоузлов в 60-76% случаев. Принципы хирургического лечения рака пищевода Низкая чувствительность РП к химиопрепара-там, паллиативный и кратковременный эффект лучевой терапии делают хирургическое вмешательство методом выбора. Современная агрессивная стратегия оперативной онкологии органов желудочно-кишечного тракта состоит в максимизации хирургического воздействия на опухоль - радикальном удалении первичного очага роста с широкой диссек-цией регионов метастазирования. Ключевые моменты оперативного вмешательства Согласно данным современных публикаций, большинство практикующих хирургов придерживаются мнения, что с онкологических позиций радикальная операция при РП должна отвечать следующим требованиям: 1. Быть одномоментной, т.е. включать как радикальный, так и реконструктивный этапы. Сегодня нет таких больных, которые не могут быть по каким-либо причинам оперированы одномоментно. Следовательно, обладая рядом неоспоримых 162 торакальная хирургия преимуществ, одномоментные вмешательства не имеют принципиальных противопоказаний. 2. Удалять пищевод следует целиком при раке верхнегрудного отдела пищевода (тотальная ре зекция, эзофагэктомия) или выполнять субто тальную резекцию при раке средне- и нижнегруд ного отделов. Эта позиция основана на нередком мультицентрическом расположении очагов, пре имущественно инфильтративном росте опухоли в краниокаудальном направлении, частом интраму- ральном метастазировании. Экстирпация грудного отдела пищевода предполагает формирование внеполостного соустья на шее, которое имеет два важных преимущества: а) его несостоятельность более безопасна, чем внут-риплеврального; б) оно более доступно хирургической реконструкции. Кроме того, культя собственного пищевода должна быть не более 5-6 см в длину, тогда ее кровоснабжение наилучшее. Кстати, мы предпочитаем накладывать двухрядные инвагинационные пищеводные анастомозы. Однорядные соустья применяем редко из-за высокой частоты их несостоятельности - около 18%. 3. При выборе оперативного доступа необходи мо учитывать возможность выполнения расширен ной ЛАЭ. Многие современные авторы подчеркива ют необходимость торакотомии для осуществле ния адекватной медиастинальной ЛАЭ, независимо от уровня поражения пищевода. Трехзональная ЛАЭ выполняется из билатеральной цервикотомии, правосторонней торакотомии в IV—V межреберье и срединной лапаротомии. Для оценки местной распространенности онкопроцесса вмешательство лучше начинать с торакотомии, если при нерезек- табельной опухоли планируется наложить гастрос- тому. Если же при неблагоприятном исходе пред полагается шунтирующая пластика, то сначала вы полняют лапаротомию и формируют трансплан тат. Тем более, что РП более чем у трети больных метастазирует в лимфоузлы брюшной полости, по этому окончательно вопрос резектабельности ре шается только после выполнения лапаротомии. Мы согласны с тем положением, что при РП с прогнозируемой лимфогенной диссеминацией для обеспечения большей радикальности вмешательства необходим трансторакальный доступ, позволяющий выполнить медиастинальную ЛАЭ. Одним из перспективных направлений нашей работы является внедрение оперативной методики трехзональ-ной лимфодиссекции (шея, средостение, живот) при РП. Тем не менее трансхиатальную эзофагэкто-мию мы считаем радикальной при раннем РП и малотравматичной паллиативной операцией при позднем РП (IV стадии). Она показана тяжелым больным, т.к сравнительно легко переносится, дает небольшое число осложнений и низкую летальность. 4. Оптимальным пластическим материалом явля ется желудок. Он хорошо кровоснабжается и ус тойчив к гипоксии. Пищевод замещают изоперис- тальтическим трансплантатом из большой кривиз ны желудка с полным удалением малой кривизны и кардиального отдела желудка по соображениям ра дикальности. Методика предполагает формирова ние желудочной трубки шириной 3,5-4,0 см и дли ной до 50 см с питанием на правой желудочно- сальниковой артерии. Длина такого трансплантата во всех случаях достаточна для создания пищевод-но-глоточного соустья. Пораженный пищевод можно заменить фрагментом толстой кишки. Мы используем ее левую половину и выкраиваем антиперистальтический трансплантат на средней ободочной артерии. Причинами отказа от использования желудка при эзофагоплас-тике могут служить: а) ранее перенесенные на нем операции (гастростомия, гастроэнтеростомия, резекция и т.п.), б) его патологические изменения (распространенный рак, ожог, язвенная болезнь). В последнее время мы активно изыскиваем новые возможности создания искусственного пищевода из патологически измененного или оперированного желудка - используем дополнительные источники кровоснабжения трансплантата, разрабатываем технические приемы его ручного формирования с преимущественным использованием сохранной стенки. |
