ЛЕКЦИИ 50 лекций по хирургии под редакцией академика B.C. Савельева. ЛЕКЦИИ 50 лекций по хирургии под редакцией академика B.C. Савель. Media medica 2003 п од редакцией академика B. C. Савельева
 Скачать 9.44 Mb. Скачать 9.44 Mb.
|
|
Рис.4. Динамика системного транспорта кислорода при при различных уровнях гематокрита. 120 Гемоконцентрация 10 20 30 40 43 50 60 70 Р  ешая вопрос о показаниях к трансфузии эритроцитов, традиционно всегда полагались на уровень НЬ или Ht больного. Однако сегодня мы все более убеждаемся в опасности опираться на эти показатели как единственные критерии для назначения гемотрансфузии. ешая вопрос о показаниях к трансфузии эритроцитов, традиционно всегда полагались на уровень НЬ или Ht больного. Однако сегодня мы все более убеждаемся в опасности опираться на эти показатели как единственные критерии для назначения гемотрансфузии.Как уже упоминалось, первичную реакцию на снижение кислородной емкости крови обеспечивает сердце путем увеличения СВ. При ИБС и сердечной недостаточности оно может оказаться неспособным адекватно усилить свою работу без риска развития острой сердечной недостаточности. Поэтому у лиц с сопутствующей сердечной и легочной недостаточностью уровень НЬ лучше поддерживать выше 100 г/л, a Ht на уровне 0,36 л/л, поскольку эта степень гемодилю-ции, как правило, бывает безопасной. Не существует доказательств, что умеренная или средняя степень нормоволемической гемодилю-ции повышает риск периоперационных осложнений. Более того, есть доказательства, что при стабильной гемодинамике нормоволемическая гемодилюция хорошо переносится больными. И уровень НЬ 100 г/л уже не считается критерием для назначения препаратов крови. Таким образом, донорские эритроциты при острой кровопотере должны применяться на втором этапе лечения, когда устранен дефицит ОЦК с помощью плазмозаменителей и имеется доказанная необходимость в увеличении доставки кислорода у больных, не способных удовлетворить эту потребность посредством собственных физиологических механизмов. Иными словами, прямым и по существу единственным абсолютным показанием к трансфузии донорских эритроцитов при острой кровопотере является необходимость в коррекции избыточной гемодилюции при появлении признаков гипоксии тканей. Необходимо подчеркнуть, что переливание консервированной эритромассы наиболее эффективно именно на фоне искусственной гемодилюции, которая восстанавливает центральную гемодинамику, улучшает микроциркуляцию и транскапиллярный обмен и тем самым обеспечивает влитым донорским эритроцитам оптимальные условия для транспорта и отдачи кислорода тканям. При кровопотере повышения кислородной емкости крови можно добиться не Только, используя донорские эритроциты, но и применяя препараты с газотранспортной функцией. В последние два десятилетия появились кровезаменители переносчики кислорода, разработанные на основе эмульсий перфторуглеродов - химически и физически инертных соединений, растворяющих до 60 об. % кислорода и до 90 об. % углекислого газа. На их основе разработан и создан первый отечественный препарат с газотранспортной функцией - перф-торан и японский препарат флюозол. Эмульсии перфторана имеют голубой цвет, поэтому его еще называют «голубая кровь». Эти препараты не только переносят кислород, но и уменьшают вязкость крови и улучшают микроциркуляцию, а также способны разрушать жировые эмболы. Перфторан циркулирует в кровяном русле достаточно долго: через 24 ч в кровотоке циркулирует около 30 %, через 48 ч - 13%, через 120 ч - 1 % перфторана. Легкие являются одним из основных путей выведения фторуглеродов из организма. Но они куму-лируются и в микро- и макрофагальной системах селезенки и печени. В меньшем количестве они определяются в лимфатических узлах, костном мозге, вилочковой железе. Особо следует обсудить особенности инфузион-но-трансфузионной терапии при кровотечении, которое не удалось остановить, а также при высокой угрозе его рецидива. Раннее восполнение внут-рисосудистого объема при продолжающемся кровотечении остается спорным вопросом. Установлено, что введение большого количества переливаемой жидкости сопровождается нарушением тром-бообразования, усилением кровотечения и повышением летальности. Поэтому, если мы не можем надежно остановить кровотечение, то инфу-зионная терапия не должна быть слишком активной и АД следует поддерживать на минимально приемлемом уровне. Хотя критическая точка, на которой следует поддерживать АД при кровотечении, неизвестна, но ясно то, что оно не должно быть ниже 80/40 мм рт.ст. Это очень ответственная и серьезная рекомендация, потому что пожилые пациенты плохо переносят гипотонию, а у больных с нефросклерозом при низком АД может развиться почечная недостаточность. Поэтому стандартного рецепта нет. Следует очень серьезно индивидуально просчитывать тактику, однако вести больного следует на минимально допустимом АД. При повышении АД мы будем способствовать отрыву тех первичных тромбоцитарных рыхлых сгустков, с которых начинается процесс тромбообра-зования и остановки кровотечения. Поэтому пока тромб мягкий и свежий с минимальным содержанием фибрина высока вероятность его разрушения 278 абдоминальная хирургия и рецидива кровотечения. На образование фибрина, укрепляющего тромбоцитарный сгусток, уходит не менее 30 мин. А на образование прочного фибринового тромба требуется около 24 ч. Но что же делать, если АД продолжает снижаться ниже критического уровня? Введение сосудосуживающих средств для поддержания АД при кровотечении - наименее удачный выход из положения, поскольку это усиливает нарушения микроциркуляции и тканевого метаболизма. Улучшить кровоснабжения мозга и сердца при снижении АД можно за счет перераспределения крови больного из нижних конечностей, сосуды которых вмещают 15-20 % общего объема крови. Поэтому подъем ножного конца кровати должен быть первым и немедленным мероприятием, как только констатировано снижение систолического АД ниже 80 мм рт.ст. Это простой и полезный прием, который позволяет увеличить венозный возврат крови к сердцу. Также действуют эластическая компрессия конечностей, специальные пневматические шины и медицинские противошоковые брюки. В этой ситуации лечение должно быть направлено также на повышение свертываемости крови и восполнение кровопотери. Для достижения этих задач оптимальным следует считать использование свежезамороженной плазмы. При тяжелой кровопотере возникает необходимость и в лечении других патологических синдромов. Наиболее частыми следствиями геморрагического шока или его интенсивной терапии являются острая сердечная, почечная и печеночная недостаточность, респираторный дистресс-синдром, ДВС-синдром, синдром массивного кровезамещения. Почти во всех случаях тяжелой кровопотери требуются глюкокортикоидные гормоны, специальная респираторная терапия и профилактика вторичных желудочно-кишечных кровотечений из острых эрозий. Не следует опаздывать с их применением, надо чтобы геморрагический синдром, на который направлено лечение, был купирован, а новый не возник. Альтернативы переливанию крови В последнее время после приблизительно трех десятилетий неограниченного использования цельной крови и ее компонентов, медицина неожиданно столкнулись с двумя большими проблемами: нехваткой человеческой крови и высоким риском, связанным с переносом инфекции и иммунологическими реакциями. На рубеже веков стало очевидно, как опасна чужая кровь. В связи с этим трансфузиологи пересмотрели показания к использованию препаратов крови и разработали ряд альтернатив, связанных, в частности, с использованием собственной крови больного. Во многих программах бескровной хирургии у пациентов с анемией давно принято использование эритропоэтина (ЭПО). В настоящее время его получают при помощи методов генной инженерии. Рекомбинантный ЭПО представляет собой синтетическую форму естественного гормона и подобно эндогенному стимулирует эритропоэз, действуя на костный мозг. Для обеспечения полноценного эритропоэза одновременно с ЭПО обязательно назначают препараты железа и другие структурные компоненты, входящие в состав эритроцитов. Использование препаратов донорской крови можно также ограничить с помощью более широкого использования аутокрови. Многих пациентов успокаивает мысль о том, что им не переливают чужой крови а только их собственную. Существуют два варианта использования аутокрови. Это реин-фузия и аутогемотрансфузия. Возвращение больному крови излившейся в рану или полость при кровотечении, известно как реинфузия крови, а заранее заготовленной и стабилизированной - как аутогемотрансфузия. Аутогемотрансфузия Предложено несколько различных вариантов заготовки аутокрови перед операцией. Наиболее известен метод, когда заготовку и хранение крови больного осуществляют на протяжении нескольких дней или даже недель до плановой операции. При этом заготовку аутокрови осуществляют в трансфузионном центре. Этот метод требует особых условий обработки, консервации и хранения крови. В последние годы за рубежом предоперационная заготовка крови стала менее популярной из-за ее высокой стоимости, низкой эффективности и большом количестве случаев, когда больные не успевают восстановить уровень гемоглобина к операции. В настоящее время этот метод подвергается осторожной переоценке. Более популярной становится методика предоперационной нормоволемической гемодилюции, которая позволяет одномоментно заготовить до 2 л свежей аутокрови без ущерба здоровью больного. Методика заключается во взятии у больного непосредственно перед операцией части его крови и в замещении этого объема кровезаменителями. При этом ОЦК остается прежним, а уровень гематокри-та снижается до 20-30%. Этот уровень эритроцитов вполне достаточен для нормального транспорта кислорода. Хотя кровотечение во время операции остается прежним, в условиях гемодилюции больной теряет меньше собственных эритроцитов, поскольку кровопотеря идет в значительной степени за счет введенного плазмозаменителя. Собранная кровь находится тут же в операционной и используется для компенсации операционной кровопотери. В свежей крови эритроциты и факторы свертывания сохраняют все свои свойства. Эта кровь лучше переносит кислород и эффективнее способствует остановке кровотечения, чем хранящаяся длительное время. На математических моделях рассчитано, что использование предоперационной нормоволемической гемодилюции с резервированием крови пациента позволяет на 17% уменьшить потерю эритроцитов по сравнению с интраоперационной ге-модилюцией, при которой операционную крово-потерю восполняют плазмозаменителем. Нормоволемическая предоперационная гемоди-люция - рентабельный метод, поскольку он прост, не требует большого времени и материальных затрат, при этом используются стандартные пакеты для заготовки крови. Помимо снижения потребностей в донорской крови нормоволемическая гемо-дилюция оказывает положительное влияние на реологические свойства крови. Снижение вязкости 279 абдоминальная хирургия крови сопровождается улучшением микроциркуляции, увеличением сердечного выброса и доставки кислорода тканям. Все это позволяет больному легче перенести операционную агрессию. Всем ли пациентам перед операцией необходимо заготавливать аутокровь? Резервирование ау-токрови перед операцией нужно проводить лишь в тех случаях, когда ожидается крово-потеря более 20% ОЦК. При этом больной должен быть в состоянии перенести эту процедуру. Абсолютные противопоказания включают: острые инфекции, нестабильные заболевания сердца и анемию с уровнем гемоглобина ниже ПО г/л. Количество заготавливаемой крови зависит от объема прогнозируемой кровопотери и исходного состояния пациента. Реинфузия крови При реинфузии кровь, излившуюся в операционную рану или полости тела, отсасывают, фильтруют и опять вводят больному. Процедуру можно проводить как во время, так после операции. Основным показанием к реинфузии аутокрови является острая кровопотеря, превышающая 20% ОЦК. В настоящее время этот метод широко применяется в сердечно-сосудистой хирургии и ортопедии, где врачи часто имеют дело с массивной кровопо-терей. Этот метод хорошо зарекомендовал себя также в акушерстве и гинекологии, где угрожающие кровотечения отличаются высокой частотой, внезапностью и обилием вытекающей крови. «Отныне ни одна женщина не должна умирать от разрыва трубы во время операции, если используется реинфузия крови» - так была названа статья немецкого хирурга Лихтенштейна, опубликованная еще в 1918 г. Это было первым упоминанием о реинфузии. Когда кровь реинфузируют без отмывания, она содержит вредные для больного активированные факторы свертывания, свободный гемоглобин, продукты деградации фибрина, вазоактивные вещества и микросгустки. После переливания такой крови у больных могут наблюдаться различные трансфузионные реакции и осложнения, причем весьма грозные:
Особенно выраженные изменения наблюдаются в крови, собранной из операционной раны в вакуумную дренажную систему в послеоперационном периоде. Высок риск ее бактериального обсеменения. Во избежание сепсиса реинфузию крови, со- бранной при таком дренировании, не следует производить позже чем через 6 ч после операции. Такая кровь не содержит тромбоцитов, насыщена активаторами фибринолиза (Д-димерами и продуктами деградации фибрина), и она может вызвать нарушения свертывания и привести к сильному кровотечению. Для снижения риска осложнений при реинфузии собранную кровь подвергают предварительной обработке. Для этого ее фильтруют, центрифугируют и отделяют плазму от эритроцитов, которые затем отмывают и возвращают больному. При этом только 50% собранных эритроцитов может быть введено обратно, остальные подвергаются гемолизу или теряются по другим причинам. Самыми совершенными аппаратами для реинфузии являются так называемые СЕЛ-СЕЙВЕРЫ (CELL SAVER), работающие с использованием всех 4 принципов реинфузии (сбор и стабилизация, фильтрация, центрифугирование и отмывание). Значительная стоимость этих аппаратов и необходимого для них расходного материала ограничивают их широкое применение. Они используются только в небольшом числе клиник, где регулярно выполняются операции, сопровождающиеся массивной кровопотерей. В большинстве хирургических стационаров имеются более простые и дешевые приспособления для реинфузии излившейся крови. Более глубокое познание клинической физиологии кровопотери, совершенствование методов профилактики и остановки кровотечения, использование технологий сбережения собственной крови больного, возможность ускорять ее естественное воспроизводство и появление новых эффективных кровезамещающих препаратов позволяют нам с каждым годом находить все более надежные и безопасные пути лечения кровопотери. Литература
10. Pruitt В., Moncrief J., Mason AD. Effect of Buffered Saline Solution upon Blood Volume of Man Acute Hemorrhage: Annual Research Progress Report. San Antonio, Institute of Surgical Research, 1965. 280 абдоминальная хирургия Радикальная дуоденопластика в хирургии осложненных дуоденальных язв В.И. Оноприев    Какими бы убедительными не были аргументы в пользу рекомендуемой хирургической коррекции, оппоненты едины во мнении, что пароль «идеальной» может претендовать реконструкция, способная полностью восстановить функционирующую Какими бы убедительными не были аргументы в пользу рекомендуемой хирургической коррекции, оппоненты едины во мнении, что пароль «идеальной» может претендовать реконструкция, способная полностью восстановить функционирующуюструктуру F.Holle, 1970 Исторический экскурс История развития дуоденопластики сравнительно молода. Первый ее шаг сделал в 1971 г. Norman С. Tanner, который для устранения язвенного дуоденального стеноза использовал известные пилоро-разрушающие приемы Heineke-Mikulich и Finney. Выполнение этих манипуляций ниже привратника позволило сохранить привратник и назвать способ дуоденопластикой. Техническая детализация аналогичного способа с описанием приемов, предупреждающих повреждение привратника, выполнена в 1972 г. и Т. Kennedy. Однако на современном этапе развития органо-сохраняющих технологий операцию Танне-ра-Кеннеди нельзя отнести к идеальной из-за значительных недостатков метода: оставление осложненной язвы — патоморфологической основы хро-низации или ее рецидивирования; сохранение патологической фиксации привратника и луковицы двенадцатиперстной кишки (ДПК); неизбежное натяжение в швах при больших размерах язвенного очага; ригидность создаваемого непрерывным швом просвета кишки; неизбежное повреждение привратника, его кровоснабжения и иннервации при околопривратниковой локализации язвы; опасность повреждения магистральных сосудов, желчных и панкреатических протоков при прошивании низких кровоточащих язв. Следующим этапом повышения эффективности органосохраняющих операций закономерно стала необходимость разработки технологий радикального удаления язвенного очага. Первый вариант решения этой задачи предложили Heiwing и Heymann в 1978 г. в виде резекции сегмента ДПК на уровне осложненной язвы. В дуодено-дуоденаль-ный анастомоз включался нижний край кратера язвы, выведенной за просвет ДПК. В сущности выполнялась подпилорическая широкая сегментарная резекция луковицы с конце-концевым дуоденальным анастомозом. Этот способ хотя и устранил ряд недостатков, однако предполагал неоправданное удаление неизмененных стенок луковицы, недостаточно мобилизовались адаптируемые стенки ДПК, допускалось оставление края язвенного очага на дуоденальной стенке и включение его в анастомоз, сохранялась высокая вероятностью рубцовой фиксации к кратеру язвы задней стенки луковицы с привратником. В настоящее время на роль идеальной технологии хирургического устранения осложненных язв ДПК может претендовать только радикальная мое- 281 товидная и сегментарная дуоденопластика (В.И. Оноприев и соавт. - патенты и многочисленные публикации с 1980 до 2002 г.). Гистотопография осложненных дуоденальных язв Современная реконструктивная хирургия осложненных язв двенадцатиперстной кишки требует детального изучения их патоморфологических особенностей (А.Ф. Черноусое, 1983). Кровотечение, перфорация, стеноз, пенетрация и другие угрожающие жизни осложнения, как правило, развиваются уже на базе выраженных, т.е. сформировавшихся стенотических рубцово-язвенных деформаций ДПК (В.И. Оноприев, 1995). В общем механизме формирования стенотических рубцово-язвенных деформаций участвуют сегментарный спазм, воспалительный отек и рубцово-спаечный процесс (AKerlund, 1921; Clairmant, 1923; В.И. Фанарджян, 1964, и др.). Первоначально сужающее ДПК кольцо состоит их двух морфологически разных частей: первичной шпоры — язвы-рубца и вторичной шпоры — удвоения стенки ДПК, возникающего в результате втяжения ее контралатеральным спазмом в просвет ДПК к язвенному очагу с последующей фиксацией основания вторичной шпоры наружным руб- Р  ис. 1. Схема функционального стеноза двенадцатиперстной кишки: ис. 1. Схема функционального стеноза двенадцатиперстной кишки:1 - пилорический жом; 2 - сегментарное кисетное сужение двенадцатиперстной кишки; 3 - язва - первичная шпора кисетного стеноза; 4 - удвоен ные стенки луковицы - вторичная шпора стеноза (постъязвенный псевдопривратник); 5 - наружный спаечный перипроцесс; 6 - боковые кисеты псев додивертикулов, f 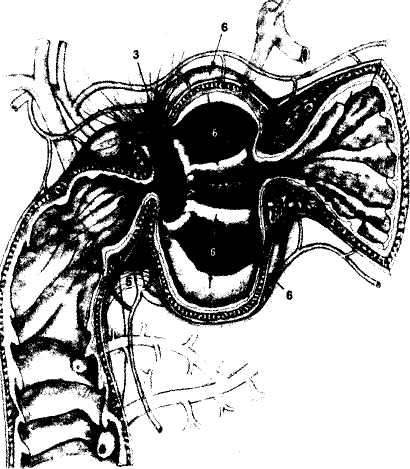 абдоминальная хирургия   Рис.2. Иссечение рубцового стенотического кольца при субкомпенсированном стенозе. Рис.2. Иссечение рубцового стенотического кольца при субкомпенсированном стенозе.1 - проксимальный отдел ДПК; 2 - дистальный отдел ДПК. 3 - стенотическое кольцо (макропрепарат (а) и микропрепарат (б). 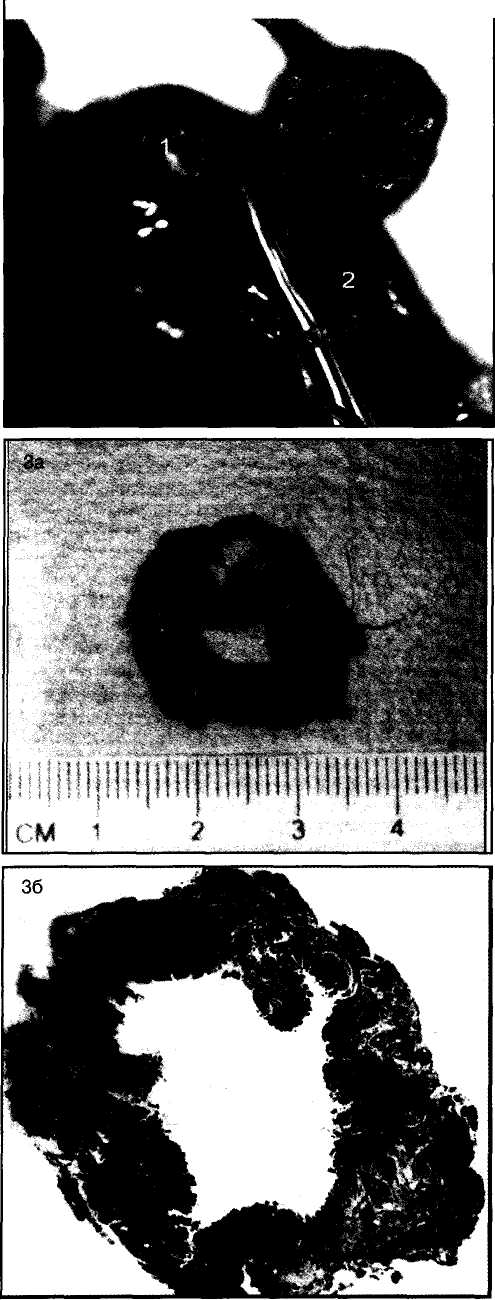 цово-спаечным кольцом (рис.1). Удвоенная стенка двенадцатиперстной кишки — псевдопривратник после фиксации снаружи перипроцессом теряет способность к расправлению и расширению, но сохраняет способность к спазмам, т.е. к уменьшению просвета ДПК. Функциональный стеноз при дуоденальных язвах обязательная начальная стадия развития рубцового стеноза. Защитный сегментарный спазм стенки ДПК на уровне язвы сначала формирует псевдопривратник, который, по-стенно сужаясь и рубцуясь, берет на себя функцию привратника, последний из-за ненадобности дила-тируется, хотя признаков декомпенсации желудка еще долго нет. Рубцовый сегментарный стеноз - это сегментарное рубцово-спаечное поле язвы, распространяющееся от пенетрирующей язвы, как снаружи по серозному слою, так и внутристеночно, захватывая подслизистые и мышечные слои псевдопривратника, замыкается в кольцо, которое постепенно сужается (рис.2). При острых язвах, непосредственно вокруг прогрессирующего язвенного дефекта (зоны некроза - тканевой деструкции), определяется воспалительный отек, возвышающийся в виде валика и распространяющийся от края язвы не более 1 -1,5 см. Этот отечный валик соответствует зоне выраженной воспалительной дегенерации (вплоть до некроза) и одновременно соединительнотканной трансформации основных гистологических и клеточных структур стенок ДПК, под-слизистых, мышечных, серозных слоев, их сосудов и нервов. При этом рядом с нормальными клетками и их группами (волокнами) видны различные стадии дегенерации клеток. Вместе с тем необратимая соединительнотканная трансформация специализированных рабочих клеточных структур во всех слоях дуоденальной стенки распространяется всего на 0,5-0,7 см от слоя фибриноидного некроза стенки язвы. При хронизации процесса зона выраженной воспалительной дегенерации трансформируется в 4-й гомогенный фиброзный слой. Вокруг монолитного фиброзного слоя хронической язвы визуально обнаруживается рубцовое поле на протяжении 1,0-1,5 см, четко отличающееся от последнего пестрой слоистостью стенок, т.е. сохранением гистотопографии слоев пронизанных соединительно-тканными прослойками. Границы между серозными, мышечным и под-слизистыми слоями нечеткие, вследствие разрастания в них соединительно-тканных элементов. Это своего рода пятый слой хронической язвы, т.е. ее рубцовое поле, которое формирует рубцово-спа-ечные деформации стенок ДПК При иссечении хронической язвы по этому слою происходит полное расправление конвергенции стенок ДПК, стянутых соединительнотканными тяжами к центру язвы (рубца). Этот слой мы назвали «хирургическим». Именно рубцовое поле пятого слоя хронической язвы формирует конвергирующие и стенотические деформации стенок ДПК вокруг язвы (рубца). Отек и фибробластическая трансформация тканей от язвы могут распространятся только по окружности ДПК т.е. сегментарно. Если разрушается язвой сегментарная сосудистая дуга и остро нарушается кроволимфо-обращение в сегменте ДПК развивается острый сосу-дисто-стазовый отечный стеноз. Вследствие гипоксии и ацидоза в сегменте отека развивается дистрофическая трансформация специализированных клеточных структур в соединительную ткань. Более всего этот процесс развивается в подсли-зистом слое. При заживлении язвы и развитии колла-тералей острый отечный стеноз уменьшается или исчезает. Этот механизм повторяется при рецидивах язв, размер которых с каждым разом увеличивается. 282 абдоминальная хирургия В механизме адгезивного рубцово-спаечного пери-процесса лежит пенетрация, т.е. полное разрушение стенки ДПК и выход повреждающих факторов за ее пределы. Защитные фибриноидные наложения и последующая их трансформация в спаечные наложения распространяются не только сегментарно, но и широко во всех направлениях, не только на двенадцатиперстную кишку, но на привратник и даже антраль-ный отдел желудка, симулируя обширность воспаления стенок. При рецидиве язвы рубцово-спаечные наложения лизируются, а при ее рубцевании образуются вновь и в большей мере. Адгезивный процесс сопровождает только пенетрирующие язвы. Рубцово-спаечная мантия плотно фиксирована только в центре пенетра-ции, т.е. строго над язвой (рубцом). В остальных отделах между стенкой ДПК и мантией рыхлая клетчатка, т.е. мантия подвижна и легко снимается. Рубцово-спаечные наслоения полностью закрывают сегментарный стеноз. Характер и выраженность стеноза можно изучить только после снятия мантии. Кисетное сужение ДПК независимо от ее степени всегда сопровождается вторичным надстенотичес-ким ее расширением, которое может быть с псевдодивертикулами или без них, т.е. иметь одну общую мешковидную полость. По механизму формирования псевдодивертикулы разделяем на пульсионные, трак-ционно-пульсионные и тракционные. Тракционные псевдодивертикулы могут располагаться на любом уровне луковицы ДПК, но только на стенке несущей рубцово-язвенный очаг. Они всегда малого размера и замурованы в стенках. Рубцовые тяжи прочно фиксируют вершину тракционного псевдодивертикула и вытягивают стенку луковицы в виде конусовидного кармана, имеющего широкий вход и узкую вершину. Пульсионные и пульсионно-тракционные дивертикулы имеют более узкий вход и расширяющееся мешковидное или шаровидное выпячивание - головку. Серозная оболочка передней и задней стенок около-пилорических рецессусов прочно соединена с под-слизистым слоем, и стенки в этой зоне малорастяжимы, а боковые стенки лишены серозной оболочки, так как здесь к ним прилежит жировая клетчатка сальников. Поэтому стенка околопилорических карманов свободно растягивается в рыхлой клетчатке, т.е. «головка» псевдодивертикула растет из околопило-рического кармана в пространство рыхлой жировой клетчатки малого и большого сальников. При локализации язв по центральным линиям передней, задней или сразу обеих стенок (и целующиеся язвы) на базальном или корпоральном уровнях луковицы, т.е. когда абсолютно свободны боковые око-лопилорические рецессусы, из последних формируются симметричные псевдодивертикулы. При этом базальные язвы формируют псевдодивертикулы меньших размеров, чем корпоральные. Асимметричность, т.е. различие в величине псевдодивертикулов обусловлены смещением язвы от центральной линии в сторону меньшего псевдодивертикула. При базаль-ных язвах боковых стенок большой или малой кривизны формируются только одиночные пульсионные псевдодивертикулы на противоположной, т.е. свободной от язвы, стенки луковицы, так как стенка околопилорического рецессуса, несущего язву, разрушается и фиксируется рубцовым процессом. Поэтому из нее не может формироваться пульсионный псевдодивертикул. Одиночный псевдодивертикул со- здает яркую асимметрию. При корпоральных язвах боковых стенок на стенке, несущей язву, формируется пульсионно-тракционный псевдодивертикул и он всегда меньше размерами пульсионного, образовавшегося на противоположной свободной от язвы стенке, что и обусловливает асимметричность деформации луковицы. Сегментарному рубцово-язвен-ному стенозу на третьем и четвертом уровнях ДПК соответствует общее мешковидное надстенотичес-кое расширение. При этом симметричная его форма возникает при локализации язв по центральным линиям передней и задней стенок, а асимметричная, при язвах боковых стенок ДПК Асимметричные мешковидные надстенотические расширения всей луковицы ошибочно трактуются как огромные дивертикулы ДПК. На всех уровнях проксимальной части ДПК может формироваться редкая форма симметричного общего расширения без псевдодивертикулов и наружного спаечного процесса, так как стенотическое рубцовое кольцо формируется язвой, не проникающей глубже подслизистого слоя. Рубцующийся подслизистый слой симметрично, циркулярно втягивает стенки ДПК удваивая их, и создает ригидный псевдопилорус. Вышеперечисленные закономерности морфологических взаимосвязей между локализацией язвы (рубца) и основными анатомическими элементами деформации явились основой хирургической классификации, по которой тип кисетной деформации и его название определяются уровнем локализации рубцово-язвенного очага, а вид сегментарной деформации - стенкой, несущей язву (рубец) (рис.3). В зависимости от уровня локализации рубцово-язвенного очага выделено 4 типа сегментарных деформаций: 1 — базальные; II - корпоральные; III -апикальные; IV — постбульбарные. На каждом уровне—в зависимости от локализации язвы, по окружности ДПК, т.е. по стенке, выделяем еще четыре вида деформаций: 1 - симметричные передней, задней стенки или сразу обеих стенок, т.е. целующиеся деформации; 2 — асимметричные большой кривизны; 3 — асимметричные малой кривизны; 4 - симметричные без псевдодивертикулов и пери-процесса (псевдопилорические деформации). При множественных или гигантских язвах проксимальная часть ДПК буквально обезображивается чрезвычайно сложными и абсолютно индивидуальными формами стенозов и надстенотических расширений. При множественных язвах, резко деформирующих луковицу, часто встречаются "целующиеся" язвы боковых стенок и циркулярные язвы. Дуоденальный стеноз, захватывающий два и более уровней проксимальной части ДПК, мы называем тубулярным (трубчатым). Тубулярный стеноз, включающий два или три первых уровня ДПК, т.е. почти или всю луковицу, называем проксимальным тубулярным стенозом (микробульбусом), тубулярный стеноз, захватывающий два или три последних уровня проксимальной части двенадцатиперстной кишки, относим к дистальным; тубулярным стенозам, а тубулярный стеноз, захватывающий два средних уровня, т.е. только II и III уровни луковицы медиальным тубулярным стенозом. Тотальный тубулярный стеноз захватывает всю проксимальную (до сосочка) часть ДПК. У,больных с «декомпенсированными» сегментарными и тубулярными стенозами полностью исче- 283   абдоминальная хирургия абдоминальная хирургияР  ис. 3. Виды сегментарных деформаций: ис. 3. Виды сегментарных деформаций:I - базальные; II - корпоральные; III - апикальные; IV - постбульбарные; а - симметричные: передней, задней или сразу обеих стенок; б - асимметричные большой кривизне; в - асимметричные малой кривизны; г - симметричные без псевдодивертикулов и перипроцесса (псевдопилорические деформации). 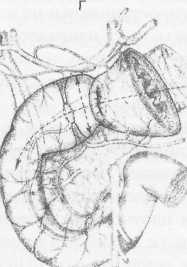 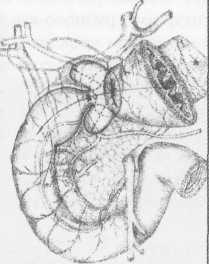 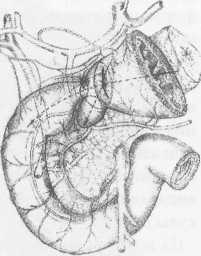 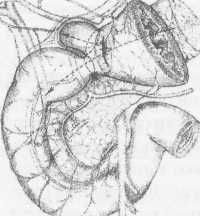    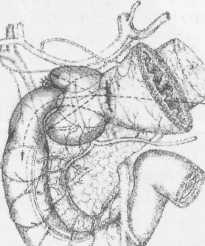 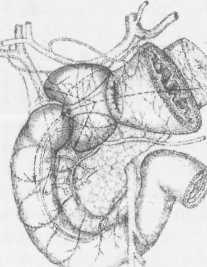 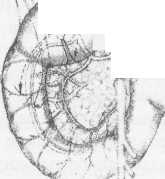 * ■ 1.. \   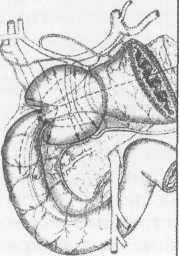 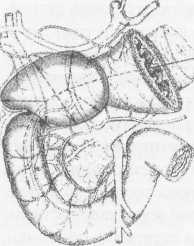 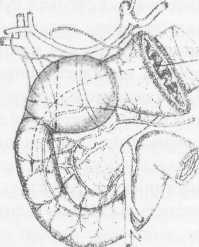      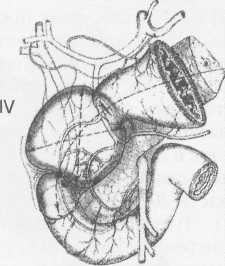 ЙЕ^  зали все анатомические формы надстенотического расширения. Происходила антрализация надсте-нотической части луковицы, т.е. полностью дила-тировался пилорус, расправлялись и сливались с антральным отделом псевдодивертикулы. При этом воспаленная слизистая луковицы (стазовый бульбит) не отличалась при эндоскопическом исследовании от слизистой антрального отдела. зали все анатомические формы надстенотического расширения. Происходила антрализация надсте-нотической части луковицы, т.е. полностью дила-тировался пилорус, расправлялись и сливались с антральным отделом псевдодивертикулы. При этом воспаленная слизистая луковицы (стазовый бульбит) не отличалась при эндоскопическом исследовании от слизистой антрального отдела. Необходимо учитывать, что при тубулярных стенозах параллельно с декомпенсацией и антрализа- циеи происходит нависание, сползание дилатиро-ванных стенок луковицы, привратника и антрального отдела на тубулярный стеноз и фиксация их к нему рубцами. Тубулярный стеноз как бы втягивается в луковицу и желудок и формируется фиксированная «чернильница невыливайка» (рис.4), в конструкции которой дилатированный привратник располагается ниже вершины стеноза. На этапе исследования необходима дезинвагинация, которую можно выполнить, только пересекая сраще- 284 абдоминальная хирургия    Рис. 4. Схема декомпенсированного тубуляр-ного стеноза по типу «чернильницы-невыливайки»: Рис. 4. Схема декомпенсированного тубуляр-ного стеноза по типу «чернильницы-невыливайки»:1 .Дилатированный привратник,
|
