Орг. Химия. Орг. химия. Лаборат. практ. 2018. Мифи (дити нияу мифи) Органическая химия Лабораторный практикум для студентов специальности 18. 05. 02 Составитель С. В. Павутницкая Димитровград 2018 г
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
|
3.2 Методы очистки органических соединений и определение их важнейших констант Органические соединения, выделенные из природных источников или полученные в результате синтеза, практически всегда загрязнены примесями. При их использовании для конкретных целей требуется определенная степень чистоты. При выборе метода очистки в первую очередь учитывается агрегатное состояние вещества. Основными методами являются кристаллизация, возгонка в вакууме, перегонка, экстракция, хроматография. Кристаллизация (перекристаллизация). Используется для веществ, находящихся в обычных условиях в кристаллическом состоянии. Для очистки конкретного вещества подбирают растворитель. Он должен удовлетворять следующим основным требованиям: не должен химически реагировать с кристаллизуемым веществом, растворимость вещества при комнатной температуре должна быть по возможности небольшой, а при температуре кипения – высокой. При кипении примеси, как правило, растворяются вместе с основным веществом. Если часть примесей не растворяется при нагревании, их удаляют фильтрованием горячего раствора. При последующем охлаждении раствора основное вещество выкристаллизовывается, а примеси остаются в растворе. Суть метода заключается в том, что при охлаждении образуется раствор, пересыщенный относительно основного вещества (так как его много) и ненасыщенный относительно примесей. После сушки кристаллов всегда получается более чистое вещество. Регулируя скорость охлаждения раствора, можно получать кристаллы разных размеров. При быстром охлаждении, как правило, образуются мелкие кристаллы, а при медленном – крупные. При необходимости получения еще более чистого вещества перекристаллизацию повторяют несколько раз. При этом следует иметь в виду, что при каждой операции часть основного вещества остается в растворе и теряется вместе с примесями. Часто при кристаллизации трудно подобрать индивидуальный растворитель и приходится использовать смешанные растворители. Существует также метод фракционированной кристаллизации, в ходе которой последовательно отделяют кристаллы, постепенно выпадающие при понижении температуры. Последующая повторная кристаллизация полученных фракций позволяет разделить два или несколько находящихся в смеси кристаллических органических веществ. Маточные растворы, содержащие примеси и часть основного вещества, при необходимости собирают, растворитель выпаривают, а остаток подвергают снова кристаллизации. Перегонка. Используется для очистки и разделения веществ в жидком состоянии. Перегонкой называют процесс, в ходе которого вещество нагревают в соответствующей аппаратуре до кипения и образовавшийся пар конденси-руют. Метод основан на том, что все вещества имеют индивидуальную температуру кипения и при нагревании смеси в первую очередь начинает кипеть и превращаться в пар жидкость с наименьшей температурой кипения. Температура перегонки контролируется термометром. Она остается постоянной, пока отгоняется определенная жидкость. Кроме простой перегонки при атмосферном давлении используют несколько разновидностей процесса перегонки: перегонка под вакуумом, под давлением, с водяным паром, ректификация. Перегонка под вакуумом используется для высококипящих жидкостей, которые до наступления кипения разлагаются. Температура кипения сильно зависит от давления. Понижая давление в установке для перегонки (откачивая из установки воздух), можно значительно снизить температуру кипения и осуществить перегонку. Перегонка под давлением используется для разделения и очистки веществ, которые в обычных условиях являются газами. При повышении давления они сжижаются и способны перегоняться. Экстракция (извлечение) используется для очистки веществ от примесей и для разделения смеси веществ. Для экстракции органических соединений из водных растворов часто применяют диэтиловый и петролейный эфиры, бензин, бензол, хлороформ и другие, не смешивающиеся с водой растворители. Растворитель должен растворять выделяемое вещество лучше, чем вода. Для идентификации органических веществ и доказательства чистоты того или иного вещества используют методы определения физических констант органических соединений. Чаще всего для выяснения степени чистоты кристаллического вещества достаточно определить температуру его плавления, а для жидкости – плотность, температуру кипения и показатель лучепреломления. Температурой плавления вещества называется температура, при которой твердое вещество находится в равновесии с собственным расплавом. Разность между температурой, при которой появляется жидкая фаза, и температурой полного расплавления вещества для чистых соединений не должна превышать 0,5 градуса. Незначительные загрязнения вещества иногда сильно понижают температуру его плавления и плавление происходит в более широком интервале температур. Такое явление используют для установления идентичности двух веществ с одинаковой температурой плавления. Многие органические вещества плавятся с разложением, которое обнаруживается обычно по окрашиванию расплава или выделению газов. Разложение является химическим процессом и температура, при которой оно происходит, зависит, в первую очередь, от продолжительности и скорости нагревания. Нередко в качестве характеристики веществ, которые плавятся с разложением, в справочной литературе приводится величина температуры плавления с дополнением «разл.». Между температурой плавления вещества и его строением существует зависимость. Так, симметрично построенные молекулы плавятся при более высокой температуре, чем их изомеры. Методика проведения опытов Опыт 1. Кристаллизация (перекристаллизация) В термостойкий стаканчик объёмом 100 см3 помещают 10 г щавелевой кислоты (или другого соединения по указанию преподавателя) и 25 мл воды (или другого растворителя по указанию преподавателя). При перемешивании убеждаются, что вещество не растворяется. Нагревают содержимое стаканчика до температуры кипения. При этом вещество должно раствориться. Если остаются не растворившиеся частицы, раствор в горячем состоянии быстро фильтруют. Раствор делят пополам. Одну часть с раствором охлаждают при комнатной температуре, другую – быстро охлаждают под струей холодной воды. Полученные кристаллы отфильтровывают, отсасывая жидкость с помощью фарфоровой воронки Бюхнера (рисунок 5), присоединив колбу Бунзена к насосу.  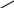 3 Рисунок 5 - Устройство для отфильтровывания кристаллов. 1 – воронка Бюхнера; 2 – колба Бунзена; 3 – бумажный фильтр. Сравнивают кристаллы, выпавшие в разных температурных условиях. Опыт 2. Дробная (фракционная) перегонка Простейшая лабораторная установка для перегонки приведена на рис. 6. Помещают в перегонную колбу 2 исходную смесь, которую нужно разделить, и кусочки фарфора или кипелки для обеспечения равномерности кипения. Нагревают колбу с помощью колбонагревателя 1, водяной или песочной бани до кипения смеси. Пары жидкости, попадая в холодильник 5, конденсируются в жидкость, которая стекает в колбу-приемник 8. Термометр 4 показывает температуру кипения перегоняющейся жидкости. По окончании отгонки этой жидкости температура упадет. Если разгоняется смесь веществ, приемник меняют и нагревают колбу до более высокой температуры, пока не начнет перегоняться следующая, более высококипящая жидкость. Подсоединив установку к вакуум-насосу через патрубок 9 и, создав необходимый вакуум, на этой установке можно перегонять жидкости, имеющие высокие температуры кипения.  Рисунок 6 - Установка для перегонки: 1 – колбонагреватель; 2 – колба с жидкостью; 3 – насадка Вюрца; 4 – термометр; 5 – водяной холодильник; 6 - подача охлаждающей воды; 7 – слив воды; 8 – колба-приёмник; 9 – патрубок; 10 – аллонж. В некоторых случаях смесь двух жидкостей при определенном их соотношении перегоняется подобно индивидуальному веществу (азеотропная смесь) при постоянной температуре (таблица 1). Таблица 1 - Азеотропные смеси
Собирают установку для перегонки, как показано на рисунке 6, наливают в круглодонную колбу перегоняемую смесь жидкостей, выданную преподавателем, и кипятильные камешки. Физические свойства перегоняемых отдельных жидкостей приведены в таблице 2. Жидкость должна занимать 2/3 объёма колбы во избежание переброса жидкости в колбу-приемник при кипении. Объём налитой в колбу жидкости фиксируют и записывают в лабораторную тетрадь (таблица 3). Таблица 2 - Характеристика разделяемых жидкостей
Колбу закрывают пробкой со вставленным в нее термометром. Верхняя часть ртутного столбика термометра должна находиться на 0,5 см ниже отводного отверстия насадки Вюрца. Холодильник подключают к водопроводу и начинают нагревать перегонную колбу. При этом следят за равномерностью кипения, за показаниями термометра и поступлением отгона в колбу-приёмник. Отмечают и записывают температуру, при которой в приёмник попадает первая капля жидкости. Скорость перегонки должна составлять примерно 1 – 2 капли/с. Температура паров отгоняемой жидкости должна оставаться постоянной. Как только жидкость перестаёт поступать в колбу-приёмник, и температура начинает повышаться, заменяют колбу-приёмник на новую. Объём отогнанной жидкости фиксируют и записывают в таблицу 3. Последовательно меняя приёмники, собирают все фракции. Объёмы жидкостей записывают. Отогнанные жидкости используют в следующем опыте. По результатам опыта и данным таблицы 2 определяют отогнанные вещества и состав исходной смеси. Объёмную долю каждого вещества в составе смеси определяют по формуле: где V и Vсмеси – объёмы каждой отогнанной жидкости и смеси жидкостей, соответственно. Таблица 3 - Результаты опыта.
|
