Орг. Химия. Орг. химия. Лаборат. практ. 2018. Мифи (дити нияу мифи) Органическая химия Лабораторный практикум для студентов специальности 18. 05. 02 Составитель С. В. Павутницкая Димитровград 2018 г
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
|
Часть высушенной смолы помещают в металлическую ложечку и осторожно нагревают над пламенем спиртовки. При этом смола должна пузыриться в результате испарения остатков воды и исходных веществ. При продолжении нагревания она должна отвердевать в виде пористой массы. При дальнейшем нагревании образовавшийся полимер размягчаться не способен и может только обугливаться. Техника безопасности Обнаружение запаха уксусного альдегида проводить осторожно, направляя струю воздуха от пробирки к лицу движениями ладони. Нагревание щелочных растворов проводить осторожно, следя за направлением устья пробирки. Фенол обжигает кожу, оставляя на ней белые пятна. При работе соблюдать осторожность, не допускать попадания фенола на кожу. При работе с серной кислотой соблюдать правила работы с кислотами. 3.12 Карбоновые кислоты Карбоновые кислоты содержат карбоксильную группу – С = О \О–Н За счет индукционного и мезомерного эффектов сильно поляризована связь О←Н карбоксильной группы, что облегчает отрыв водорода в виде протона и обусловливает кислотные свойства. Карбоновые кислоты являются значительно более слабыми по сравнению с неорганическими. В свою очередь сила кислот зависит от их строения. Так, уксусная кислота слабее муравьиной. Объясняется это тем, что в уксусной кислоте появляется эффект сверхсопряжения, направленный в сторону карбоксильной группы. В результате полярность связи О←Н уменьшается. А двухосновная щавелевая кислота НООС—СООН сильнее уксусной и муравьиной. Две рядом расположенные карбоксильные группы взаимно оттягивают на себя электронную плотность, увеличивая полярность связей О←Н. Характерной реакцией всех кислот является их взаимодействие с основаниями с образованием солей. Значительно поляризованы и связи С→О←Н карбоксильной группы. Так, при образовании ангидридов кислот при отщеплении воды в одной из молекул кислоты рвется связь О–Н , а в другой связь С–О . Важными производными кислот являются сложные эфиры, образующиеся при взаимодействии кислот или их ангидридов со спиртами. В свою очередь сложные эфиры легко гидролизуются с образованием исходной кислоты и спирта. Ангидриды кислот также легко гидролизуются с образованием исходных кислот. Ангидриды реагируют со спиртами, образуя сложные эфиры. Важное место занимают сложные эфиры трехатомного спирта глицерина и высших жирных кислот (триглицериды) – жиры. Важнейшей реакцией, широко используемой на практике, является гидролиз жиров в присутствии щелочи (омыление). Продуктами гидролиза являются глицерин и смесь солей жирных кислот, представляющую собой мыло. Методика проведения опытов Опыт 1. Сравнение степени ионизации кислот В пробирки наливают по 1-2 мл 0,5 н. растворов кислот, указанных в таблице 2. Чистой стеклянной палочкой на универсальную индикаторную бумагу наносят по капле растворов данных кислот. Стеклянную палочку после нанесения предыдущей кислоты следует промыть и стряхнуть с нее капли воды. Сравнивают окраску пятна на универсальной индикаторной бумаге со шкалой рН в каждом случае и записывают значения рН в таблицу 8. В пробирки внести по грануле цинка и наблюдать за происходящими явлениями. По активности выделения газа можно также сделать вывод о силе кислот. Сравнить наблюдения со значениями рН. Написать уравнения реакций взаимодействия кислот с цинком в ионной и молекулярной формах. Таблица 8 - Степень ионизации кислот
В выводе кислоты следует расположить в ряд по увеличению их силы и дать объяснение, исходя из их строения. Опыт 2. Реакция кислот с хлоридом железа (III) В две пробирки вносят по 5 капель 3%-ных растворов уксусной и лимонной кислот, 1 каплю фенолфталеина и нейтрализуют кислоту, добавляя по каплям 3%-ный раствор гидроксида натрия до появления слаборозового окрашивания. Затем добавляют несколько капель 0,5н хлорида железа (III). Растворы окрашиваются от образующейся железной соли кислоты (ацетата или цитрата железа). Подогревают раствор до кипения. Происходит гидролиз соли, в результате которого должен выпасть красно-бурый осадок. Опыт 3. Окисляемость карбоновых кислот В отдельные пробирки помещают по 0,1 г муравьиной, уксусной, щавелевой кислот и приливают по 2 мл воды. К каждому из полученных растворов приливают по 1 мл разбавленной серной кислоты и раствор перманганата калия по каплям. Различие в ходе окисления обнаруживается по изменению окраски раствора сразу же или спустя несколько минут. Опыт 4. Разложение щавелевой кислоты Около 1 – 2 г щавелевой кислоты нагревают в пробирке с газоотводной трубкой, оттянутый конец которой опущен в другую пробирку, содержащую 1 – 2 мл известковой (или баритовой) воды. Когда начнется непрерывное выделение пузырьков газа, образующего в известковой воде осадок, трубку вынимают из жидкости и поджигают у её отверстия выделяющийся газ. Содержащаяся в нем окись углерода сгорает характерным голубым пламенем. Опыт 5. Разложение лимонной кислоты В пробирку с газоотводной трубкой помещают 1 г лимонной кислоты и приливают 2 мл концентрированной серной кислоты. Пробирку закрепляют наклонно в лапке штатива. Готовят еще две пробирки: в одну из них (А) наливают 2 – 3 мл прозрачной известковой (или баритовой) воды, в другую (Б) —такое же количество раствора йода с добавлением нескольких капель раствора щелочи до почти полного обесцвечивания раствора йода. Осторожно нагревают пламенем спиртовки смесь лимонной и серной кислот. Масса начинает пениться; при приближении к отверстию отводной трубки спиртовки выделяющиеся летучие продукты загораются голубым пламенем, характерным для окиси углерода. Не прекращая нагревания, погружают газоотводную трубку сначала в пробирку А, где образуются муть и осадок углекислой соли, а затем в пробирку Б, и наблюдают образование йодоформа при комнатной температуре. Техника безопасности Соблюдать правила работы с кислотами. При нагревании растворов в пробирках отверстие пробирки необходимо направлять в сторону от себя и окружающих во избежание выброса веществ из пробирки. Ароматические карбоновые кислоты Ароматическими карбоновыми кислотами называют производные бензола, содержащие карбоксильные группы, непосредственно связанные с атомами углерода бензольного ядра. Кислоты, содержащие карбоксильные группы в боковой цепи, называются жирноароматическими. Ароматические кислоты – бесцветные кристаллические вещества с температурами плавления выше 1000С и кипят и плавятся при более высоких температурах, чем кислоты жирного ряда с тем же количеством атомов С. Ароматические кислоты плохо растворяются в холодной воде, являются слабыми кислотами, проявляют химические свойства, характерные карбоновым кислотам. Замещенные кислоты, имеющие в бензольном ядре нитрогрупы, атомы галогенов или гидроксильные группы, обычно более ионизированы, особенно, если атом галогена или гидроксильная группа находится в о-положении к карбоксильной группе: Водородная связь 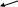 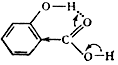 Благодаря образованию водородной связи между водородом гидроксильной группы и карбонильным кислородом карбоксильной группы увеличивается положительный заряд карбоксильного углерода и ионизация кислоты резко возрастает. Карбоксильная группа мало влияет на подвижность атомов водорода в ароматическом ядре. Введение же электрондонорных заместитетей в бензольное ядро ароматических кислот резко повышает активность атомов водорода и такие кислоты легко вступают в реакции электрофильного замещения (галогенирования, нитрования). Методика выполнения опытов Опыт 1. Сравнение степени ионизации бензойной и салициловой кислот Обе исследуемые кислоты предварительно следует растереть в ступке в тонкий порошок. Готовят в пробирках растворы бикарбоната, ацетата и формиата натрия, встряхивая несколько минут 1 г соли с 5 мл воды. Бикарбонат натрия мало растворим в воде и остается частично в осадке; обе другие соли растворяются полностью. Каждый из полученных прозрачных растворов делят на две части: к одной из них добавляют немного бензойной кислоты, к другой части – примерно такое же количество салициловой кислоты. Встряхивая смеси, отмечают, в каком из растворов солей растворяется кислота. Одновременно убеждаются, что в равном объеме чистой воды такое же количество данной кислоты не растворяется. Наблюдения и выводы о силе кислоты записывают в таблицу 9. Таблица 9 – Результаты опыта
Степень ионизации малорастворимой кислоты ориентировочно можно оценить вытеснением ею из соли другой кислоты, которая является более слабой и степень ионизации которой известна (таблица 10). Признаком вытеснения является растворение исследуемой кислоты в растворе соли другой кислоты. Таблица 10 - Степень ионизации кислот
Опыт 2. Взаимодействие ароматических кислот с хлоридом железа (III) Готовят насыщенные водные растворы бензойной и салициловой кислот, встряхивая небольшие количества каждой из них с 7 – 8 мл воды. Полученные прозрачные растворы сливают с осадков и используют их для данного опыта, а также для следующих опытов. К 1 – 2 мл водного раствора каждой из исследуемых кислот добавляют несколько капель раствора хлорида железа. В одной из пробирок появляется интенсивное фиолетовое окрашивание жидкости. В эту пробирку приливают равный объем спирта и наблюдают, исчезла ли окраска. Цветная реакция с раствором хлорида железа (III) характерна для многих соединений, имеющих в молекуле фенольную гидроксильную группу. Из трех изомерных оксибензойных кислот м-изомер не дает этой реакции. О-Оксибензойная (салициловая) и п-оксибензойная кислоты дают окрашивание с хлоридом железа, исчезающее при добавлении сильных минеральных кислот или щелочей. Однако спирт, глицерин и уксусная кислота не уничтожают это окрашивание (в отличие от фенолята железа). Бензойная кислота не образует цветных комплексных соединений с солями железа. Опыт 3. Взаимодействие ароматических кислот с бромом А. В отдельные пробирки наливают по 1 – 2 мл водных растворов бензойной и салициловой кислот, добавляют по каплям бромную воду и отмечают, заметны ли изменения. Б. В пробирку с раствором салициловой кислоты продолжают добавлять бромную воду при встряхивании до появления неисчезающей ярко-желтой окраски раствора и перехода белого осадка в желтоватый. Полученную смесь кипятят 2 – 3 мин для удаления избытка брома, при этом осадок растворяется. Охладив пробирку, добавляют 0,5 мл бензола и встряхивают. Желтый осадок, снова выпавший при охлаждении, растворяется в бензоле. Затем приливают несколько капель 1%-ного водного раствора иодида калия; при встряхивании бензольный слой окрашивается выделяющимся йодом в красно-фиолетовый цвет. Опыт 4. Окисляемость ароматических кислот В отдельные пробирки наливают по 1 – 2 мл водных растворов бензойной и салициловой кислот и добавляют равный объем раствора карбоната натрия, а затем раствор перманганата калия по каплям при встряхивании до прекращения изменения окраски смеси. Отмечают различие хода реакции для исследуемых кислот. Подобно фенолам, салициловая кислота легко окисляется перманганатом калия в щелочной среде с образованием сложной смеси продуктов. Опыт 5. Нитрование салициловой кислоты Опыт следует проводить в вытяжном шкафу. К небольшому количеству (0,05 – 0,1 г) салициловой кислоты добавляют 1 мл концентрированной азотной кислоты. Смесь встряхивают и слегка нагревают. Начинается энергичная реакция, сопровождающаяся разогреванием и выделением окислов азота. Кристаллы салициловой кислоты растворяются, и на дне реакционной пробирки собирается осадок нитросалициловой кислоты в виде желтого порошка. А. Через 5 – 6 мин встряхивают смесь, отливают несколько капель ее в другую пробирку и разбавляют в 6 – 10 раз водой. Образовавшийся желтый раствор делят на две части. К одной части добавляют избыток разбавленного раствора щелочи до перехода светло-желтой окраски раствора в оранжевую. К другой части приливают столько раствора щелочи, чтобы не произошло изменения окраски, и затем 2 – 3 капли раствора хлорида железа (III), При этом жидкость приобретает ярко-красную окраску. Б. К оставшейся после проведенного опыта А смеси нитросалициловой и азотной кислот добавляют еще 1 мл концентрированной азотной кислоты и кипятят содержимое пробирки на пламени спиртовки в течение нескольких минут. Осадок нитросалициловой кислоты быстро исчезает. Полученный прозрачный раствор выливают в пятикратный объем холодной воды, снова нагревают до образования прозрачного раствора (если выпадает осадок) и оставляют медленно охлаждаться. Через несколько минут из жидкости выделяются красивые игольчатые кристаллы тринитрофенола. В пробе полученного раствора тринитрофенола реакцией с FeCl3 обнаруживают присутствие еще оставшейся нитросалициловой кислоты. Опыт 6. Отношение ароматических кислот к нагреванию Небольшие количества салициловой и бензойной кислот нагревают в сухих пробирках до расплавления и начала кипения. Продолжая кипячение, нагревают в пламени спиртовки не только дно пробирки, но и стенки ее выше уровня жидкости, чтобы пары кипящей кислоты проходили через нагретую зону. Кислоты частично возгоняются; в одной из пробирок появляется ясный характерный запах, сохраняющийся и после охлаждения пробирки. Легкость распада кислот ароматического ряда при нагревании определяется наличием и положением заместителей в бензольном ядре. Техника безопасности Соблюдать правила работы с кислотами. При нагревании растворах в пробирках отверстие пробирки необходимо направлять в сторону от себя и окружающих во избежание выброса веществ из пробирки. Работу с бромом следует проводить в вытяжном шкафу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
