Орг. Химия. Орг. химия. Лаборат. практ. 2018. Мифи (дити нияу мифи) Органическая химия Лабораторный практикум для студентов специальности 18. 05. 02 Составитель С. В. Павутницкая Димитровград 2018 г
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
|
Опыт 1. Взаимодействие ароматических углеводородов с азотной кислотой. Работу проводят параллельно с тремя углеводородами: бензолом, толуолом и ксилолом. Опыт следует проводить в вытяжном шкафу. В три пробирки помещают по 2 мл концентрированной азотной кислоты, добавляют в них соответственно по 5—7 капель одного из углеводородов и сильно встряхивают. Жидкости во всех пробирках образуют нестойкую, быстро расслаивающуюся эмульсию. Продолжая часто встряхивать, нагревают смеси почти до кипения. Отмечают различие хода процесса в разных пробирках. Эмульсии во всех случаях постепенно становятся все более стойкими. После 5—10 мин нагревания со встряхиванием охлаждают пробирки и приливают в каждую по 6—7 мл холодной воды. Отмечают характерный запах продуктов реакции. В двух пробирках выделяются продукты реакции в виде тяжелого окрашенного масла. Концентрированная азотная кислота нитрует ароматические углеводороды. Для ароматических мононитросоединений характерен своеобразный запах миндаля. Опыт 2. Получение нитробензола. Готовят нитрующую смесь, для чего в широкой пробирке или в маленькой колбочке смешивают 1,5 мл концентрированной азотной кислоты и 2 мл концентрированной серной кислоты и охлаждают в воде разогревшуюся смесь кислот. В полученную смесь добавляют по каплям 1 мл бензола при сильном, но осторожном встряхивании и охлаждении в воде. Наблюдается значительное разогревание. Постоянно встряхивая пробирку, заставляют отделяющийся верхний слой вновь эмульгироваться в нижнем. Через 3—5 мин реакционную смесь выливают в стаканчик с 20—30 мл воды, встряхивают ее и дают отстояться. Нитробензол выделяется в виде тяжелого желтоватого масла, мутного от капелек воды. Опыт 3. Получение динитробензола. Работу следует проводить в вытяжном шкафу. Готовят нитрующую смесь того же состава, что и в предыдущем опыте, из 1,5 мл азотной кислоты и 2 мл серной кислоты. В пробирку со смесью кислот, не ожидая ее охлаждения, добавляют около 1 мл нитробензола и нагревают 15 мин на кипящей водяной бане при частом сильном встряхивании для эмульгирования верхнего слоя. Затем охлаждают реакционную смесь и выливают ее в четырехкратный объем холодной воды. Динитробензол выделяется в виде тяжелого масла, которое быстро закристаллизовывается. В водном слое также вскоре появляются кристаллы динитробензола, окрашенные примесями в желтый цвет. Кристаллы отсасывают, промывают на фильтре водой и отжимают досуха в фильтровальной бумаге. Чистый динитробензол, перекристаллизованный из этилового спирта, бесцветен. Опыт 4. Нитрование толуола. А. Для введения в бензольное ядро толуола одной нитрогруппы готовят нитрующую смесь из 1,5 мл концентрированной азотной кислоты и 2 мл концентрированной серной кислоты и вводят в нее по каплям 1 мл толуола при хорошем охлаждении и встряхивании реакционной смеси. Все дальнейшие операции проводят так же, как при нитровании бензола (см. опыт 2). Маслянистый продукт нитрования толуола, выделяющийся после выливания реакционной смеси в воду, является смесью изомерных нитротолуолов. Б. Для введения второй нитрогруппы снова готовят нитрующую смесь из тех же объемов серной и азотной кислот, и добавляют к ней полученную в опыте А смесь нитротолуолов. Все дальнейшие операции проводят так же, как при получении динитробензола (см. опыт 3). Гомологи бензола обычно нитруются легче, чем бензол. Опыт 5. Получение нитронафталина К 2 мл концентрированной азотной кислоты добавляют 0,5 г порошка нафталина. При встряхивании смесь начинает желтеть уже при комнатной температуре. Нагревают смесь на кипящей водяной бане 5 мин при частом встряхивании и затем выливают в четырехкратный объем холодной воды. Нитронафталин выделяется в виде оранжевого масла, быстро твердеющего при встряхивании. Выход почти теоретический. Продукт можно очистить кристаллизацией из смеси спирта и воды. Нитрование нафталина идет значительно легче, чем нитрование бензола или толуола, поэтому вместо нитрующей смеси можно применять для этой цели одну лишь азотную кислоту. Продуктом реакции в условиях опыта является преимущественно α-нитронафталин (tпл.=610С). Опыт 6. Получение анилина. В маленькую круглодонную колбочку помещают 10 г железных опилок, 4 мл воды и около 0,3 мл концентрированной соляной кислоты. Колбу закрывают пробкой с изогнутой отводной трубкой, направляя её конец вверх. Нагревают смесь на пламени горелки до кипения и кипятят 1—2 мин. При этом наблюдается выделение водорода. Затем добавляют 1 мл нитробензола, снова закрывают колбочку пробкой с трубкой и встряхивают смесь, сначала осторожно, потом сильно. Нагревают смесь снова до кипения и поддерживают его 2 мин, после чего помещают колбочку на 10—15 мин в кипящую водяную баню, продолжая часто и сильно встряхивать смесь. После введения нитробензола выделение пузырьков водорода почти прекращается. Наблюдается превращение части железа в красно-коричневую окись железа (II и III). После нагревания смеси, когда запах нитробензола совершенно исчезнет, вынимают колбочку из бани, вытирают ее снаружи насухо и к горячей реакционной смеси добавляют при встряхивании 8—10 капель разбавленного раствора щелочи (до резко щелочной реакции) и 2 мл воды. Укрепляют колбочку наклонно в лапке штатива, снова присоединяют отводную трубку и опускают её конец в пробирку-приемник, охлаждаемую холодной водой (рисунок 11). Начинают отгонку, осторожно нагревая пламенем горелки сначала верхние слои реакционной смеси. В приемник быстро переходит 3 мл мутной смеси анилина и воды, после чего прекращают отгонку и разбирают прибор. Через некоторое время из отгона выделяется желтоватый маслянистый слой анилина. Для очистки анилин отделяют пипеткой, сушат кусочком твердой едкой щелочи и перегоняют. А 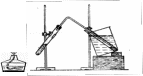 Рисунок 11 - Прибор для отгонки нилин образует соль с присутствующей в реакционной смеси соляной кислотой, поэтому для выделения анилина необходимо добавлять щелочь. В опыте анилин получается мутным, так как содержит капли эмульгированной в нем воды. Для связывания эмульгированной и растворенной в анилине воды применяют обычно твердый едкий натр. Чистый анилин представляет собой бесцветную, буреющую на воздухе жидкость с характерным запахом, малорастворимую в воде. Техника безопасности Работы с нитробензолом проводить только в вытяжном шкафу! Длительное вдыхание паров нитробензола и динитробензола, а также всасывание этих веществ через кожу может вызвать головную боль. При попадании нитробензола на кожу следует сразу же хорошо обмыть ее водой с мылом, а затем несколько раз протереть спиртом. 3.17 Амины Атом азота аминогруппы имеет свободную неподелённую электронную пару. За счет этой пары он может взаимодействовать с протоном, образуя положительно заряженный ион замещенного аммония. Вновь образованная связь является донорно-акцепторной. Амин при этом проявляет свойства оснований. Это происходит уже при растворении аминов в воде. Такой раствор имеет щелочную реакцию: .. R–NH2 + НОН → [R–NH3]+ОН ̄ Это свойство наиболее характерно проявляется в образовании солей при взаимодействии аминов с кислотами: .. R–NH2 + HNO3 → [R–NH3]+ NО3̄ Качественной реакцией на первичные, вторичные и третичные амины является реакция с азотистой кислотой. Первичные амины образуют неустойчивые соли диазония, которые разлагаются с образованием спиртов и выделением в виде пузырьков азота: +HNO2 R–CH2–NH2 → [R–CH2–N ≡ N]+ → R–CH2–OH + N2 ↑ - H2O Вторичные амины при действии азотистой кислоты превращаются в N-нитрозоамины R2N–N=O, представляющие собой масла, окрашенные в желто-оранжевые цвета. Третичные амины дают с азотистой кислотой нестойкие соли, легко разлагающиеся водой с образованием гаммы продуктов. Анилин, как все амины, является основанием. Однако влияние непосредственно связанного с аминогруппой ароматического ядра проявляется в резком ослаблении основных свойств ароматических аминов по сравнению со свойствами аминов жирного ряда. Анилин образует с минеральными кислотами устойчивые кристаллические соли. Большинство солей анилина хорошо растворимо в воде. Введение аминогруппы в ароматическое ядро резко повышает подвижность атомов водорода при атомах углерода бензольного ядра. Поэтому анилин очень легко бромируется даже в разбавленном водном растворе. Аминокислоты содержат в молекуле одновременно карбоксильные и ами-ногруппы. Свойства аминокислот поэтому обусловлены их амфотерностью (проявление кислотных и основных свойств) и аналогичны тем, которые проявляют амины и карбоновые кислоты. Особенностями их можно назвать возможность взаимодействия карбоксильных и аминогрупп. Это свойство проявляется уже при растворении аминокислот в воде. Такие растворы показывают среду, близкую к нейтральной, в результате образования внутренних солей (биполярных ионов): H2N–R–COOH ↔ H3N+–R–COO ̄ С ионами тяжелых металлов аминокислоты образуют внутрикомплексные хелатные соединения: O .. // NH2 O – C  CH2 Cu CH2 .. C – O NH2 \\ O С атомами азота медь образует донорно-акцепторные связи. Методика проведения опытов Опыт 1. Определение характера среды растворов аминов и аминокислот На универсальную индикаторную бумагу наносят по одной капле растворы 1,6-диаминогексана (гексаметилендиамина H2N-(CH2)6-NH2), аминоуксусной кислоты (глицина, гликокола) и уксусной кислоты. Записывают значения рН. В выводах необходимо написать уравнения диссоциации соединений и объяснить полученные результаты. Опыт 2. Реакции мочевины с азотной и азотистой кислотами А. В пробирку помещают кристаллическую мочевину (карбамид H2NCONH2) объемом с горошину и добавляют по каплям при встряхивании воду до образования концентрированного раствора. К полученному раствору добавляют 5 капель концентрированной азотной кислоты и встряхивают. В зависимости от концентрации мочевины сразу или через несколько секунд должно начаться выделение кристаллов нитрата мочевины, который относительно трудно растворим. При оформлении схемы реакции следует учесть, что основные свойства азота амидной группы в мочевине выражены гораздо слабее, чем у аминогрупп первичных аминов, поэтому мочевина образует соль только с одной молекулой азотной кислоты. Б. Реакция с азотистой кислотой используется для обнаружения первичных аминогрупп, поскольку сопровождается выделением азота. Азотистая кислота очень неустойчива, поэтому обычно получается в процессе опыта при взаимодействии соли азотистой кислоты с какой-либо сильной кислотой. В пробирку с кристаллами, полученными в первой части опыта, добавляют несколько капель раствора нитрита натрия. При встряхивании должно начаться выделение пузырьков газа (азота и диоксида углерода). В реакции с выделением азота аминогруппы замещаются на гидроксильные - образуется угольная кислота, распадающаяся на углекислый газ и воду. Опыт 3. Взаимодействие аминов с ангидридами кислот В пробирку вносят 0,5 мл раствора 1,6-диаминогексана и добавляют 20 капель уксусного ангидрида. Смесь осторожно нагревают на пламени спиртовки в течение 2-3 минут. После охлаждения пробирки добавляют в нее 1-1,5 мл воды. При образовании амида должны выделиться кристаллы. Опыт 4. Образование и разложение соли анилина Взбалтывают 6—8 капель анилина с 2—3 мл воды и полученную эмульсию делят на две части. К одной части эмульсии добавляют по каплям, при встряхивании, концентрированную соляную кислоту до получения однородного раствора, после чего к нему приливают 2 капли раствора фенолфталеина, а затем по каплям разбавленный раствор щелочи. Помутнение жидкости вследствие выделения капель анилина наблюдается задолго до появления щелочной реакции по фенолфталеину. К другой части исходной водной эмульсии анилина добавляют по каплям разбавленную серную кислоту. Наблюдают образование кристаллического осадка. Опыт 5. Бромирование анилина К 10 мл воды добавляют 1 – 2 капли анилина и встряхивают до полного растворения анилина. Полученный сильно разбавленный раствор анилина называют анилиновой водой. Полученный раствор используется в опытах 5 и 6. К 1 мл анилиновой воды добавляют по каплям бромную воду. Наблюдают за изменением окраски раствора и выпадением осадка. Опыт 6. Окисление анилина К 1 мл анилиновой воды добавляют 2—3 капли насыщенного раствора бихромата калия и 0,5 мл разбавленной серной кислоты. Жидкость окрашивается в интенсивный темно-зеленый цвет, переходящий в синий, а затем в черный. Опыт 7. Образование медной соли аминоуксусной кислоты В пробирку помещают порошок оксида меди (II) высотой 0,5 см, 0,5 мл раствора аминоуксусной кислоты и нагревают на пламени спиртовки. Дав отстояться избытку черного порошка оксида меди, обращают внимание на образование темно-синего раствора медной соли аминоуксусной кислоты. К отстоявшемуся раствору добавляют 1-2 капли 2н раствора гидроксида натрия. Выпадения осадка гидроксида меди, как это наблюдается с обычными солями меди, не должно происходить. Опыт 8. Конденсация анилина с формальдегидом В пробирку внесите 1 каплю анилина и 10 капель воды, взболтайте и добавьте несколько капель формалина. Образование мономера происходит по схеме: С6Н5–NH2 + O=CH2 → C6H5–N=CH2 + H2O Реакция полимеризации протекает очень быстро. Полимер выпадает в осадок. Техника безопасности Соблюдать правила работы с концентрированными кислотами. Работу с бромом, формальдегидом проводить в вытяжном шкафу. |
