Орг. Химия. Орг. химия. Лаборат. практ. 2018. Мифи (дити нияу мифи) Органическая химия Лабораторный практикум для студентов специальности 18. 05. 02 Составитель С. В. Павутницкая Димитровград 2018 г
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
|
| Вещество | Формула | Поведение при нагревании | Горючесть паров | Цвет пламени | Выделение паров воды | Остаток | рН |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
Опыт 2. Открытие углерода и водорода
В сухую пробирку помещают небольшое количество ( 3 мм по высоте пробирки) сахарозы, добавляют пятикратное по объему количество порошка оксида меди и перемешивают с помощью стеклянной палочки. Пробирку закрывают пробкой с П-образной газоотводной трубкой. Конец трубки вводят в другую пробирку с 2 – 3 мл прозрачной баритовой или известковой воды. Смесь нагревают на пламени спиртовки сначала осторожно, затем сильнее и наблюдают за изменениями в нагреваемой пробирке и пробирке-приемнике.
Опыт 3. Открытие азота
В сухую пробирку помещают несколько кристаллов мочевины CO(NH2)2. Туда же бросают небольшой кусочек металлического натрия.
Пробирку осторожно нагревают на пламени спиртовки до расплавления смеси. При этом иногда наблюдается небольшая вспышка, чего желательно избегать. Нагревают, пока не получится однородный сплав. Окончание сплавления нужно проводить на более сильном пламени газовой или бензиновой горелки. Когда пробирка остынет, добавляют в нее 10 капель этилового спирта для уничтожения остатков натрия. После прекращения шипения за счет выделения газа добавляют 0,5 мл воды и нагревают пробирку до растворения сплава. Вносят в пробирку 2 – 3 капли раствора сульфата железа (II). Одну каплю мутной жидкости из пробирки наносят на фильтровальную бумагу. Как только капля впитается, на ее место наносят 1 каплю 2н соляной кислоты. О наличии азота в исследуемом соединении судят по появлению синего пятна.
Опыт 4. Открытие серы
В сухую пробирку помещают небольшое количество сульфаниловой кислоты (HO3S-С6Н4-NH2) и кусочек металлического натрия. Затем пробирку нагревают для сплавления вещества с натрием, добавляют спирт, воду и кипятят, как описано в опыте 3.
При сплавлении с натрием вещество обугливается, поэтому раствор получается черным от присутствия частиц угля. Каплю полученной жидкости наносят на фильтровальную бумагу. Частицы угля адсорбируются в центре пятна, а раствор образует концентрический бесцветный "вытек". На границу "вытека" наносят каплю раствора ацетата свинца. При наличии в исследуемом соединении серы должна появиться темно-коричневая окраска.
Опыт 5. Открытие хлора
В пробирку вносят 2 капли хлороформа (СНСl3), примерно 15 капель этилового спирта и кусочек металлического натрия. После того, как прекращается выделение водорода, для растворения осадка добавляют примерно 10 капель воды, затем 10 капель концентрированной азотной кислоты и 2 – 3 капли азотнокислого серебра. При наличии в исследуемом соединении хлора должен выпасть осадок белого цвета.
Опыт 6. Открытие галогенов пробой Бейльштейна
Медную проволочку, загнутую на одном конце петлей, прокаливают в пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди, окунают в вещество или в его раствор. Смоченную веществом петлю осторожно вносят в край пламени. При наличии в веществе галогенов появляется характерная ярко-зеленая окраска пламени вследствие образования летучего соединения меди с галогенами.
Техника безопасности.
Металлический натрий брать только пинцетом и предохранять от контакта с водой.
Концентрированную азотную кислоту добавлять по каплям и во избежание ожога соблюдать осторожность.
3.4 Алифатические углеводороды. Получение и химические свойства
Предельные углеводороды содержат только простые σ-связи С–С и С–Н. Связи прочные, поэтому предельные углеводороды являются химически инертными соединениями. Они способны вступать в реакции только в жестких условиях (нагревание, катализ).
Несмотря на то, что энергия связей С–Н (в среднем 415 кДж/моль) больше, чем для связей С–С (в среднем 335 кДж/моль), в первую очередь рвутся именно связи С–Н. Объясняется это тем, что они находятся на «поверхности» молекулы и более доступны для реагентов, а связи С–С - "внутри" молекулы. Таким образом, основным типом реакций являются реакции замещения атомов водорода. Причем легче всего замещаются атомы водорода у третичного атома углерода, затем у вторичного и труднее всего у первичного.
Наиболее типичными являются реакции галогенирования и нитрования.
Одним из методов получения алкенов является отщепление воды от спир-
тов (дегидратация). Реакция протекает в присутствии концентрированной сер-
ной кислоты, являющейся водоотнимающим средством. Реакция идет в две
стадии:
R-CH2-OH + HO-SO3H → R-CН2-ОSО3Н + Н2О
R-CН2-ОSО3Н → HOSO3H + ...
Основные химические свойства алкенов обусловлены наличием в молекуле двойной связи. Энергия π-связи в ней значительно меньше энергии σ-связи. Следовательно, основным типом реакций являются реакции присоединения, сопровождающиеся разрывом π-связи. Типичными реакциями являются рассматриваемые в работе реакции галогенирования и окисления. При галогенировании образуются дигалогенопроизводные. При окислении этилена в условиях опыта образуется двухатомный спирт этандиол-1,2.
Одним из методов получения ацетилена является реакция взаимодействия карбида кальция СаС2 с водой.
Алкины имеют в своем составе тройную связь, состоящую из σ- и двух π-связей. Поэтому для них характерны те же реакции, что и для алкенов. Реакции присоединения протекают ступенчато с последовательным разрывом обеих π-связей. В результате при действии избытка галогена образуются тетрагалогенопроизводные. При окислении ацетилена в условиях опыта образуется щавелевая кислота, которая затем окисляется до оксида углерода (IV).
Для ненасыщенных соединений характерны реакции полимеризации за счёт разрыва π-связей, протекающие по радикальному или ионному механизмам.
Одним из наиболее широко используемых на практике является метод полимеризации алкенов по радикальному механизму с внесением в систему инициатора. В качестве инициаторов используются органические и неорганические соединения, имеющие неустойчивые связи и разрывающиеся при нагревании с образованием свободных радикалов - частиц, имеющих на одном из атомов неспаренный электрон, обозначаемый точкой. Такая частица является неустойчивой и старается образовать связь, разрывая π-связи у ненасыщенных соединений, присутствующих в системе, превращая их в свободные радикалы.
Реакция образования полимера протекает по цепному механизму и состоит из трех стадий (актов):
а) инициирование: t0
распад инициатора R – R → 2 R●
инициатор свободные радикалы
Инициирование заключается в присоединении свободных радикалов, образующихся при распаде инициатора, к молекулам мономера с разрывом π-связи и образованием новых свободных радикалов:
R● + CH2 = CH → R – CH2 – CH●
\Х \Х
мономер свободный радикал мономера
б) рост цепи: + CH2=CH-Х
R–CH2–CH● + CH2=CH → R–CH2–CH–CH2–CH● →
\Х \Х \Х \Х
+ nCH2=CH-Х
→ R–CH2–CH–CH2–CH–CH2–CH● → R–CH2–CH–(CH2–CH)n–CH2–CH●
\Х \Х \Х \Х \Х \Х
Макрорадикалы
в) обрыв цепи:
Обрыв цепи заключается в исчезновении активной частицы.
- рекомбинация растущих макрорадикалов
СН2 – СН● + ●СН – СН2 → СН2 – СН – СН – СН2
\Х \Х \Х \Х
макрорадикалы макромолекула полимера
- реакция диспропорционирования
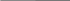
 ↓
↓СН2 – СН● + ●СН – СН2 → CН2 – СН2 + СН = СН
\Х \Х \Х \Х
макрорадикалы молекулы полимеров
Наряду с реакциями обрыва цепи могут протекать реакции передачи цепи на полимер или мономер, в результате которых макрорадикал насыщается, но образуется новый свободный радикал, способный вызвать дальнейший рост
цепи.
Методика проведения опытов
Опыт 1. Отношение предельных углеводородов к бромной воде
В опыте используется бензин, предварительно освобожденный от непредельных соединений и являющийся смесью предельных углеводородов.
В пробирку помещают 1 мл бензина и 0,5 мл бромной воды. Содержимое пробирки энергично встряхивают до образования эмульсии и наблюдают за изменением цвета бромной воды. Затем пробирку нагревают на водяной бане, периодически встряхивая. При протекании реакции должно происходить обесцвечивание бромной воды.
Смесь сливают в емкость с отходами органических соединений.
При написании реакции в качестве модельного углеводорода использовать 2-метилпентан.
Опыт 2. Отношение предельных углеводородов к окислителям
В пробирку помещают I мл бензина и 0,5 мл перманганата калия. Пробирку энергично встряхивают до образования эмульсии и наблюдают, что происходит.
Смесь сливают в емкость с отходами органических соединений.
Опыт 3. Получение этилена
В пробирку помещают 1 мл этилового спирта и осторожно, при взбалтывании, приливают небольшими порциями 2 мл концентрированной серной кислоты. В разогревшуюся смесь бросают кипятильный камешек (кусочек фарфора) для обеспечения равномерного кипения при последующем нагревании. Пробирку закрывают пробкой с П-образной газоотводной трубкой, готовят две пробирки с растворами для опыта 4, который проводят одновременно с опытом 3. Пробирку начинают медленно и осторожно нагревать. Реакционная смесь при этом чернеет. Этилен, выходящий из газоотводной трубки, используется в опыте 4.
Остатки смеси сливают в емкость с отходами кислот.
Опыт 4. Свойства этилена
а) Бромирование
В пробирку помещают 2 мл бромной воды, вводят газоотводную трубку с выделяющимся этиленом (опыт 3) и наблюдают, что происходит при пробулькивании этилена через бромную воду.
б) Окисление
В пробирку помещают 2 мл раствора перманганата калия, вводят газоотводную трубку с выделяющимся этиленом и наблюдают изменения.
в) Горение
Выделяющийся в опыте 3 этилен поджигают, поднося пламя спички к концу газоотводной трубки, и наблюдают за характером горения.
Опыт 5. Получение и свойства ацетилена
Получение ацетилена и исследование его свойств проводятся одновременно. Готовят две пробирки, одну с 2 мл бромной воды, другую – с 2 мл раствора перманганата калия. В третью пробирку наливают 2 – 3 мл воды, бросают туда же кусочек величиной с горошину карбида кальция, закрывают пробкой с газоотводной трубкой и сразу пропускают выделяющийся ацетилен в бромную воду, а затем в раствор перманганата калия. Наблюдают за происходящими изменениями. В конце опыта выделяющийся ацетилен поджигают.
Опыт 6. Радикальная полимеризация винилбензола (стирола).
1 мл стирола заливают в чистую сухую пробирку и вносят 0,2 г инициатора пероксида бензоила. Пробирку встряхивают до полного растворения инициатора, закрывают пробкой со стеклянной трубкой, выполняющей роль обратного холодильника, и помещают в кипящую водяную баню. Замечают время и наблюдают за изменением вязкости системы, периодически вынимая пробирку из бани. Конец полимеризации фиксируют, когда система полностью теряет текучесть. Полимер можно извлечь, завернув пробирку в ткань и разбив ее осторожными ударами молотка.
Техника безопасности.
Следует помнить, что бензин относится к легколетучим и легковоспламеняющимся жидкостям. При нагревании смеси нужно соблюдать осторожность.
При работе с концентрированной серной кислотой соблюдать правила работы с кислотами. Кислоту к спирту приливать небольшими порциями с перемешиванием. Не забывать помещать в пробирку кипятильный камешек. Особую осторожность соблюдать при нагревании смеси, не допуская переброса жидкости из пробирки-приемника в пробирку с реакционной смесью.
