Орг. Химия. Орг. химия. Лаборат. практ. 2018. Мифи (дити нияу мифи) Органическая химия Лабораторный практикум для студентов специальности 18. 05. 02 Составитель С. В. Павутницкая Димитровград 2018 г
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
|
3.18 Диазосоединения Получение солей диазония, одной из форм диазосоединений, называется реакцией диазотирования. Эта_реакция характерна только для первичных ароматических аминов и заключается в действии азотистой кислоты на первичный амин в кислой среде: Ar–NH2 + HNO2 + НСl → [Аr–N≡N ]+Cl ̄ + 2Н2O Азотистая кислота в свободном состоянии не существует, поэтому действуют обычно нитритом натрия, а кислоты прибавляют достаточно для вытеснения НNO2 из NaNO2, образования соли диазония и сохранения кислой среды, т. е. 2,5 - 3 эквивалента по отношению к амину. Реакция диазотирования проводится при низкой температуре (от 0 до 50С), иначе легко происходит разложение азотистой кислоты и неустойчивой при обычной температуре соли диазония. Реакции солей диазония делят на два типа: с выделением азота (образование фенолов, галогенпроизводных, нитрилов, металлорганических соединений и т. д.); без выделения азота (образование азокрасителей). Практически особую важность имеет последняя реакция, так как значительная часть синтезируемых в настоящее время красителей принадлежит к азокрасителям. Азокрасители образуются в результате реакции азосочетания - действия диазокатиона на фенолы и ароматические амины. Диазокатион, являясь слабым электрофильным реагентом, замещает атом водорода только в активном п-положении ароматического кольца:  [C6H5 –N≡N]Cl + H– –OH → –N=N– –OH + HCl Методика выполнения опытов Опыт 1. Диазотирование анилина Помещают в небольшую колбочку 1 мл анилина, 7-8 мл воды и 2,5 мл концентрированной соляной кислоты, тщательно охлаждают смесь до 0-10С водой со снегом или со льдом и по каплям при встряхивании добавляют 1 мл 30%-ного нитрита натрия. Необходимо следить за тем, чтобы температура раствора не поднималась выше 5-70С, для чего добавляют кусочки льда в пробирку. После прибавления всего NaNO2 наносят каплю раствора на йод-крахмальную бумагу. Посинение или почернение бумаги говорит о наличии некоторого избытка НNO2. При отрицательной реакции на иод-крахмальную бумагу добавляют еще несколько капель NaNO2 и после перемешивания через 1—2 мин снова делают пробу на иодкрахмальную бумагу. Добавляют нитрит натрия до посинения иодкрахмальной бумаги и постоянно охлаждают раствор соли фенилдиазония. Полученный раствор используют по частям в опытах 2, 3 и 4. Опыт 2. Разложение соли фенилдиазония при нагревании 2 мл раствора соли фенилдиазония, полученного в предыдущем опыте, в пробирке слегка нагревают над пламенем горелки. Немедленно начинается бурное выделение пузырьков газа — азота, которое продолжается далее и без нагревания. По окончании реакции закрывают пробирку пробкой с газоотводной трубкой, свободный конец которой опускают в пустую пробирку-приёмник. Нагревают раствор на пламени горелки, держа рукой пробирку-приёмник так, чтобы пробирка с раствором находилась почти в горизонтальном положении. Образовавшийся при разложении соли фенилдиазония свободный фенол перегоняется с водяным паром в пробирку-приёмник. Достаточно перегнать хотя бы 1 каплю жидкости. Нужно следить, чтобы жидкость не перебросило. Фенол можно обнаружить по характерному запаху. Опыт 3. Образование азокрасителя Для образования азокрасителя к 1 капле N,N-диметиланилина С6Н5N(СН3)2 прибавляют несколько капель воды и по каплям концентрированную соляную кислоту до образования прозрачного раствора, охлаждают льдом, прибавляют к этому раствору часть раствора соли фенилдиазония и энергично встряхивают. При добавлении раствора СН3СООNa выпадает желто-оранжевый осадок основания красителя — фенилазо-N,N-диметиланилин, или п-диметиламиноазобензол. Опыт 4. Изменение цвета азокрасителя в зависимости от реакции среды К части полученной в опыте 3 эмульсии диметиламиноазобензола добавляют 2—3 капли 2 н. НС1. Образуется сравнительно легко растворимая в воде и окрашенная в красный цвет соль диметиламиноазобензола, причем раствор просветляется и принимает ярко-красную окраску. Одну каплю полученного концентрированного раствора переносят в новую пробирку и доливают водой доверху. Отливают половину разбавленного слабо-красного раствора соли в чистую пробирку и добавляют к ней 1 каплю 2 н. NaОН. Наблюдают изменение окраски раствора. При добавлении 1 капли 2 н. НС1 раствор вновь окрашивается в красный цвет:  + HCl + HCl–N=N– –N(CH3)2 → –NH–N= =N+(CH3)2 Cl- ← щелочная среда + NaOH кислая среда Опыт 5. Восстановление азокрасителя водородом Помещают в пробирку 1 каплю разбавленного раствора диметиламиноазобензола, полученного в опыте 3, добавляют 2 капли воды, кусочек металлического цинка и 1 каплю концентрированной соляной кислоты. Начинается выделение водорода, который восстанавливает краситель. Наблюдают изменение окраски раствора. Если реакция замедляется, подогревают раствор. В случае необходимости добавляют еще 1 каплю концентрированной соляной кислоты. При восстановлении красителя происходит разрушение хромофорной группы -N=N- по месту двойной связи между атомами азота и образование двух молекул аминов – анилина и п-диметиламиноанилина. Опыт 6. Получение азокрасителя β-нафтолового оранжевого Каплю раствора сульфаниловой кислоты NaO3S-C6H4-NH2 в щелочи (0,2 г кислоты в 1 мл 2н NaOH) наносят на фильтровальную бумагу. На полученное пятно помещают каплю 10%-ного раствора нитрита натрия NaNO2, каплю 2н НС1 и каплю раствора β-нафтола в 2н растворе NaOH. Наблюдают за происходящими изменениями и записывают наблюдения. Синтез красителя проходит в две стадии: 1 стадия - реакция диазотирования сульфанилата натрия: NaO3S-C6H4-NH2 + NaNO2 + 2HCl → [NaO3S-C6Н4-N≡N]Cl + 2H2O + NaCl 2 стадия – реакция азосочетания с образованием красителя β-нафтолоранжа:  + H N = N – –SO3Na [NaO3S– –N≡N]Cl + –ONa → –OH + NaCl хлористый сульфанилдиазоний β-нафтолят натрия β-нафтолоранж Техника безопасности Соблюдать правила работы с концентрированными кислотами. При приливании реактивов нельзя наклонятся над отверстием сосуда во избежание попадания брызг на лицо и одежду. 3.19 Белки Белки являются природными полимерами, основные цепи которых построены из остатков α-аминокислот. Их можно представить как продукты поликонденсации α-аминокислот, протекающей при взаимодействии карбоксильных и аминогрупп с выделением воды. В цепи образуются амидные группировки – С – NH –, которые в белках называют пептидными. \\ О Характерной реакцией белков является их гидролиз по пептидным группам. В результате полного гидролиза образуется смесь α-аминокислот. Белки являются коллоидными амфотерными электролитами. H2N – R - СООН ↔ H3N+- R - СОО- ( кислая среда) + Н+ + ОН- (щелочная среда) Н3N+-R – СООН Н2N –R– СОО-  В большинстве случаев константа диссоциации белка как кислоты несколько превышает константу диссоциации того же белка как основания; поэтому частица чистого белка в водном растворе обычно заряжена отрицательно. При потере частицами заряда коллоидный раствор белка оказывается наименее устойчивым и особенно легко коагулирует, т. е. свертывается. Свертывание белков - выпадение их в осадок при кипячении растворов - характерно для большинства представителей этого класса соединений. Наиболее легко происходит свертывание в слабокислой среде, вблизи от изоэлектрической точки, хуже в нейтральной среде, а в щелочной среде обычно совсем не наблюдается. Добавление нейтральных солей (сульфат натрия, хлорид натрия и др.) облегчает и ускоряет свертывание белков при кипячении; наоборот, введение сахаров, многоатомных спиртов, многих альдегидов, кетонов, аминов защищает белки от свертывания. Осаждение белка в результате свертывания необратимо, и полученные осадки уже нерастворимы ни в воде, ни в растворах солей. Свертывание белка при кипячении обусловлено способностью крупных белковых молекул изменять структуру - денатурироваться - при 80 – 1000С. Белки образуют с фенолом и формальдегидом малорастворимые продукты конденсации; реакция протекает с участием имеющихся в молекуле белка свободных аминогрупп. Фенол быстро осаждает белок из раствора, при этом раствор мутнеет или образуются хлопья или сгустки. Формалин «дубит» белок, уплотняя его консистенцию и сильно снижая растворимость в воде и способность к набуханию. В обоих случаях происходит денатурация белка. Соли тяжелых металлов уже в очень малых концентрациях в растворе осаждают белки, образуя с ними нерастворимые в воде солеобразные соединения. Поэтому белки являются противоядием при отравлениях солями многих тяжелых металлов, например, ртути. Осаждение белков солями тяжелых металлов необратимо. Однако некоторые из таких осадков, в частности, полученные в условиях описанного опыта, растворяются в избытке осадителя — раствора соли меди, свинца или серебра - в результате пептизации осадка адсорбирующимися на его частицах ионами. Методика проведения опытов Опыт 1. Качественные реакции белков А. Биуретовая реакция белков. К 1 мл раствора яичного белка добавляют 1 мл концентрированного раствора гидроксида натрия и затем каплю (не больше!) раствора сульфата меди. Наблюдают изменение окраски смеси. Смесь сливают в емкость с отходами щелочей. Биуретовая реакция является важнейшей качественной реакцией на белки, обнаруживая наличие в молекуле пептидных групп. Схемы реакций ввиду их сложности можно не приводить. Б. Ксантопротеиновая реакция белков. Наливают в пробирку 1 мл раствора яичного белка, добавляют 0,2 - 0,3 мл концентрированной азотной кислоты. Нагревают смесь до кипения и кипятят 1 - 2 минуты. Затем охлаждают смесь и осторожно, по каплям добавляют избыток (1 – 2 мл) концентрированного раствора щелочи. Опыт 2. Отношение белков к кислотам и щелочам К 2—3 мл раствора белка добавляют по каплям при встряхивании концентрированную уксусную кислоту. Наблюдается выпадение белка в осадок в виде мути или хлопьев. При дальнейшем добавлении кислоты осадок белка снова растворяется. А. Полученный кислый раствор делят на две части. Одну из них нагревают до кипения. В отличие от исходного раствора свертывания белка не наблюдается. При введении в горячую кислую жидкость 1 - 2 капли раствора сульфата аммония белок свертывается. Б. К другой части кислого раствора белка осторожно добавляют по каплям при встряхивании разбавленный раствор щелочи. При постепенной нейтрализации кислоты образуется осадок белка, снова растворяющийся в избытке щелочи. Добавив еще 1 - 2 мл раствора щелочи, нагревают полученную жидкость до кипения. При этом белок не свертывается. Если раствор белка не слишком разбавлен, то при кипячении с избытком щелочи обнаруживается отщепление аммиака и сероводорода. Опыт 3. Кислотные свойства белка Готовят 10 мл очень разбавленного раствора фуксина в воде. Он должен быть интенсивно окрашен, но вполне прозрачен. Добавляют к нему 1 мл концентрированного раствора аммиака. Через 5 - 7 мин раствор фуксина должен почти полностью обесцветиться. Приготовленный раствор фуксина разливают в две пробирки. В одну из них приливают 2 - 3 капли концентрированного раствора NаОН. Затем вносят в обе пробирки по небольшому комочку белой шерсти. Через несколько минут шерсть в бесцветной жидкости, не содержащей NаОН, должна окраситься в интенсивный сине-фиолетовый цвет, в другой пробирке шерсть должна остаться неокрашенной. Яркая окраска растворов фуксина обусловлена присутствием в них соли фуксина с кислотой. Щелочи, в том числе раствор аммиака, обесцвечивают эти растворы, выделяя из них почти бесцветное псевдооснование фуксина: H2N-Ar OH \ / H2N-Ar –C–Ar–NH2 В условиях опыта белковые волокна шерсти, реагируя с псевдооснованием, окрашиваются, хотя раствор остается бесцветным. Следовательно, на волокне за счет карбоксильных групп белка образуется солеобразное соединение его с основанием фуксина. При большом разбавлении раствора красителя слабоионизированный раствор аммиака не мешает образованию этой соли. Наоборот, сильноионизированная щелочь препятствует образованию соли фуксина с белком. Опыт 4. Денатурация белков А. Свёртывание белков при нагревании. В пробирку наливают 2—3 мл раствора белка и нагревают его в пламени горелки до кипения 0,5—1 мин. Затем слегка охлаждают жидкость, делят ее на две части и добавляют к одной из них 1-2 капли концентрированной уксусной кислоты, а к другой – 1-2 капли раствора сульфата аммония. Снова нагревают обе смеси до начала кипения; при этом в обеих пробирках количество свернувшегося белка заметно увеличивается. Б. Денатурация белка фенолом. К 1—2 мл раствора яичного белка или желатина добавляют по каплям насыщенный раствор фенола и отмечают наблюдаемые изменения. В. Денатурация белка спиртом. К 1—2 мл раствора яичного белка по каплям этиловый спирт отмечают наблюдаемые изменения Г. Денатурация белка формалином. В пробирку наливают 1 —1,5 мл формалина и равный объем воды. Встряхнув полученный раствор, помещают в него полоску сухого желатина так, чтобы лишь нижняя ее половина была погружена в жидкость. Через 15—20 мин сливают жидкость, а оставшуюся в пробирке полоску желатина полностью заливают горячей водой. Отмечают различие характера набухания и растворения верхней и нижней частей полоски. Д. Осаждение белков солями тяжёлых металлов Помещают в две пробирки по 1 —1,5 мл исследуемого раствора белка и добавляют в одну из них насыщенный раствор сульфата меди, а в другую — 20%-ный раствор ацетата свинца. Реактив в обоих случаях вводят медленно, по каплям, при встряхивании. Первоначально образуется хлопьевидный осадок или раствор мутнеет вследствие выделения малорастворимого соединения белка с солями металлов. При дальнейшем добавлении реактива осадок снова растворяется. Опыт 5. Гидролиз и расщепление белков действием щелочи Небольшой комочек шерсти помещают в пробирку и заливают 2 мл концентрированного раствора гидроксида натрия. Смесь осторожно нагревают в пламени спиртовки до растворения шерсти. К полученному горячему раствору добавляют 1 мл раствора уксуснокислого свинца, нагревают пробирку и следят за происходящими изменениями. Смесь сливают в емкость с отходами щелочей. В отчете необходимо привести схему гидролиза белка в общем виде и реакцию обнаружения серы. Реакция на наличие серы является качественной реакцией на кератин шерсти, содержащий цистиновые связи. В щелочной среде происходит их разрушение: Цистиновая связь 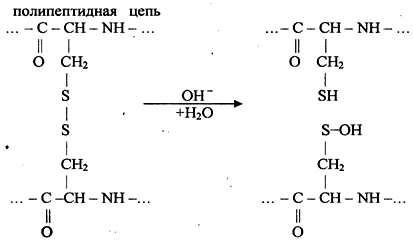 Образующаяся сульфеновая кислота не устойчива в щелочной среде и распадается с выделением сероводорода:  …−CO−CH−NH−… …−CO−CH−NH−… + H2S …−CO−CH−NH−… …−CO−CH−NH−… + H2S| | CH2–S–OH CHO В продуктах разложения шерсти в щелочной среде сера присутствует в виде сульфида натрия. Техника безопасности При проведении опытов соблюдать правила работы с концентрированными растворами кислот и щелочей. Работу с формальдегидом проводить в вытяжном шкафу. Фенол обжигает кожу, оставляя на ней белые пятна. При работе соблюдать осторожность, не допускать попадания фенола на кожу. 3.20 Углеводы Моносахариды - полифункциональные соединения со смешанными функциями. Их химические свойства определяются наличием в молекуле карбонильной группы, спиртовых гидроксильных групп и полуацетального гидроксида. В альдозах присутствует альдегидная группа, а в кетозах - кетонная группа. Альдегидная группа в отличие от кетонной легко окисляется и эта реакция используется для доказательства наличия в сахарах альдегидной группы. Благодаря наличию рядом расположенных гидроксильных групп сахара, подобно другим многоатомным спиртам, реагируют с гидроксидом меди (II) с образованием хелатного соединения. Дисахариды построены из остатков двух моносахаридов, связанных кислородным мостиком. Они делятся на восстанавливающие и невосстанавли-вающие. Восстановительными свойствами обладают дисахариды, в которых в одном из остатков моносахаридов при образовании кислородного мостика сохраняется гликозидный гидроксил, способный изомеризоваться в альдегидную группу. Если кислородный мостик образован с участием обоих гликозидных гидроксилов, дисахарид является невосстанавливающим, например, сахароза. Дисахариды легко гидролизуются. Гидролиз протекает по кислородному мостику, в результате чего образуются моносахариды, из которых построен дисахарид. |
