Орг. Химия. Орг. химия. Лаборат. практ. 2018. Мифи (дити нияу мифи) Органическая химия Лабораторный практикум для студентов специальности 18. 05. 02 Составитель С. В. Павутницкая Димитровград 2018 г
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
|
Опыт 3. Определение относительной плотности жидкостей. Относительная плотность – одна из важнейших физико-химических характеристик веществ. Относительную плотность d вещества обычно определяют по отношению к плотности дистиллированной воды (при 40С). Так как величина плотности зависит от температуры, её определяют при 20 или 15 0С. Относительную плотность определяют при помощи пикнометров, ареометров, денсиметров (рисунок 7). 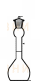   а б в Рисунок 7 - Определение относительной плотности. а – пикнометр; б – ареометр; в – ареометр с термометром и правило измерения плотности. Жидкости из предыдущего опыта налить в мерные цилиндры и с помощью ареометров измерить их плотность. Если объёмы жидкостей невелики, то используют пикнометры. Чистый и сухой пикнометр взвешивают на аналитических весах, а затем заполняют до метки исследуемой жидкостью и снова взвешивают. Результаты записывают в таблицы 3 и 4. Таблица 4 - Относительная плотность жидкостей.
Относительная плотность рассчитывается по формуле: где m, m1, m2 – массы пустого, с жидкостью, с водой пикнометра, соответственно,г О 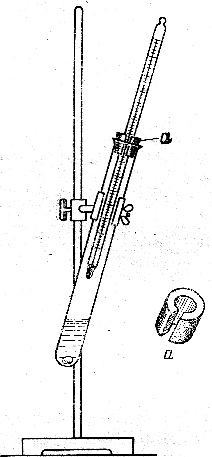 пыт 4. Определение температуры кипения пыт 4. Определение температуры кипенияТемпературу кипения можно определить в процессе перегонки, как это было указано в опыте 2. Если же вещества немного, и его не нужно чистить перегонкой, то температуру кипения можно определить в пробирке с термометром (рисунок 8). Помещают в пробирку 1 – 3 мл вещества и кипятильный камешек, вставляют термометр на корковой пробке с вырезом против его шкалы. Термометр устанавливают так, чтобы его резервуар был выше уровня жидкости на 4 – 5 см и не касался стенок пробирки. Рисунок 8 - Установка для определения температуры кипения: а – пробка с вырезом Пробирку осторожно нагревают до равномерного кипения. Пары жидкости охлаждаются и конденсируются на термометре и стенках пробирки. Когда столбик термометра перестанет подниматься, записывают показания термометра. Температура кипения является константой вещества. При сравнении определенной температуры со справочной следует помнить, что ее значение зависит от атмосферного давления, поэтому необходимо зафиксировать его и внести поправочный коэффициент. Опыт 5. Экстракция (извлечение). Для экстракции в лабораторных условиях пользуются делительными воронками (рисунок 9). Водный раствор вещества, которое нужно выделить, заливают в делительную коническую или цилиндрическую воронку и добавляют туда же подобранный растворитель, не смешивающийся с водой (эфир, бензол, толуол, хлороформ и др.).   Рисунок 9 - Установка для экстракции 1 – делительная воронка цилиндрическая; 2 – штатив; 3 – лапка; 4 – стакан для сбора отфильтрованной жидкости. Закрывают воронку пробкой и встряхивают до образования эмульсии. При использовании легколетучего растворителя (например, эфира) воронку периодически переворачивают краном вверх и, придерживая одной рукой пробку, открывают кран для выпуска паров растворителя. После встряхивания в течение нескольких минут воронку закрепляют с помощью лапки 3 в штативе 2 до четкого разделения слоев. Вынув пробку, медленно сливают через кран водный слой в стакан 4, а затем в другой сосуд – слой растворителя. Водный слой снова заливают в воронку, добавляют свежую порцию растворителя, и операцию повторяют. Для более полного извлечения вещества целесообразно брать небольшие порции растворителя, но повторять операцию несколько раз. Для экстракции использовать водный раствор гидрохинона, полученный растворением 2 г гидрохинона в 40 см3 воды. Для полного растворения вещества раствор подогревают и затем охлаждают и переливают в делительную воронку объёмом 100 – 150 см3. В качестве органического растворителя используют диэтиловый эфир (10 – 20 см3). После экстрагирования гидрохинона из водного раствора эфирную вытяжку переливают в сухой стакан или чашку и осторожно выпаривают (вдали от огня!) досуха в вытяжном шкафу Опыт 6. Определение температуры плавления органического вещества. Температуру плавления органического кристаллического вещества можно определить, используя прибор, изображенный на рисунке 10. Исследуемое вещество тщательно растирают в ступке или на часовом стекле и помещают в тонкий капилляр, запаянный с одного конца. Открытым концом капилляра набирают в него немного вещества и бросают его запаянным концом вниз в стеклянную трубку длиной 80 – 90 см, поставленную вертикально на лабораторный стол. Эту операцию наполнения повторяют несколько раз до получения в капилляре хорошо уплотненного столбика вещества высотой около 2 мм.  Рисунок 10 - Прибор для определения температуры плавления (а): 1 – круглодонная колба; 2 – пробирка; 3 – термометр; 4 – капилляр. б – крепление на термометре капилляра с веществом. а б Заполненный капилляр закрепляют на термометре так, чтобы проба вещества находилась на уровне шарика термометра (рисунок 10б). Для прикрепления капилляра к термометру обычно применяют резиновое колечко. Температуру плавления возгоняющихся веществ определяют в капиллярах, заполненных с обоих концов. Капилляр 4 вместе с термометром 3 помещают в пробирку 2, вставленную в круглодонную колбу 1, заполненную нагревательной жидкостью. В качестве нагревательной жидкости используют воду, если известно, что температура плавления исследуемого вещества ниже 1000С, или концентрированную серную кислоту, которая дает возможность определять температуру плавления до 2500С. При длительном пользовании серная кислота темнеет; для обесцвечивания вносят в нее кристаллик селитры. Определение температуры плавления в приборах с серной кислотой требует осторожности, так как в случае поломки прибора, горячая серная кислота представляет опасность. Поэтому при работе с серной кислотой в качестве обогреваемой жидкости следует надевать защитные очки. Кроме воды и серной кислоты, в качестве теплопередающей среды употребляют парафиновое (температура разложения 220°С) или силиконовое масло. Собранный прибор помещают в колбонагреватель и начинают медленно нагревать, внимательно следя за повышением температуры и состоянием столбика вещества в капилляре. Наблюдая за веществом в капилляре, отмечают все его изменения — перемену окраски, разложение, слипание, спекание, намокание и т. п. Когда исследуемое вещество начинает заметно сжиматься и мокнуть, нагревание прекращают. Началом плавления считают появление первой капли в капилляре, а окончанием – исчезновение последних кристалликов вещества. Опыт 7. Определение молекулярной массы вещества. Молекулярная масса – одна из самых главных характеристик вещества. Она лежит в основе определения таких величин, как молярные концентрации, объем, теплоемкость, электропроводность, теплота реакции и т. д. Молекулярная масса используется для установления строения вещества, применяется во всех расчетах по химическим формулам и уравнениям. Существует много различных методов, дающих возможность определять молекулярные массы веществ органических соединений любого класса. Наибольшее распространение получили криоскопический, эбулиоскопический методы и метод Раста. М 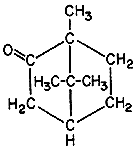 етод Раста позволяет определять молекулярную массу органических соединений в приборе для определения температуры плавления. Этот метод применим для веществ, растворимых в расплавленной камфоре и устойчивых до 190° С. етод Раста позволяет определять молекулярную массу органических соединений в приборе для определения температуры плавления. Этот метод применим для веществ, растворимых в расплавленной камфоре и устойчивых до 190° С. Камфора (1,7,7-триметилбицикло-[2,2,1]-гептанон-2) C10H16O Молярная масса 154,25 г\моль Плотность 0,990 г/см3 Температура плавления 179,75 0С Метод состоит в определении понижения температуры плавления камфоры при растворении в ней определенного количества исследуемого вещества. Для определения молекулярной массы требуется всего 1 – 5 мг вещества; точность определения 5 – 10%. В небольшую чистую, сухую пробирку помещают 60 – 70 мг нафталина и около 0,7 – 0,8 г камфоры. Осторожно, на маленьком пламени, нагревают пробирку для сплавления этих веществ. Затем удаляют из пламени пробирку, перемешивают полученный расплав проволочкой, сплющенной на конце. После того как расплав затвердевает, извлекают большую его часть той же проволочкой на часовое стекло. Массу растирают и набивают ею капилляр (рисунок 10б). В другой такой же капилляр набирают пробу чистой камфоры. Оба капилляра крепят при помощи резинового кольца к термометру. Затем начинают медленно нагревать прибор, внимательно наблюдая за состоянием проб через лупу, и в момент плавления последних кристаллов смеси камфоры с нафталином записывают температуру, принимая ее за температуру плавления смеси. Продолжая нагревание, определяют температуру плавления чистой камфоры в другом капилляре. Молекулярную массу исследуемого вещества (в данном случае нафталина) рассчитывают по формуле: где m1 – навеска исследуемого вещества; m2 – навеска камфоры; t1 – температура плавления чистой камфоры; t2 – температура плавления смеси; 40 – криоскопическая константа. 3.3 Качественный элементный анализ органических соединений Качественный анализ на содержание определенных элементов в составе соединения вместе с другими характеристиками (температуры кипения и плавления, показатель преломления и др.) часто позволяет достаточно точно идентифицировать вещество. В данной работе использованы наиболее простые, доступные и быстрые методы открытия некоторых, наиболее часто встречающихся в органических соединениях элементов. Органические соединения, не содержащие металлов, при нагревании обычно улетучиваются или разлагаются (обугливаются), но затем при прокаливании сгорают нацело. Сильно коптящее пламя горящих паров вещества указывает на высокое содержание углерода, т. е. позволяет предполагать наличие кратных связей, бензольных колец или длинных углеродных цепей. Образование паров воды обнаруживает наличие водорода в молекуле вещества. При сильном прокаливании солеобразных органических соединений, содержащих металлы (соли кислот, феноляты и т. п.), образуются нелетучие карбонаты щелочных металлов (К, Na) либо оксиды щелочноземельных металлов (Са, Ва, Mg). Все эти продукты прокаливания дают с водой щелочную реакцию и полностью растворяются в соляной кислоте. Наличие нерастворимого в ней остатка указывает на присутствие в испытуемом веществе тяжелых металлов. Открытие углерода и водорода. Суть метода состоит в том, что при прокаливании вещества с оксидом меди (II) углерод и водород окисляются, а медь восстанавливается: (С...Н...) + 3СuО → СО2 + Н2О + 3Сu Образование воды можно наблюдать по появлению ее капель на холодных стенках пробирки и трубки при проведении опыта, а образование углекислого газа - по образованию осадка при пропускании образующихся газов через баритовую или известковую воду (растворы гидроксидов бария или кальция): СО2 + Ва(ОН)2 → ... Открытие азота. Суть метода состоит в том, что при сплавлении вещества, содержащего азот, с металлическим натрием образуется цианид натрия: (C...N...) + Na → NaCN После добавления к плаву этанола и воды получается щелочная среда. Затем добавляется раствор сульфата железа (II), обычно содержащего примесь сульфата железа (III). В присутствии щелочи немедленно образуется грязно-зеленый осадок гидроксида железа (II) в смеси с желтым осадком гидроксида железа (III). При наличии в растворе избытка цианида натрия образуется желтая кровяная соль: Fe (OН)2 + 6 NaCN → Na4[Fe(CN)6] + 2 NaOH После подкисления осадки гидроксидов железа (II) и (III) растворяются и при наличии азота появляется синее пятно образовавшейся берлинской лазури (гексациано-(II)феррата железа (III)): Fe (ОН)3 + 3 НС1 → FeCl3 + 3 H2O 3 Na4[Fe(CN)6] + 4 FeCl3 → Fe4[Fe(CN)6]3 + 12 NaCl Открытие серы. Суть метода состоит в том, что при сплавлении натрий отщепляет от вещества серу: (...S) + Na → Na2S После кипячения с водой, нанесения раствора на фильтровальную бумагу и добавления к "вытеку" капли раствора ацетата свинца должно появляться темно-коричневое окрашивание за счет образования нерастворимого сульфида свинца: Na2S + РЬ(СН3СОО)2 → ... | |||||||||||||||||||||||||||
