Объект изучения микробиологии
 Скачать 6.2 Mb. Скачать 6.2 Mb.
|
|
129. санитарно-показательные микробы почвы и их определение Основные характеристики санитарно-показательных микроорганизмов. СПМ должен постоянно обитать в организме чселовека или животных и постоянно выделяться во внешнюю среду. СПМ не должен размножаться на объектах окружающей среды. Длительность выживания СПМ во внешней среде должна соответствовать длительности выживания патогенных микроорганизмов. Методы идентификации и дифференциации СПМ должны быть просты и удобны. Для выявления общей микробной обсемененности определяют общее микробное число (ОМЧ) путем подсчета всех микроорганизмов (растущих на питательных средах) в 1г или 1мл субстрата. Количество СПМ выражают в титрах и индексах. Санитарная оценка почвы по микробиологическим показателям. При санитарной оценке почвы учитывают результаты химического, микркобиологического и гельминтологического исследований. -Микробиологическое исследование проводят для санитарной оценки почвы,. Характеристики процессов самоочищения, оценки методов обезвреживания отбросов, при определении пригодности участков для строительства, а также при эпидемиологических и эпизоотологических обследованиях с целью выяснения путей заражения почвы, продолжительности выживания в ней патогенных микробов и т.д. В зависимости от поставленной задачи применяют краткий или полный санитарно-бактериологический анализ почвы. -Краткий санитарно-микробиологический анализ предусматривает определение общего микробного числа(ОМЧ), титров бактерий группы кишечной палочки (БГКП), энтерококков, перфингенс-титра(наименьшее количество почвы, в котором обнаруживается Clostridium perfringens), термофильных , бактерий, нитрифицирующих бактерий. Полученные результаты указывают на наличие и степень фекального загрязнения. Краткий анализ почвы осуществляется при проведении текущего санитарного надзора за состоянием почвы. Полный санитарно-микробиологический анализ включает определение всех показателей краткого анализа, а также общей численности сапрофитов. ОМЧ и процентного содержания споровых микроорганизмов, аэробных бактерий, разрушающей клетчатку, бактерий-аммонификаторов. Исследуют токсичность почв для микроорганизмов. Полный анализ проводят при осуществлении предупредительного санитарного надзора, первичном обследовании при выборе территории для размещении отдельных объектов. Прямое обнаружение патогенных микробов в почве проводят только при расследовании вспышек инфекционных заболеваний. В качестве косвенных показателей возможного загрязнения почвы патогенными бактериями используют санитарно-показательные микроорганизмы: бактерии группы кишечной палочки, Cl. Perfingens, бактерии рода Proteus, термофильные бактерии. Наличие в почве бактерий группы кишечной палочки свидетельствует о ее фекальном загрязнении. В загрязненных участках почвы коли-титр составляет 1*10^4, тогда как в чистых почвах коли-титр может быть равен 1 и выше. Обнаружение Cl. Perfingens в почве также указывает на ее фекальное загрязнение. Методы опредения состава и активности микроорганизмов почвы. Почвенная биота – это совокупность живых организмов, населяющих почву. В их число входят: бактерии, грибы, актиномицеты, водоросли, микроскопические животные, а так же лишайники и зеленая растительность, имеющая в почвах свою корневую зону. Обычно, чем плодороднее почва, тем больше в ней содержится живых организмов, и тем разнообразнее они по видовому составу. Биологическую активность почвы определяют следующими способами: - подсчетом общего количества почвенных микроорганизмов - определением количества отдельных физиологических групп , например микроорганизмов нитрифицирующих и целлюзоразлагающих бактерий. Появление нитрифицирующих бактерий указывает на развитие процесса самоочищения, так как они завершают цикл разложения азотосодержащих соединений, превращая аммиак в азот. При свежем фекальном загрязнении нитрификаторов не будет, поскольку субстрат для их развития отсутствует. В ходе жизнедеятельности микроорганизмов, разлагающих орг.вещества, образуется аммиак, что приводит к развитию нитрификаторов. - определение выделения из почвы диоксида углерода – биохимический способ определения биологической активности почвы. Чем интенсивнее выделение углекислого газа из почвы, тем активнее происходит в ней биологические процессы, тем лучше условия для возделывания сельскохозяйственных культур и выше их потенциальная урожайность. Отбор проб производят с квадратного участка(не менее 5*5) из 5 точек – из каждого угла и центра квадрата («метод конверта»). Образцы забирают в условиях асептики с глубины 20-30 см. объем образцов 1 кг. Периодичность контроля: не реже 1 раза в год. 130. Микрофлора почвы. Санитарно-эпидемическое значение . определение общего колличества микробов в почве. Почва является основным местом обитания микробов. Количество микробов в разных почвах варьирует. Так, унавоженная почва содержит – 5 млрд микробов, чернозем – более 4-х, глинозем – 200 млн клеток в 1г почве. Доминирующее место по количеству занимают бактерии. В пахотном слое культурной почвы на 1га может содержаться до 6 тонн микробной массы. Весной и осенью количество микроорганизмов увеличивается. Колличественный и качественный состав биоценоза зависит от влаги, содержания орг.веществ, структуры почвы, клим.условий, способа с/х обработки и т.д. С санитарной точки зрения особое значение в микрофлоре имеет слоя почвы до глубины 50-70см. в самом поверхностном слое почвы количество микроорганизмов,ограничено из-за действия солнечных лучей, высушивания. Основная масса микробов содержится на глубине 10-20 см, их количество уменьшается на глубине 4-5м, почва практически стерильна. Важнейшей группой почвенного микробиоценоза являются сапрофиты, которые играют важную роль в самоочищении почвы, участвуют в круговороте азота, углерода, серы, железа и т.д. Патогенные микроорганизмы попадают в почву с испражнениями, мочой, мокротой, слюной, с трупами и т.д. Значит, часть их, не образующая споры, рано или поздно отмирает. Однако, есть такие, для которых почва – это естеств. форма обитания (возбудители ботулизма, глубоких микозов, микотоксикозов, фитопатогенные бактерии и грибы). Роль почвы в передаче инфекции не так велика, т.к. в почве микроорганизмы встречаются с неблагоприятными для них факторами: недостаток пит.субстратов, антаганизм почвенных сапрофитов, высыхание, действие солнечного света и т.д. В основном длительно сохраняются спорообразующие аэробные(возб. сиб.язвы) и анаэробные(возб. Столбняка, газ. Гангрены) бактерии. Сроки их выживания – 25 лет, но и неспорообраз. Могут сохранятся до нескольких месяцев. Для характеристики в почве общего микробного загрязнения используют определение численности микроорганизмов, преимущественно бактерий, растущих на мясо-пептонном агаре при 37°С. При этом производят посев почвенных разведений 1,5% мясо-пептонный агар. Из каждой пробы почвы должно быть использовано для посева не менее двух различных разведений в зависимосте от степени педполагаемого загрязнения исследуемой почвы. Перед посевом каждое разведение тщательно перемешивают стерильной пипеткой , после чего берут 1мл суспензии и переносят на дно стерильной чашки. Из каждого разведения посев производят минимум на 2 параллельные чашки. После в каждую чашку вливают предварительно расплавленный и остуженный до 45°С пит.агар в количестве 15-20мл. чашки петри с раплавленным агаром хорошо перемешивают с имеющейся там почвенной суспензией, осторожно наклоняя чашки во все стороны. Затем чашки помещают на строго горизонтальную поверхность до затвердевания среды. На чашке должна быть сделана надпись с указанием номера и названия пробы и разведения. После застывания агара чашки с посевом помещают в термостат в перевернутом виде (крышкой вниз) при 37°С на 24 часа. После инкубации подсчитывают выросшие колонии и проводят пересчет на 1г абсолютно сухой почвы. 131. понятие о санитарно – показательных микроорганизмов. Санитарно-показательные микроорганизмы являются постоянными обитателями поверхностей и полостей человеческого или животного организма. Обнаружение и в объектах внешней среды свидетельствует о загрязнение выделениями человека или животного. Чем обильнее такое загрязнение, тем больше возможность попадания в объект патогенных микробов. Санитарно-показательными микроорганизмами могут быть только те, которое постоянно и больших количествах содержатся в выделения человека или животного, они должны сохранять жизнеспособность во внешней среде в течении сроков, близких к срокам выживания патогенных микробов, выделяемых теми же путями , но не размножаться интенсивно во внешней среде. Они должны также легко обнаруживаться современными и довольно простыми методами исследования. Основными санитарно-показательными микроорганизмами в отношении кишечных инфекций, указывающими на фекальное загрязнение внешней среды (вода, почва), считают бактерии группы кишечных палочек (БГКП). В качестве дополнительных показателей при оценке некоторых объектов определяют наличие фекальных стрептококков(энтерококков) и клостридий К БГКП относятся не только эшерехии, но и представители родов цитробактер, энтеробактер, клебсиеллы. Для них характерны следующие признаки:короткие, грамотрицательные , неспорообразующие палочки, на среде Эндо они растут в виде темно-красных колоний с металлическим блеском или без него либо в виде розовых колоний с темным центром; сбраживают лактозу и глюкозу при 37°С в теч.24ч с образ. Кислоты и газа. Все БГКП попадают во внешнюю среду только из кишечника человека и животных. Наибольшее санитарно-показательное значение в этой группе имеет E.coli, присутствие которой, например, в питьевой воде, рассматривается как признак свежего хоз.-бытового загрязнения. Писутствие энтерококков считают дополнительным показателем фекального загрязнения воды и др. объектов. Однако их выделение требует сред более сложных при приготовлении и растут они медленнее. Энтерекокки явл. Нормальными обитателями кишечника, но выделяются во внешнюю сребу в меньших кол-х, чем кишечные палочки. К санитарно-показательным клостридиям относят группу грам+, спорообраз. анаэробных палочек, редуцирующих сульфит на сульфит-неомицинполимиксиновой среде (СПН) при инкубации в условиях 45°С в теч.12-24ч. Эта группа в основном представлена Cl.perfringens. определение санитарно-показательных клостридий рекомендуют проводить в почве и воде, используемой на предприятиях пищевой промышленности, а также при выборе новых источников водоснабжения. санитарно-показательными микробами загрязнения воздуха закртых помещений являются стафилококки, гемолитические стрептококки.чем больше количество стрептококков обнаруживают в воздушной среде, тем вероятнее возможность заражения чел-ка воздушно-капельными инфекциями. Нарастание обсемененности воздуха Staph.aureus и частое его обнаружение свидетельствует о санитарно-эпидемиологическом неблагополучии. В лечебных учреждениях вторичным источником обсеменения воздуха Staph.aureus могут быть загрязненные постельные принадлежности, белье. 132. способы повышения микробной чистоты нестерильных лекарственных средств. Пути повышения микробной чистоты нестерильных лек.средств. В зависимости от источников и путей попадания микроорганизмов в лекарственные средства возможны различные подходы к обеспечению требуемого уровня микробной чистоты нестерильных ЛС. Если микробное обсеменение вызвано попаданием вместе с сырьем, то для достижения требуемого уровня микробной чистоты достаточно очистить от микроорганизмов сырье. Если обсеменение микробами происходит в процессе изготовления, то проводят деконтаминацию готовой лекарственной формы. Предварительной деконтаминации можно достичь прессованием сыпучих материалов (при отсутствии споровых микроорганизмов, низкой влажности исходного порошка и высоком давления). На практике применяют 4 способа деконтаминации сырья и готовых ЛС. Термический способ. Широко распространенный метод промышленной деконтаминации. Не пригоден для обработки термолабильных лекарственных форм, для которых применяют прогревание до 60-70°С горячим воздухом, инфракрасное и высокочастотное излучение. Химический способ. Более пригоден для стерилизации посуды, трубопроводов и прочих изделий из полимерных материалов. Стерелизирующий агент – окись этилена или смесь окиси этилена и бромистого метила (в соотношении 1:25). Для непосредственной деконтаминации ЛС этот способ применяют ограничено. УФ-облучение. Существенным ограничением для более широкого использования метода признана его неэффективность при обработке светонепроницаемых веществ. Наиболее часто его используют для обработки упаковочного материала и технологической воды. Ионизирующее излучение обладает высокой проникающей способностью. При облучении не образуются канцерогенные, мутагенные, токсичные вещества, сохраняются физико-химические и биологические свойства обрабатываемых лекарств. Метод используют для обработки антибиотиков, витаминов, ферментов , гормонов и алколоидов. 133. бактериологическое исследование стерильных лек.средств. Инъекционные растворы, глазные капли, лек.средства для новорожденных, др. лек.препараты, стерилизуемые в процессе их изготовления, засевают неразведенными в тиогликолевую среду для определения микробной обсемененности и среду Сабуро. Посевы на тиогликолевой среде выдерживают 14 суток при 24°С. Учет результатов посевов проводят по отсутствию видимых изменений в посевах. Определение микробной обсемененности готовых лекарств. Жидкие лек. формы разводят стерильным физ.раствором 1:10 (или 1:100) и засевают в объеме 0,5мл на МПА в чашке Петри. 1г порошка или таблеток помещают в пробирку с 10мл физ.раствора и после растворения производят посев на МПА. Мягкие лек.формы (мази, пасты) в кол-ве 1г взвешивают в асептических условиях, переносят в пробирки с 10мл стерильного 1,4% раствора натрия гидрокарбоната для диспергирования, которое производят вращательным движением пробирки между ладонями в течении 2-4 мин, 0,5 мл полученного раствора засевают на МПА в чашках Петри. Далее чашки помещают в термостат на 48 часов затем подсчитывают число колоний и определяют количество бактерий в 1 мл или 1г образца 134. санитарно-микробиологическое исследование инвентаря, оборудования, рук и санитарной одежды работников аптек Санитарная одежда – мед.халат и шапочка, предназначенные для защиты медикаментов, материалов и других загрязнений, выделяемые пресоналом. Аптечную посуду, подготовленную для розлива инъекционных растворов и глазных капель, отбирают в момент приготовления их в количестве трех штук одинаковой емкости. Флаконы доставляют в лабораторию в укупоренном виде, используя при этом пробки и прокладки, для отпуска лек.средств. Исследование аптечной посуды, пробок, прокладок, воронок, цилиндров: Подготовка к исследованию: три одноименных флакона, доставленные в лабораторию, последовательно ополаскивают в 10 куб.см стерильной водопроводной воды. Воду из флакона во флакон переливают над пламенем горелки, тщательно споласкивая каждый флакон. В банки и широкогорлые колбы с доставленными пробками и прокладками наливают 10 куб.см стерильной водопроводной воды и тщательно споласкивают. 135.методы контроля микробной загрязненности растительного лек.сырья Лек. Растительное сырье может инфицироваться патогенными микробами на всех этапах заготовки (сбор, первичная обработка, сушка, измельчение, упаковка) и хранения. При хранения сырья важно соблюдение санитарного режима в аптеках. Неблагоприятное действие оказывают влажность, пыль, насекомые и др.факторы, повышающие микробное обсеменение и приводящие к порче лек.сырья. Внешними проявления микробной порчи раст.сырья являются изменение цвета и консистенции, загнивание, плесневение всего растения и или его частей. При этом резко снижается содержание или полностью исчезают фармакологические активные вещества , использование такого недоброкачественного сырья становится бесполезным или вредным. Легко портятся плоды, ягоды и корневища, богатые углеводистыми соединениями, более устойчивыми являются сухие листья, корни, кора. Состав микроорганизмов зависит от вида лек.сырья, его структуры и фармакологических свойств. Преобладают грибы, актиномицеты и спорообразующие виды бактерий. Определение микробной обсемененности раст-го лек.сырья: В асептических условиях(в стерильной чашке Петри, обожженными ножницами и пинцетом)из листа или верхнего слоя корневища вырезают кусочек площадью 1 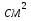 , который помещают в пробирку с 10мл стерильного физ.раствора и взбалтывают в течении 5мин. Из полученного смыва готовят 4 десятикратных разведения (1:10, 1:100, 1:1000, 1:10000), для посева в связи с с большой обсемененности раст.сырья используют два последних (1:1000, 1:10000)разведения. В стерильную чашку Петри вносят 1 мл смыва, после чего в нее наливают 15мл расплавленного и остженного до 45°С МПА, перемешивают и после застывания агара посевы инкубируют при 37°С 24-48 часов. Производят подсчет выросших колоний на поверхности и в глубине агара. Полученное число колоний следует умножить на степень разведения. , который помещают в пробирку с 10мл стерильного физ.раствора и взбалтывают в течении 5мин. Из полученного смыва готовят 4 десятикратных разведения (1:10, 1:100, 1:1000, 1:10000), для посева в связи с с большой обсемененности раст.сырья используют два последних (1:1000, 1:10000)разведения. В стерильную чашку Петри вносят 1 мл смыва, после чего в нее наливают 15мл расплавленного и остженного до 45°С МПА, перемешивают и после застывания агара посевы инкубируют при 37°С 24-48 часов. Производят подсчет выросших колоний на поверхности и в глубине агара. Полученное число колоний следует умножить на степень разведения. 136. Санитарно-микробиологическое исследование сухих веществ, используемых для приготовления лек.форм. Исследования проводят в случаях неоднократных неудовлетворительных бактериологических анализов, превышения норм предельно допустимого содержания непатогенных микроорганизмов при удовлетворительных результатах анализов дистиллированной воды используемой для их приготовления, при удовлетворительных данных бактериологического контроля посуды, флаконов, пробок, прокладок. Результаты, полученные при исследовании сухих лекарственных веществ, служат одним из оснований для выбора партии при приготовлении инъекционных растворов. Сухие лекарственные вещества разводятся стерильной дистиллированной водой с целью создания соответствующих концентраций инъекционным растворам и глазным каплям, изготовляемым в аптеках. Отбор сухих лекарственных веществ проводят стерильными ложками в стерильную посуду лаборатории в количестве 30 - 50 г. В случае, если вещество таблетированное, то отбирают фламбированным пинцетом в стерильную посуду лаборатории в количестве 30 - 50 г.
|
