Темы и лекции 1 модуля. Обычные Bacillus subtilis 0,70,8x23 Escherichia coli 0,31х16 Staphylococcus aureus 0,51,0 Thiobacillus thioparus 0,5х13 Rickettsia prowazeki 0,30,6x0,82 Мелкие
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
|
Периоды инфекционной болезни Развитие инфекционного процесса подразделяют на несколько периодов: - инкубационный; - продромальный; - разгара заболевания; - исход заболевания: реконвалесценции (выздоровления) / летальный исход / микробное носительство. Инкубационный период – это время, прошедшее с момента попадания микроорганизма в макроорганизм до появления первых клинических признаков заболевания. Этот период может быть различным по продолжительности и зависит в основном от вида возбудителя. Например, при кишечных инфекциях инкубационный период не длительный – от нескольких часов до нескольких суток. При других инфекциях (грипп, ветряная оспа, коклюш) – от нескольких недель до нескольких месяцев. Но есть и такие инфекции, при которых инкубационный период длится несколько лет: лепра, ВИЧ-инфекция, туберкулез. В этом периоде происходит адгезия клеток и, как правило, возбудители не выявляются. Продромальный период – в этот период идет колонизация возбудителя на чувствительных клетках организма. В этот период появляются первые предшественники заболевания (повышается температура, снижаются аппетит и работоспособность и др.), микроорганизмы образуют ферменты и токсины, которые приводят к местным и генерализованным воздействиям на организм. При таких заболеваниях, как брюшной тиф, оспа, корь, продромальный период очень характерен и тогда уже в этом периоде врач может поставить предварительный диагноз. В этом периоде, как правило, возбудитель не выявляется, кроме коклюша и кори. Разгар заболевания – в этот период идет интенсивное размножение возбудителя, проявление всех его свойств, максимально проявляются клинические проявления, характерные для данного возбудителя (пожелтение кожных покровов при гепатите, появление характерной сыпи при краснухе и т. д.). В этот период формируется защитная реакция макроорганизма в ответ на патогенное действие возбудителя, продолжительность этого периода также бывает различной и зависит от вида возбудителя. Например, туберкулез, бруцеллез текут долго, несколько лет – их называют хроническими инфекциями. При большинстве инфекций этот период является самым заразным. В разгар заболевания больной человек выделяет в окружающую среду очень много микробов. Период клинических проявлений заканчивается выздоровлением или смертью больного. Летальный исход может наступить при таких инфекциях, как менингит, грипп, чума и др. Степень выраженности клинического течения заболевания может быть разной. Болезнь может протекать в тяжелой или легкой форме. А иногда клиническая картина может быть вообще нетипичной для данной инфекции. Такие формы заболевания называют атипичными, или стертыми. Поставить диагноз в таком случае трудно и тогда используются микробиологические методы исследования. Исход заболевания – выздоровление (реконвалесценция), смерть, бактерио-, вирусоносительство. Реконвалесценция – постепенное угасание всех признаков проявления заболевания, восстановление структуры и функций пораженных органов и систем. В этот период может развиться бактерионосительство: в организме могут сохраняться антигены, которые длительно будут циркулировать по организму. Период выздоровления сопровождается снижением температуры, восстановлением работоспособности, повышением аппетита. В этот период из организма больного выводятся микробы (с мочой, испражнениями, мокротой). Продолжительность периода выделения микробов неодинакова при различных инфекциях. Например, при ветрянке, сибирской язве больные освобождаются от возбудителя при исчезновении клинических проявлений болезни. При других болезнях этот период продолжается 2-3 недели. После перенесённого заболевания возбудитель может «задерживаться» в организме, но уже не проявлять патогенных свойств и не вызывать развитие клинических проявлений. Такое состояние называется – бактерионосительство. Выделяют: - острое (до 3 мес.) - затяжное (до 6 мес.) - хроническое (более 6 мес.) бактерионосительство В зависимости от того размножается ли возбудитель в крови или нет различают две формы: - бактериемия (или вирусемия) - сепсис. Формы сепсиса: - септицемия(или первичный сепсис) – при этой форме сепсиса возбудитель сразу с входных ворот инфекции попадает в кровь и розмножается там. - септикопиемия (или вторичный метастатический сепсис) – эта форма развивается вследствие генерализации локального инфекционного процесса. – синдром системного воспалительного ответа (ССВО) Формы инфекционного процесса: Острая инфекция – возникает сразу же после инкубационного периода как логическое продолжение в более активно реагирующем организме. Хроническая инфекция – характеризуется наличием возбудителя в организме в течение длительного времени (месяцы, годы). Например: сифилис, туберкулез, бруцеллез. Бессимптомная (инаппарантная) инфекция – представляет собой острое заболевание, при котором отсутствуют симптомы. Завершается выздоровлением и освобождением организма от возбудителя. Латентная инфекция – протекает скрыто, без клинических проявлений, однако может перейти в явную форму болезни. Вторичная инфекция – это новая инфекция, возникающая в ослабленном первичной болезнью организме (осложнение основного заболевания другим микробом) – корь осложняется пневмонией. Рецидив – возврат симптомов за счет оставшихся в организме возбудителей (возвратный тиф, малярия). Реинфекция – повторное заражение тем же видом после полного выздоровления. Суперинфекция – заражение тем же видом во время заболевания (до выздоровления). По степени интенсивности эпидемического процесса различают: 1) спорадическую заболеваемость – единичные случаи на данной территории в конкретный отрезок времени (не более 10 на 100 тыс. населения); 2) эпидемии – распространение инфекционной болезни на большие контингенты населения (20-100 на 100 тыс. населения); 3) пандемии – массовое распространение инфекционной болезни на большие территории. Эндемия – инфекция, встречающаяся в определенной местности: а) природно-очаговые эндемии связаны с природными условиями и ареалом распространения переносчиков и источников инфекции (чума, туляремия, желтая лихорадка); б) статистические эндемии обусловлены комплексом климато-географических и социально-экономических факторов (холера в Индии). Карантинные (конвенционные) болезни – наиболее опасные болезни, склонные к быстрому распространению. Показатели: Заболеваемость – исчисляется по количеству заболевших за год, к примеру, в пересчете на 10 тыс. или 100 тыс. населения. Смертность – исчисляется по количеству умерших от данной болезни на 100 тыс. населения. Летальность – выражается соотношением числа умерших на 100 заболевших в % Биологический (экспериментальный) метод исследования Биологический (экспериментальный) метод исследования (ЭСМИ) – совокупность способов искусственного воспроизведения клинической картины инфекционных болезней или их синдромов на лабораторных животных. Цели ЭСМИ. 1. Выделение и идентификация чистой культуры микроорганизмов, если ее невозможно получить на питательных средах: а) из-за большого количества в материале посторонней микрофлоры, обладающей ингибиторным действием (например, выделение возбудителя чумы из разлагающихся трупов грызунов); б) для выделения микроорганизмов, которые на питательных средах не растут (риккетсии, вирусы). 2. Определение вирулентности и патогенности микроорганизмов. 3. Индикация и идентификация экзотоксинов. 4. Изучение патогенеза инфекционных болезней при воспроизведении экспериментальных инфекций. 5. Производство биологических препаратов (профилактических, диагностических и лечебных сывороток, вакцин, культур тканей). 6. Проверка безвредности и эффективности лечебных препаратов (химиопрепаратов, иммунопрепаратов). 7. Лабораторные животные служат донорами крови для приготовления кровяных питательных сред и проведения исследований, связанных с использованием крови и её ингредиентов. Взятие и обработка материала. Материал для исследования забирается в асептических условиях, в стерильную посуду, гомогенизируется и используется для заражения. Выбор лабораторного животного. В медико-биологических исследованиях используется около 250 видов животных. Нелинейные животные. Одни виды постоянно разводят в лабораториях, питомниках и предприятиях по производству биопрепаратов, это так называемые лабораторные животные: белые мыши, белые крысы, морские свинки, кролики, хомяки, кошки, собаки, обезьяны, бараны, лошади. Других животных периодически отлавливают для эксперимента (полевки, песчанки, суслики, хорьки, сурки, лемминги). От общего числа лабораторных животных на долю белых мышей приходится около 70%, белых крыс – 15%, морских свинок –9%, кроликов – 2%. Линейные животные. Методом тесного инбридинга (внутриродственного скрещивания) удалось вывести более 200 линий мышей, свыше 20 линий крыс, 7 линий морских свинок, несколько линий кроликов. Среди диких животных чистых линий не существует. На выведение линий затрачивается не менее 8–10 лет тщательно выполняемой работы. С целью выведения определённой линии лабораторных мышей, крыс или других животных осуществляют братско-сестринское скрещивание на протяжении более 20 последовательных поколений и лишь тогда достигают 100% гомозиготности. Линейные (инбредные) животные ценны тем, что являются генетически однородными и отличаются от нелинейных животных постоянными реакциями на воздействие физиологических, химических и патогенных факторов. Каждой линии присущи свои передающиеся по наследству особенности и свойства (повышенная или пониженная чувствительность к возбудителям инфекционных заболеваний, опухолям). По рекомендации международного комитета по стандартизации генетической номенклатуры названия линий пишутся заглавными латинскими буквами. В заглавии линии заложено её происхождение, год создания какой-либо особенности животных данной линии. Напр., среди белых мышей наиболее распространены линии A, CBA, BALB, BAJJ, C57BL, C57BR, C58, C3H. Линейные лабораторные животные очень чувствительны к неблагоприятным факторам окружающей среды, поэтому условия содержания их должны быть лучше, чем нелинейных животных. Выбор вида, линии, возраста и пола животных диктуется целями исследований. Отобранных животных тщательно осматривают, больных выбраковывают. Перед проведением эксперимента все животные должны быть выдержаны в виварии на 2-х недельном карантине. Животные, взятые в эксперимент, должны быть здоровы, чувствительны к предполагаемому возбудителю, однородны по породе, линии, массе, возрасту, полу, упитанности, промаркированы. Методы заражения лабораторных животных. Применяют следующие методы заражения животных: накожный, внутрикожный, подкожный, внутримышечный, внутривенный, пероральный, интраназальный, внутриполостной (в брюшную полость, в грудную полость, в переднюю камеру глаза), внутриорганный (в мозг, в лёгкие). Способ заражения зависит от вида материала, вида животного, тропизма микроба. Материал вводят с соблюдением правил асептики. При болезненных вмешательствах предварительно проводят анестезию. Накожный метод. На кожу спины или живота, освобождённую от шерсти, наносят царапины скарификационной иглой. Материал берут стеклянной палочкой и втирают досуха. Внутрикожный метод. Местом введения обычно выбирают кожу спины или живота. Шерсть на этом месте за два дня до опыта удаляют депилятором. Используют очень тонкие и острые иглы с пологим скосом. Иглу вводят в кожу под очень острым углом скосом вверх. Инъецируют до 0,1 мл раствора. Образовавшееся вздутие («лимонная корочка») не исчезает 3–5 минут. Подкожный метод. Иглу шприца вводят в основание кожной складки предполагаемого места инъекции. После прокола кожи направление иглы меняют и медленно вводят жидкость – мышам не более 1,0 мл, морским свинкам и крысам –1,5 мл, кроликам –3,0 мл, место введения обрабатывают антисептиком. Следят за тем, чтобы введенный материал не вытекал наружу. Внутримышечный метод. Лучшим местом введения считается участок с развитым мышечным слоем в области верхней трети задней лапы животного. Острие иглы направляют почти перпендикулярно участку. Внутривенный метод. Инъекцию производят в краевую вену уха кроликов, яремную вену морских свинок, хвостовую вену крыс или мышей. Обрабатывают кожу над веной. Для лучшего наполнения вены ее пережимают ниже будущего введения или кожу обогревают теплой (550С) водой. Материал вводят медленно. Пероральный метод. Объём жидкости, вводимой перорально, зависит от вида и возраста животного. Кроликов и морских свинок пеленают и располагают в положении, близком к вертикальному. Материал вводят принудительно с помощью тонкого эластичного зонда. Процесс введения зонда требует навыков. Перед введением зонда животному вставляют роторасширитель с отверстием в середине. Продвижение зонда по пищеводу обычно не вызывает затруднений, если его конец смазан вазелином, а у животного вызывают глотательные движения закапыванием в рот нескольких капель воды. Через воронку или шприц жидкость вливают в желудок. Крыс или мышей помощник фиксирует в вертикальном положении, рот открывают браншами пинцета. Жидкость можно вводить двумя способами: а) шприцем со специальной изогнутой иглой, конец которой утолщен в виде шарика с боковым отверстием; б) шприцем с обычной иглой, на которую насажен тонкий эластичный зонд. Внутрибрюшинный метод. Инъекцию производят в задней трети живота. Место введения обрабатывают антисептиком до и после инъекции. Животное располагают вниз головой или в наклонном положении. Несколько отступив от средней линии, брюшную стенку прокалывают, вводят иглу под тупым углом к стенке. Игла должна быть с притупленным концом во избежание повреждения внутренних органов. Наблюдение за животным. В период наблюдения за животным должен быть обеспечен надлежащий уход; методика наблюдения зависит от ожидаемого эффекта: а) при определении вирулентности, токсигенности, токсичности наблюдают появление инфильтратов или учитывают гибель животного; б) при этиологической диагностике наблюдают за возникновением признаков заболевания; берут материал для бактериологического и серологического исследования, соблюдая правила асептики; ставят аллергические пробы. Гибель (умерщвление) животного и вскрытие трупа. Между смертью и вскрытием трупа животного должно проходить как можно меньше времени, так как кишечная флора даже при температуре холодильника проникает в ткани, кровь, органы через 20–27 часов. Более целесообразно умерщвлять животное в агональный период. Ход вскрытия зависит от задач исследования: изучают патологоанатомическую и патоморфологическую картину, делают посев органов для выявления обсеменённости и выделения чистой культуры, из внутренних органов готовят мазки-отпечатки. Все этапы работы с лабораторными животными регистрируют в специальном журнале с графами: - вид лабораторного животного - цель заражения - время заражения - материал, примененный для заражения - изменение поведенческих реакций животного после заражения - время гибели (умерщвления) животного - изменения, обнаруженные при вскрытии - материал, взятый для посева - свойства микроорганизма - вид микроорганизма. После вскрытия труп животного сжигают, автоклавируют или кипятят 1-2 часа в растворе фенола; инструменты дезинфицируют, очищают, затем стерилизуют. Трупы животных, павших от особо опасных инфекций, вскрывают в специальных помещениях с соблюдением особых мер предосторожности. Идентификация выделенной культуры и заключение по результатам исследования. Достоинства метода: - относительно высокая чувствительность; - высокая специфичность; - ранний метод исследования. Недостатки метода: - длительность; - не всегда доступен; - опасность инфицирования; - дорогостоящий. Агглютинация - склеивание антигеннесущих корпускулярных частиц молекулами специфических антител в присутствии электролитов, которое заканчивается образованием видимых невооруженным глазом хлопьев или осадка (агглютината). Характер осадка зависит от природы антигена: жгутиковые бактерии дают крупнохлопьевидный осадок, безжгутиковые и бескапсульные - мелкозернистый, капсульные - тяжистый. Различают агглютинацию прямую, при которой во взаимодействии со специфическими антителами непосредственно участвуют собственные антигены бактериальной или любой другой клетки, например, эритроцитов; и пассивную, при которой бактериальные клетки или эритроциты являются носителями не собственных, а сорбированных на них чужих антигенов (или антител) для выявления специфических к ним антител (или антигенов). Реакция агглютинации протекает в две фазы: вначале происходит специфическое взаимодействие активного центра антител с детерминантом антигена, эта стадия может происходить в отсутствие электролитов и не сопровождается видимыми изменениями реагирующей системы. Для второй стадии необходимо наличие электролитов, которые снижают заряд комплексов антиген +антитело и ускоряют процесс их склеивания. Эта фаза заканчивается образованием агглютината. Реакции агглютинации ставят либо на стеклянных пластинках, либо в стерильных агглютинационных пробирках. Реакции агглютинации на стекле обычно применяют в качестве ускоренного метода обнаружения специфических антител в сыворотке больного или для серологической идентификации возбудителя. В последнем случае обычно используют очищенные (адсорбированные) диагностические сыворотки, содержащие монорецепторные антитела. 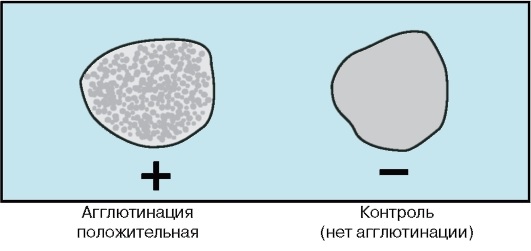 Рис. РА на стекле. Развернутая реакция агглютинации в пробирках позволяет определить количественное содержание антител в сыворотке и при необходимости зарегистрировать факт нарастания титра антител, что имеет диагностическое значение. Для постановки реакции в пробирки вносят разведенную 0,85 процентным раствором хлорида натрия сыворотку и равный объем (обычно 0,5 мл) суспензии стандартного диагностикума (или исследуемой культуры), содержащей в 1 мл 1 млрд бактерий. За титр сыворотки принимают последнее разведение сыворотки, в которой еще наблюдается четкая агглютинация. Учет результатов реакции производят окончательно через 20-24 ч по двум признакам: наличию и величине осадка и степени прозрачности надосадочной жидкости. Оценку осуществляют по четырехкрестной системе. Положительной считается как минимум 3-крестовая реакция. Реакция обязательно сопровождается контролем сыворотки и антигена. РА для серодиагностики широко применяют при брюшном тифе, паратифах (реакция Видаля), бруцеллезе (реакция Райта) и др. Антителом при этом является сыворотка больного, а антигеном - известный микроб. 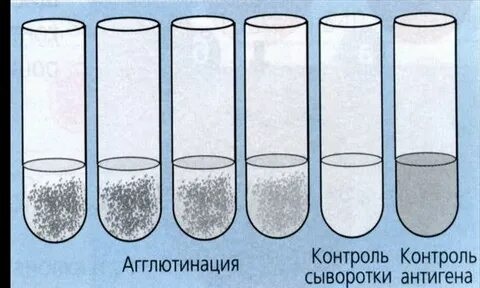 Рис. РА Райта Оценка результатов по четырехкрестной системе: ++++ – жидкость в пробирке прозрачна, очень большой осадок в виде зонтика – полная агглютинация; +++ – жидкость почти прозрачна, осадок значительный – почти полная агглютинация; ++ – жидкость непрозрачная, осадок небольшой – слабая агглютинация; + – жидкость непрозрачная, осадок незначительный, едва заметный невооруженным взглядом; при взбалтывании можно увидеть хлопья или зернистость в лупу или агглитиноскоп – отмечаются следы агглютинации Реакцию пассивной гемагглютинации ставят в специальных полистироловых пластинках с луночками, имеющими полусферическое дно. При использовании ее для серологической диагностики в этих луночках готовят двукратные разведения в физиологическом растворе исследуемой сыворотки, и затем добавляют к ней в качестве диагностикума взвесь сенсибилизированных эритроцитов. Учет результатов проводят через 2 часа инкубации при 37 градусов по Цельсию по четырехкрестной системе. При положительной реакции агглютинировавшиеся эритроциты оседают на дно луночки и равномерно покрывают его в виде перевернутого зонтика. При отрицательной реакции эритроциты тоже оседают, жидкость становится прозрачной, осадок выглядит в виде маленького «диска» в центре луночки. Титром сыворотки в РПГА считается ее последнее разведение, которое еще дает ярко выраженную гемагглютинацию без значительных признаков наличия «диска». РПГА может применяться в качестве обнаружения непосредственно в исследуемом материале неизвестных бактерий, вирусов, токсинов. При таком варианте постановки РПГА в роли известного компонента реакции используют эритроциты, адсорбировавшие известные по своей специфичности антитела - антительный эритроцитарный диагностикум. Если исследуемый материал содержит достаточное количество известного антигена, РПГА будет положительна. 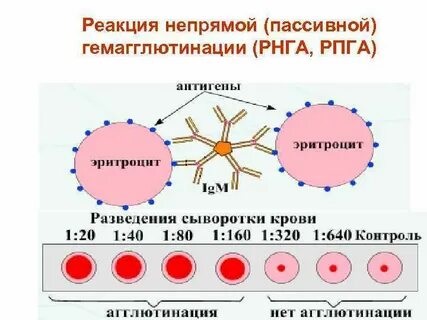 В основе реакции лежит способность специфических антител образовывать иммунные комплексы с клетками, в том числе с эритроцитами, бактериями, что приводит к активации системы комплемента по классическому пути и лизису клеток. Из реакций иммунного лизиса чаще других применяется реакция гемолиза и редко - реакция бактериолиза (главным образом, при дифференциации холерных и холероподобных вибрионов). РЕАКЦИЯ ГЕМОЛИЗА: литическое действие иммунной сыворотки в присутствии комплемента особенно четко проявляется в отношении эритроцитов. Если кролика иммунизировать эритроцитами барана, кроличья сыворотка приобретает специфическую гемолитическую активность, т.е. способность вызывать гемолиз эритроцитов, использованных для иммунизации. Этот эффект абсолютно зависим от иммунизации. Таким образом, наличие или отсутствие активного комплемента в гемолитической сыворотке очень четко выявляется по результатам ее взаимодействия с гомологичными эритроцитами: при наличии комплемента - гемолиз, образование «лаковой крови»; при его отсутствии - гемагглютинация, эритроциты выпадают на дно пробирки, образуя осадок в виде зонтика, жидкость бесцветна. Преимущество РСК состоит в том, что природа антигена, участвующего в ней, не имеет значения, так как комплемент связывается с Fc - фрагментом любого антитела, относящегося к IgG и IgM, независимо от его антительной специфичности. РСК очень чувствительна: она позволяет обнаружить количество антител в 10 раз меньшее, чем в реакции преципитации. В основе РСК лежат два свойства комплемента: 1) способность связываться с комплексом антиген + антитело 2) вызывать лизис эритроцитов, использованных для получения гемолитической сыворотки. РСК выполняется в две фазы при участии двух систем: бактериальной и гемолитической. В первой фазе (специфической) участвуют антиген+антитело+комплемент. Образовавшийся комплекс не визуализируется. Вторая фаза - выявление комплекса, образовавшегося при помощи индикаторной гемолитической системы (эритроциты барана+гемолитическая сыворотка). Гемолиз происходит в случае присоединения к гемолитической системе комплемента. Если же комплемент ранее адсорбировался на комплексе антиген+антитело в первой системе, то гемолиз эритроцитов не происходит, эритроциты выпадают в осадок. При наличии в исследуемой сыворотке гомологичных антигену антител, образовавшийся комплекс (Аг+Ат) связывает на себе комплемент. При добавлении гемолитической системы гемолиза эритроцитов не происходит, так как комплемент связывается с комплексом Аг+Ат и эритроциты выпадают в осадок. При отсутствии в исследуемой сыворотке специфических антител к антигену, введенному в первую систему, специфический комплекс антиген+антитело не образуется и комплемент остается в свободном состоянии. Поэтому при добавлении гемолитической системы к ней присоединяется комплемент. Результатом реакции в данном случае будет гемолиз эритроцитов - в пробирках появляется так называемая «лаковая» кровь. Все компоненты, участвующие в реакции, должны быть предварительно оттитрованы и взяты в равных объемах. РСК ставят в 5-и пробирках (1,2,3,4,5). Исследуемую сыворотку (I) предварительно прогревают при 56°С в течение 30 минут для инактивации содержащегося в ней комплемента и пипеткой вносят по 0,5 мл в первую и пятую пробирки. Второй пипеткой вносят 0,5 мл заведомо позитивной сыворотки (II) во вторую пробирку (контроль). Третьей пипеткой вносят 0,5 мл заведомо негативной сыворотки (III) в 3-ю пробирку (контроль). Четвертой пипеткой вносят по 0,5 мл физиологического раствора (IV) в четвёртую и пятую пробирки (контроль). Этой же пипеткой вносят по 0,5 мл специфического антигена в рабочей дозе (V) в первую, вторую, третью, четвёртую пробирки. Пятой пипеткой вносят по 0,5 мл комплемента в рабочей дозе (VI) во все пробирки. Отдельно готовят гемолитическую систему (VII) - смесь равных объемов 3% суспензии эритроцитов барана и гемолитической кроличьей сыворотки. Ингредиенты необходимо смешивать как можно быстрее. Причем гемолитическую сыворотку следует добавлять к суспензии эритроцитов, а не наоборот. Гемолитическую систему выдерживают 30 минут в термостате при 37°С и шестой пипеткой вносят по 1,0 мл в пробирки 1,2,3,4,5. После добавления гемолитической системы пробирки помещают в термостат при 37°С до полного гемолиза в контрольных пробирках.  Результат реакции оценивают по четырёхплюсовой системе: + + + + - Отсутствие гемолиза + + + - Гемолиз 25% + + - Гемолиз 50% + - Гемолиз 75%. - – полный гемолиз «лаковая кровь» Для определения титра специфических антител исследуемую сыворотку (I) последовательно двукратно разводят физиологическим раствором. Титром антител в исследуемой сыворотке считают наибольшее ее разведение, давшее задержку гемолиза.  Качественная реакция кольцепреципитации применяется часто. Для ее постановки в тонкие преципитационные пробирки наливают сначала неразведенную преципитирующую сыворотку и сверху наслаивают раствор антигена. В случае гомологичности антител и антигена на границе между этими растворами через 3-10 минут появляется кольцо преципитата. Одним из наиболее эффективных методов анализа растворимых антигенов является реакция преципитации в геле. Она позволяет выявить число индивидуальных антигенов в исследуемой жидкости и провести анализ их антигенного родства. Разработан метод встречной иммунодиффузии, позволяющий проводить прямое сравнение различных антигенов и сывороток. Этот метод часто применяют для определения токсигенности дифтерийных бактерий. Используют 1%-ный агар, приготовленный на физиологическом растворе, который разливают в чашки Петри слоем 0,5 см толщиной. После застывания в пластинке агара вырезают луночки: одну - в центре чашки, 4-5 - по окружности. В центральную луночку наливают преципитирующую сыворотку, а в периферический - раствор гомологичного и сравниваемых с ним антигенов. Учет результатов проводят через 24,48, и 72 часа инкубации при комнатной температуре. Антитела и антигены диффундируют навстречу друг другу, и в участках, где создаются их эквивалентные концентрации, образуются дугообразные полосы преципитации. 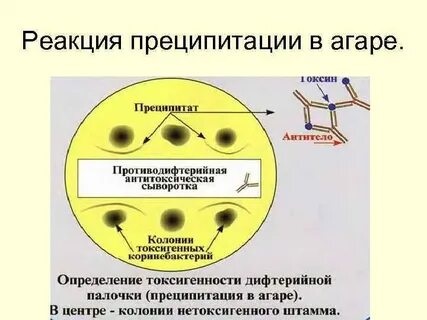 Постановка реакции термопреципитации Асколи для выявления антигена возбудителя сибирской язвы Материал для исследования (I) измельчают, заливают десятикратным объемом физиологического раствора и кипятят в течение 15 минут (II). Полученный термоэкстракт фильтруют до полной прозрачности жидкости (III). Полученный фильтрат (IV) осторожно наслаивают пастеровской пипеткой (V) на внесенную предварительно в пробирку маленького диаметра сибиреязвенную преципитирующую сыворотку (VI). Если в исследуемом материале находится антиген возбудителя сибирской язвы, то на границе контакта термоэкстракта и сибиреязвенной преципитирующей сыворотки через 2 минуты при комнатной температуре образуется тонкое мутно-белое кольцо преципитации (VII). Во избежание ложноположительного результата реакции ставят контроли: 1. преципитирующая сибиреязвенная сыворотка + стандартный специфический преципитиноген 2. преципитирующая сибиреязвенная сыворотка + физиологический раствор 3. нормальная лошадиная сыворотка + исследуемый термоэкстракт. Первый контроль должен быть положительным, остальные - отрицательными. 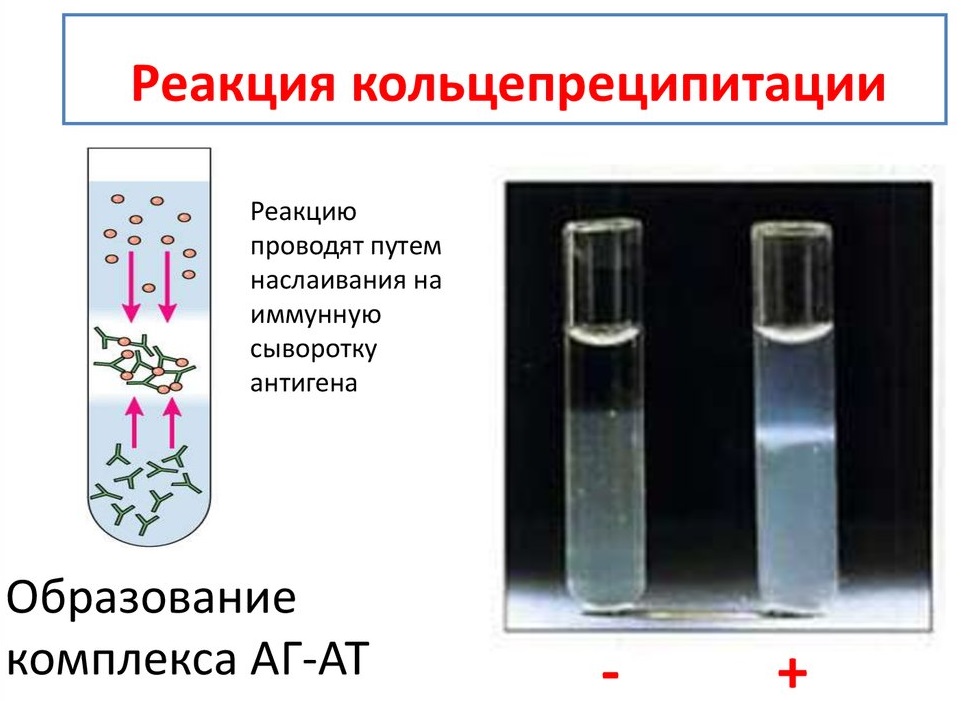 |
