Темы и лекции 1 модуля. Обычные Bacillus subtilis 0,70,8x23 Escherichia coli 0,31х16 Staphylococcus aureus 0,51,0 Thiobacillus thioparus 0,5х13 Rickettsia prowazeki 0,30,6x0,82 Мелкие
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
СИБИРСКАЯ ЯЗВАСИБИРСКАЯ ЯЗВА Сибирская язва известна с глубокой древности. Со времён Гиппократа и Гомера, Галена и Виргилия болезнь фигурирует под названиями «священный огонь» (ignissacer) или «персидский огонь» (ignispersicus). Название заболевания связано с местом изучения крупной вспышки эпидемии в Сибири (погибло 100 000 лошадей). Тогда в 1788 г. С.С. Андриевский путём самозаражения установил одинаковую этиологию сибирской язвы у людей и животных. — Возбудитель заболевания был обнаружен в Германии А.Поллендером в 1849г. в крови больного животного. — Чистую культуру возбудителя получил Р.Кох (1876), — Изучением этой болезни занимался Л.Пастер и Л.С.Ценковский — В 1881 г. Пастёр предложил живую вакцину для иммунопрофилаки заболевания. — В связи с монополизацией производства вакцины, предложенной Пастером, — Л.С. Ценковский (независимо от Пастера)разработал отечественную живую вакцину. Сибирская язва — типичный зооноз. Среди животных наиболее восприимчивы травоядные. Заболеваемость у человека носит выраженный профессиональный характер (сельскохозяйственные рабочие, работники боен, шерстобиты). Морфологические и тинкториальные свойства. Возбудитель сибирской язвы (Bacillus anthracis) имеют форму палочек. Палочки Грамположительные, крупные (до 10 мкм в длину, 1-2 мкм в ширину). Микробы располагаются преимущественно цепочками. Концы палочек на окрашенных препаратах представлены как бы обрубленными и даже вогнутыми, так что цепочки из палочек напоминают бамбуковую трость. Bacillus anthracis неподвижны. Образуют споры и капсулы. Споры располагаются центрально, их диаметр не превышает поперечника микробной клетки. Спорообразование происходит только при достаточном притоке кислорода и при температуре от 18 до 42° С капсулы образуются в организме животного и человека. Может быть общая капсула для нескольких микробов. Культуральные свойства. Сибиреязвенные бацилла – аэроб или факультативный аэроб. Оптимальная температура роста – 37°. Растет на обычных питательных средах при рН 7,2-7,6. На МПА – крупные шероховатые, матовые, с неровным краем колонии (R- формы). Край колонии под микроскопом напоминает львиную гриву. На кровяном агаре не дают гемолиза. На МПБ образуют осадок, напоминающий комочек ваты. В столбике желатина при посеве уколом рост в виде перевернутой елочки. Биохимические свойства. Ферментируют глюкозу, сахарозу, мальтозу до кислоты. Разжижают желатин (выражены протеолитические свойства). Образуют сероводород и аммиак. Свертывают молоко. Антигенные свойства. Сибиреязвенные бациллы имеют 2 антигена: — Р (протеиновый, термолабильный) — С (полисахаридный, термостабильный) Резистентность. В естественных условиях сибиреязвенные бациллы могут быть в вегетативных формах и в спорах. Вегетативные формы чувствительны к высоким температурам: при 55° С погибают через 40 мин; при 80° С через 3-5 минут; при кипячении – через 1-2 минуты. Чувствительны к дезинфицирующим средствам: хлорной извести, хлорамину. — Чувствительны к пенициллинам. Они из палочек превращаются в круглые формы («жемчужное ожерелье») — Споры термоустойчивые: кипячение – до 60 мин; 140° 2-3 часа, автоклавирование (120°) - 10-15мин. — Резистивны к дезинфицирующим средствам. Во внешней среде споры могут сохраняться до 80 лет. Патогенность для животных. Сибиреязвенные бациллы вызывают эпизоотии среди мелкого и крупного рогатого скота. Восприимчивы лошади, коровы, овцы, свиньи, верблюды. Животные заражаются через корм и воду, инфицированные калом, мочой, а также при поедании травы на зараженном пастбище. В лабораторных условиях наиболее чувствительны белые мыши, морские свиньи и кролики. Эпидемиология. Эндемические очаги заболевания находятся в Азии, Южной Африке, Южной Америке и Австралии; спорадические случаи выявляются в Европе, России и США. Ежегодно в мире регистрируют около 1 млн случаев сибирской язвы у животных и 25- 100 тыс. случаев заболевания у людей. Источник инфекции - больные животные. Пути заражения: — 1) Контактный (непосредственный контакт, разделывание туш животных); — 2)Воздушно-пылевой (уборка скотного двора, сортировка туш на меховых предприятиях); — 3)Алиментарный (мясо и молоко от больного животного) — 4) Через кровососущих насекомых (оводы, слепни, мухи- жигалки). Патогенез, клиника. Существуют следующие клинические формы болезни: кожная; легочная; кишечная; септическая: первично септическая вторично септическая. Кожная форма. Встречается в 98% случаев. На месте внедрения бацилл сибирской язвы появляется красноепятнышко,которое затем превращается впапулу, пустулуи при усилении воспалительного процесса – в сибиреязвенный карбункул. Чаще всего он располагается на лице, руках и других открытых частях тела. Характерно отсутствие болезненности, черный струп. Общее состояние больного тяжелое: t 39-40° С, сильная головная боль, увеличение регионарных лимфоузлов. Прогноз, как правило, благоприятный при своевременном лечении. Легочная форма. Начинается остро и имеет быстрое развитие, убивая в течение 2-3 дней больного. Характеризуется высокой температурой, болями в груди, одышкой, кашлем, выраженной интоксикацией. Протекает по типу бронхопневмонии. Кишечная форма. Заболевание начинается остро и имеет бурное развитие. У больных наблюдается озноб, повышение температуры тела до фебрильных цифр, головная боль, головокружение, тошнота, рвота, жидкий стул и режущие боли в животе . Прогноз неблагоприятный. Септическая форма. Может развиваться на фоне любой формы сибирской язвы. На первый план при септической форме выступает тяжелейшая токсемия, приводящая к быстрому развитию экзо- эндотоксического шока. Больные погибают обычно в первые дни болезни, а иногда и в первые часы. Первично-септическая форма сибирской язвы развивается в случае заражения неиммунного человека массивными дозами капсулосодержащих форм возбудителя. Вторично-септическая форма сибирской язвы – это следствие любых других клинических форм болезни. Микробиологическая диагностика (обязательно нужно изучить материал, изложенный в учебном пособии с грифом МОН ДНР «Специальная микробиология. Микробиологическая диагностика бактериальных инфекций» Донецк, 2019. Автор Жадинский Н.В. стр. 140). Лечение. Этиотропная терапия проводится с помощью антибиотиков: - ципрофлоксацин -доксициклин -амоксициллин Специфическая терапия осуществляется противосибиреязвенным гетерогенным (лошадиным) иммуноглобулином Специфическая профилактика. Применяется только для определенных категорий населения. Это зоотехнический и ветеринарный персонал, а также лица, занятые на заготовке, транспортировке и переработке животного сырья. Иммунизация проводится живой сибиреязвенной вакциной. Начало формы Конец формы МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ЧУМЫ Возбудитель Yersinia pestis входит в семейство Enterobacteriaceae, род Yersinia.  Yersinia pestis Материалом для микробиологической диагностики при бубонной форме чумы является содержание бубонов, при легочной форме - мокрота, при кишечной форме - кал, при септической форме - кровь. У трупа исследуют кровь из сердца, кусочки пораженных органов: лимфатических узлов, легких, печени, селезенки. Микробиологическую диагностику чумы проводят микроскопическим, бактериологическим, серологическим и биологическим методами. При исследовании загнивающего трупного материала для выявления в нем антигенов возбудителя применяют реакцию термопреципитации. Отбор и доставка материалов в лабораторию должны выполняться с тщательным соблюдением правил безопасности. Микробиологическая диагностика чумы проводится с соблюдением строгого режима в специальных противочумных учреждениях. Микроскопический метод. Из исследуемого материала готовят мазки и окрашивают по Граму и синькой Леффлера. Yersinia pestis в мазках похожа на короткую овоидную палочку и красится биполярно. Возбудитель чумы красится по Граму отрицательно. Наиболее эффективным является выявление возбудителя с помощью специфических люминесцентных сывороток в РИФ. После обработки такими сыворотками мазков из исследуемого материала при просмотре препаратов с помощью люминесцентного микроскопа обнаруживаются характерные по морфологическим признакам палочки, которые с обеих сторон на концах светятся изумрудно-зеленым цветом. Бактериологический метод. Исследуемый материал высевают на мясо-пептонный агар с добавлением стимуляторов роста (сульфит натрия, кровь или лизат культуры сарцин) и МПБ, инкубируют в термостате при 25-28˚С. На МПА через 24 часа вырастают колонии R-формы в виде «кружевных платков» - компактный выпуклый центр окружен светлой кружевной зоной. В бульоне рост проявляется образованием пленки, от которой вниз отходят нитевидные образования, напоминающие сталактиты. Бульон остается прозрачным. Материал из подозрительных колоний пересевают на скошенный агар для получения и накопления чистой культуры микробов. Из выросшего на скошенном агаре микробного налета, готовят мазок, окрашивают по Граму, изучают под микроскопом и устанавливают чистоту полученной культуры. Далее проводят ее идентификацию. Принадлежность к Y. pestis устанавливают на основании изучения морфологических, тинкториальных, культуральных, биохимических, антигенных свойств, пробы с чумным бактериофагом, биопробы, подвижности. Серологический метод. Антитела к возбудителю чумы в сыворотке крови больных определяют с помощью реакции пассивной гемагглютинации, непрямой РИФ и ИФА. Биологический метод. Исследуемый материал вводят морской свинке подкожно, внутрибрюшинно или наносят наружно, втирая его в выбритую скарифицированную кожу живота. При наличии в материале возбудителя чумы у животных развивается острый инфекционный процесс. При внутрибрюшинном заражении морские свинки погибают через 2-3 суток, а при наружном - через 5-7 суток. Из трупного материала погибших животных готовят мазки - отпечатки (из лимфатических узлов, селезенки, печени, легких), а также готовят мазки крови, делают посев на питательные среды. После забора материала на исследование, трупы животных погружают в 5% раствор лизола, а затем сжигают. Для выявления возбудителей чумы в загнивающем трупном материале, применяют реакцию термопреципитации с чумной преципитирующей сывороткой. Дифференциация Y. pestis от Y. pseudotuberculosis и Y. enterocolitica 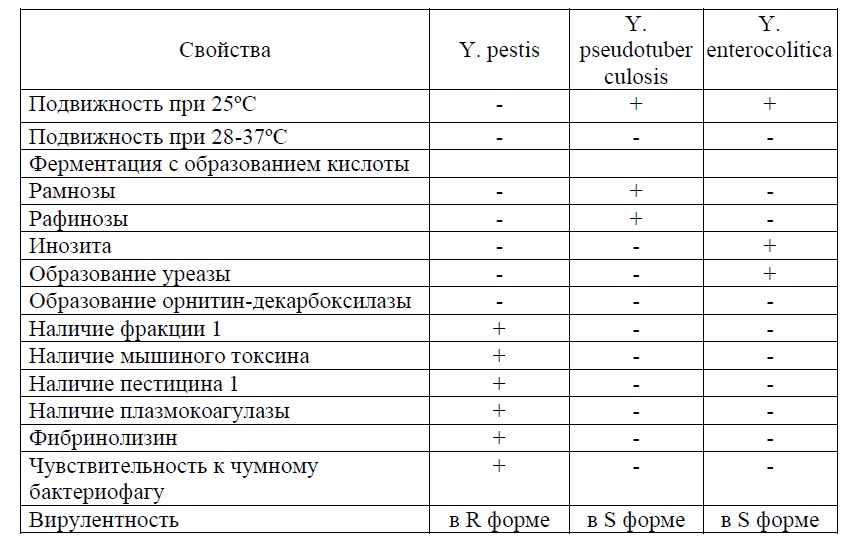 МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ТУЛЯРЕМИИ Возбудитель Francisella tularensis входит в семейство Brucellaceae, род Francisella.  Francisella tularensis Материалом для исследования, в зависимости от клинической формы заболевания, является пунктат лимфоузлов, отделяемое конъюнктивы, содержимое пустул или язвы на коже, мокрота, испражнения, кровь. Материал забирают и доставляют в лабораторию, соблюдая правила работы с возбудителями особо опасных инфекций. Микробиологическую диагностику туляремии проводят биологическим, бактериологическим, серологическим, аллергологическим методами. Биологический метод. Выделить возбудителя туляремии путем прямого посева исследуемого материала на питательные среды не удается, поэтому биологический метод имеет первостепенное значение. Исследуемым материалом инфицируют белых мышей или морских свинок. Материал вводят подкожно, наружно, внутрибрюшинно или перорально. Даже при введении единичных бактерий животные, как правило, заболевают и погибают (мыши - на 3-4 сутки, морские свинки - на 10 сутки). Если в указанный срок животные не погибают, их забивают на 15-20 сутки и вскрывают трупы. Из селезенки и печени готовят мазки-отпечатки и микроскопируют их. Кровь, костный мозг, кусочки внутренних органов втирают в поверхность одной из специальных питательных сред. Бактериологический метод. Для культивирования используется свернутая желточная среда, среда Мак-Коя, глюкозо-цистеиновый агар с кровью. Рост туляремийных бактерий на свернутой желточной среде появляется через 18-24 часов при температуре 37ºС. Засеянные питательные среды инкубируют в термостате до 10 суток. Туляремийные бактерии растут в виде налета с неровной поверхностью или образуют мелкие гладкие, S-формы, колонии, имеющие беловатый цвет с голубым оттенком, похожие на капельки росы. После выделения чистой культуры микробов проводят их идентификацию по морфологическим, культуральным, антигенным свойствам. В мазках из колоний обнаруживаются мелкие полиморфные грамотрицательные бактерии. Антигенные свойства определяют в реакции агглютинации с туляремийной агглютинирующей сывороткой. Возбудитель хорошо культивируется в желточном мешке 12-суточного куриного эмбриона, в котором он легко обнаруживается с помощью прямой реакции иммунофлюоресценции (РИФ). Биологический и бактериологический методы проводят только в специализированных лабораториях. Серологический метод. Со 2-й недели заболевания ставят развернутую реакцию агглютинации в пробирках с туляремийным диагностикумом. Диагностическим считается титр 1:100. При постановке реакции агглютинации с парными сыворотками, увеличение титра антител в четыре раза и более позволяет поставить диагноз. Специфические антитела в сыворотке крови больного определяют и в реакции пассивной гемагглютинации, которая может быть положительной уже в конце первой недели заболевания. Для ее постановки используют эритроцитарный туляремийный диагностикум. Аллергологический метод. Ставят кожно-аллергическую пробу с тулярином. В случае внутрикожной постановки она бывает положительной с 3-5-го, а при накожной - с 6-8-го дня болезни. Результаты пробы учитывают через 24-48 часов. Наличие выраженного инфильтрата и гиперемии диаметром 0,5 см и более свидетельствует о положительной реакции. МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА Возбудители заболевания Mycobacterium tuberculosis, Mycobacterium bovis, Mycobacterium africanum входят в семейство Mycobacteriасеае, род Mycobacterium. В зависимости от клинической формы заболевания исследуют: мокроту, промывные воды бронхов, гной, мочу, кал, спинномозговую жидкость, асцитическую жидкость, кровь, пунктаты лимфоузлов и закрытых отеков, кусочки ткани, которые были взяты во время операции.  Mycobacterium tuberculosis Микробиологическую диагностику туберкулеза проводят микроскопическим, бактериологическим, биологическим, серологическим, аллергологическим методами. Микроскопический метод. Материалом для микроскопического исследования чаще бывает мокрота. Предпочтение отдается утренней порции. При недостаточном количестве ее собирают в течение суток. Более ценным материалом при отсутствии мокроты является промывные воды бронхов. Мокроту выливают в чашку Петри, выбирают желто-зеленые гнойные комочки, переносят на предметное стекло, готовят мазок и окрашивают по Цилю-Нильсену. Во время микроскопии мазка на синем фоне (посторонний материал: лейкоциты, слизь, другие микробы окрашиваются в синий цвет) видны окрашенные фуксином в рубиново-красный цвет микобактерии в виде тонких, коротких или длинных, прямых или слегка изогнутых палочек, иногда расположенных под углом, часто кучками или небольшими скоплениями. Этот способ окрашивания позволяет выявить кислотоустойчивые микроорганизмы. Положительное заключение делают при обнаружении микобактерий туберкулеза в препарате после пересмотра не менее 100 полей зрения. Гной исследуют как и мокроту. При исследовании мочи, промывных вод бронхов, пунктатов и т.д. материал центрифугируют и готовят мазок из осадка. Препарат из осадка мочи обесцвечивают не только кислотой, но и спиртом, для дифференциации от M. Smegmatis, которые могут находиться в моче здоровых людей. Спинномозговую жидкость отстаивают в холодильнике и готовят мазок из нежной пленки фибрина. Необходимо учитывать, что содержание микобактерий в исследуемом материале может быть незначительным выделение их эпизодическим и в нем могут быть измененные варианты возбудителя, в том числе L-формы. Поэтому для повышения вероятности обнаружения микобактерий туберкулеза используют фазово-контрастную и люминесцентную микроскопию (РИФ). Для РИФ используют диагностические сыворотки, содержащих меченые флюорохромом антитела к антигенам L-форм. Применяют методы гомогенизации и флотации, позволяющие сконцентрировать туберкулезные микобактерии. Метод гомогенизации. К суточному объему мокроты добавляют равный объем 1% едкого натра, плотно закрывают ёмкость и встряхивают ее 15 минут до полной гомогенизации мокроты, центрифугируют, сливают жидкую часть, осадок нейтрализуют 1-2 каплями 10% раствора соляной кислоты. Из осадка, в котором сконцентрированы туберкулезные микобактерии готовят мазок, окрашивают по Цилю-Нильсену и микроскопируют. Метод флотации. После обработки едким натром, как указано выше, гомогенизированную мокроту помещают в колбу с резиновой пробкой. Колбу прогревают на водяной бане при 55°С 30 минут, добавляют 1-2 мл ксилола, толуола или бензина, после чего разводят дистиллированной водой до горлышка колбы. Смесь встряхивают 10 - 15 минут, после чего отстаивают в течение 15-20 минут. Осторожно отбирают и переносят пипеткой на предметное стекло образованный сливкообразный слой. Стекло кладут на закрытую водяную баню. На высохший мазок наслаивают новую порцию материала и снова подсушивают. Наслоения с последующим высушиванием проводят 5-6 раз. Сухой препарат несколько раз промывают эфиром, мазок фиксируют и окрашивают по Цилю-Нильсену. Флотация повышает выявления микобактерий в патологическом материале на 10%. Отрицательный результат микроскопии не может свидетельствовать на 100% об отсутствии микобактерий в исследуемом материале, поэтому результат микроскопического исследования является лишь ориентировочным. Бактериологический метод. Этот метод является более достоверным и применяется в тех случаях, когда микроскопическое исследование не дало положительных результатов. Метод позволяет выделить чистую культуру бактерий с последующей дифференциацией микобактерий с учетом скорости их роста и ряда биохимических свойств. Дифференциальные признаки некоторых микобактерий 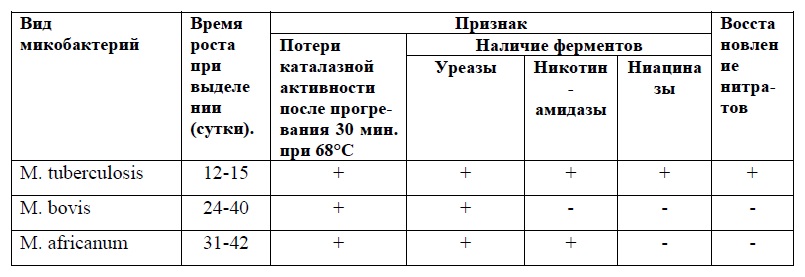 В исследуемом материале перед посевом на питательные среды должны быть уничтожены посторонние бактерии. Для этого патологический материал обрабатывают слабым раствором серной кислоты (6-12%), что убивает все бактерии, кроме кислотоустойчивых. После обработки кислотой мокроту встряхивают и центрифугируют. Полученный осадок отмывают от серной кислоты путем 20-30 минутного центрифугирования в стерильном физиологическом растворе. Отмытый осадок высевают на среды Левенштейна-Йенсена, Финн-2. После посева пробирки со средами заливают расплавленным парафином и помещают в термостат на 3-4 недели. Посевы просматривают раз в неделю. Рост микобактерий туберкулеза обычно выявляется на 3-4й неделе, но иногда и через 2,5-3 месяца. Микобактерии туберкулеза дают, как правило, сухие, морщинистые, грубые (напоминающие бородавки) колонии, обычно R-формы. Колонии плохо снимаются со среды, а при прокаливании бактериологической петли в пламени дают характерный треск. S-форма колоний с пигментацией желтого цвета свойственна и другим микобактериям. В мазках, приготовленных из колоний и окрашенных по Цилю-Нильсену, регистрируются скопления типичных микобактерий. В молодых культурах, выделенных от больных, которых лечили антибактериальными препаратами, можно найти микроорганизмы измененной формы в виде коротких палочек или шаров. Для более быстрого выделения туберкулезных микобактерий предложены ускоренные методы культивирования. Метод микрокультур Прайса. Материал от больного центрифугируют. Осадок наносят толстым слоем на стерильное предметное стекло. Высушенный препарат погружают на 5 минут в 5% серную кислоту для уничтожения посторонней микрофлоры, а затем в стерильный физиологический раствор для удаления кислоты. После этого препарат погружают в стакан с питательной средой (цитратная кровь, разведенная дистиллированной водой 1:4) и помещают в термостат. Рост туберкулезных микобактерий обнаруживают под микроскопом уже через 48-72 часа. Препараты окрашивают по Цилю-Нильсену и микроскопируют. Микроколонии возбудителя туберкулеза выглядят как косы, жгуты или массивные скопления. Данный способ позволяет видеть рост туберкулезных бактерий на той стадии, когда макроскопически его обнаружить не удается, но метод микрокультур не дает возможности изучать свойства бактериальных культур. Глубинный метод посева по Школьниковой. Исследуемый материал центрифугируют и к осадку добавляют равный объем 2% серной кислоты. Перемешивают и центрифугируют 15-20 минут. Осадок промывают стерильным физиологическим раствором. 2-3 капли осадка засевают в глубину среды (цитратная кровь, разведенная дистиллированной водой 1: 4), разлитой по 5 мл в 3 пробирки. Посевы помещают в термостат. Учёт микробного роста выполняют на десятые сутки. Готовят мазки, окрашивают по Цилю-Нильсену и микроскопируют. При положительном результате посева в мазке обнаруживают микроскопические колонии бактерий туберкулеза, имеющие вид кос или жгутов. Начало формы МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА Биологический метод. Этот метод является наиболее чувствительным и дает положительные результаты при введении морским свинкам даже единичных туберкулезных микобактерий. Исследуемый материал обрабатывают серной кислотой, освобождая от посторонней микрофлоры, и вводят подкожно двум морским свинкам массой 250-300 г в область паха. При наличии туберкулезных микобактерий через 6-10 дней в месте введения патологического материала появляется уплотнение (инфильтрат) на поверхности которого образуется язва. Из гноя язвы делают мазки, окрашивают по Цилю-Нильсену. При положительном результате животное теряет вес и через 4-6 недель погибает. При вскрытии трупа обнаруживают туберкулезные бугорки в органах. В мазках из бугорков находят туберкулезные микобактерии. При малом количестве исследуемого материала животных инфицируют внутрибрюшинно или интратестикулярно. Такой способ заражения повышает чувствительность метода, особенно в тех случаях, когда в материале содержатся маловирулентные устойчивые к изониазиду микобактерии туберкулеза. В последнее время все шире практикуется интрацеребральное заражение белых мышей. Основное отличие M. bovis от M. tuberculosis заключается в их патогенности для кроликов. В случае внутривенного заражения кролика культурой M. bovis кролик погибает от генерализованного туберкулеза через 3-6 недель. К заражению M. tuberculosis кролики резистентные. Серологический метод является вспомогательным. Предложены различные реакции, позволяющие выявить антитела к антигенам микобактерий, например, РСК, РПГА. Однако эти реакции или недостаточно специфичны, или требуют дифференциальной диагностики при ложноположительных результатах. Аллергологический метод. Применяют для определения инфицированности населения туберкулезными микобактериями. Внутрикожную туберкулиновую пробу Манту применяют для диагностики туберкулеза у детей и перед ревакцинацией. Для постановки пробы берут «туберкулиновый» шприц объемом 1 мл и иглы с коротким срезом. В кожу средней трети внутренней поверхности предплечья вводят 0,1 мл очищенного туберкулина в стандартном разведении. Результаты пробы Манту оценивают через 48-72 часа. Величину папулы измеряют при помощи прозрачной миллиметровой линейки. Регистрируют поперечный (по отношению к оси руки) диаметр папулы. Зону гиперемии при этом не учитывают. При величине папулы от 0 до 1 мм в диаметре реакция считается отрицательной, от 2 до 4 мм - сомнительной, а 5 мм и более - положительной. Конец формы |
