Клиническая химия в диагностике и лечении. Обмен натрия и воды обмен калия лечение диуретиками гомеостаз ионов водорода
 Скачать 3.99 Mb. Скачать 3.99 Mb.
|
ЗАБОЛЕВАНИЯ ПЕЧЕНИ И ЖЕЛЧНЫЕ КАМНИЗАБОЛЕВАНИЯ ПЕЧЕНИ Функции печени Печень, как и почки, осуществляет экскрецию и дезинтоксикапию конечных продуктов обмена веществ. Кроме того, она выполняет важные биосинтетические и метаболические функции; некоторые из них кратко рассмотрены ниже. Нарушения этих механизмов лежат в основе многих проявлений заболеваний печени, описанных в данной главе. Общие функции в процессах обмена веществ. Кровь поступает в печень через воротную вену. Все проникающие из кишечника питательные вещества, за исключением жиров, прежде чем попасть в кровяное русло, проходят через синусоидальные сосудистые пространства печени. После приема пищи, когда в плазме крови из воротной вены содержание глюкозы повышено, происходит биосинтез и отложение гликогена; возможно также превращение глюкозы в жирные кислоты (рис. 25). Во время голодания концентрация глюкозы в плазме циркулирующей крови поддерживается постоянной благодаря распаду резервированного гликогена и превращению в глюкозу таких субстратов, как глицерин, лактат и аминокислоты (рис. 26 и 27). Жирные кислоты, поступающие в печень из жировых депо, могут быть метаболизированы в цикле трикарбоновых кислот, включены в состав триглицеридов или превращены в кетоновые тела (рис. 26). Функции в процессах биосинтеза. В гепатоцитах происходит биосинтез: 1) белков плазмы крови, за исключением иммуноглобулинов; 2) большинства факторов свертывания крови, из числа которых протромбин, а также VII, IX и Х факторы не могут быть синтезированы в отсутствие витамина К; 3) липопротеины ЛПОНП и ЛПВП (гл. X). При тяжелых заболеваниях печени содержание альбумина в плазме может быть понижено. Интерпретация этого явления бывает затруднена, поскольку многие внепеченочные факторы оказывают такой же эффект. Однако очень низкое содержание альбумина в плазме рассматривают как определенное указание на нарушение бпосинтетической функции печени, если нет доказательств потери больших количеств белка в условиях поражений почек, кишечника или кожи. Уровень протромбина (о котором судят по протромбиновому времени) может быть понижен либо в результате поражения клеток печени, либо при нарушении всасывания витамина К; если клетки печени функционируют адекватно, парентеральное введение этого витамина устраняет данную аномалию (см. «Холестатическая желтуха»). Экскреция и дезинтоксикация. Экскрецию билирубина мы рассматриваем ниже. К числу других веществ, инактивируемых и экскретируемых печенью, относятся: 1) аминокислоты, дезампнирующпеся в печени. При этом их аминогруппы (а также аммиак, образуемый при участии бактерий кишечника и попадающий после всасывания в кровь воротной вены) превращаются в мочевину; 2) холестерин, экскретируемый в желчь либо как таковой, либо после превращения в желчные кислоты; 3) стероидные гормоны, инактивируемые путем связывания с глюкуронатами или сульфатами и экскретируемые с мочой в виде образующихся прп такой конъюгации водорастворимых соединений; 4) многие лекарственные средства, которые метаболизируются и инактивируются в печени; некоторые из пих экскретируются с желчью. Эффективность экскреции билирубина и других конечных продуктов метаболизма зависит от ряда факторов: 1) адекватного функционирования клеток печени; 2) нормального притока и оттока крови к печени и от нее; 3) свободной проходимости желчных протоков. Тесты, предназначенные для выявления нарушений метаболических (включая биосинтетические п секреторные) функции печени, — относительно малочувствительные индикаторы заболеваний втого органа, поскольку его функциональные резервы очень велики. Функция фильтрации. Поскольку оттекающая от кишечника кровь воротной вены поступает в печень, локализация ретикуловндотелиальных купферовских клеток в печеночных синусоидах благоприятствует извлечению абсорбированных токсичных соединений. Нарушения нормального строения (в результате, например, цирроза или создания хирургическим путем портокавального шунта) позволяют таким соединениям проникать в систему кровообращения. Обмен билирубина и желтуха Желтуха представляет собой клиническое проявление повышенного содержания билирубина в плазме крови. Такое явление возможно в тех случаях, когда продуцирование билирубина превышает способность печени экскретнровать его, что бывает при следующих обстоятельствах: 1) повышенная скорость образования билирубина превышает свойственную норме способность печени к его экскреции; 2) нагрузка билирубином характерна для нормы, но поврежденные клетки печени не могут обеспечить конъюгацию и/или экскрецию всего билирубина; 3) в результате заболевания желчевыводящих путей отток желчи уменьшен в такой степени, что в кишечник не поступает конъюгированный билирубин. Мы обсудим эти причины при рассмотрении последовательности явлений, схематически изображенных на рис. 36. Образование билирубина. Когда срок существования эритроцитов в циркулирующей крови заканчивается, опи разрушаются в ретикулоэндотелиальной системе, главным образом в селезенке. 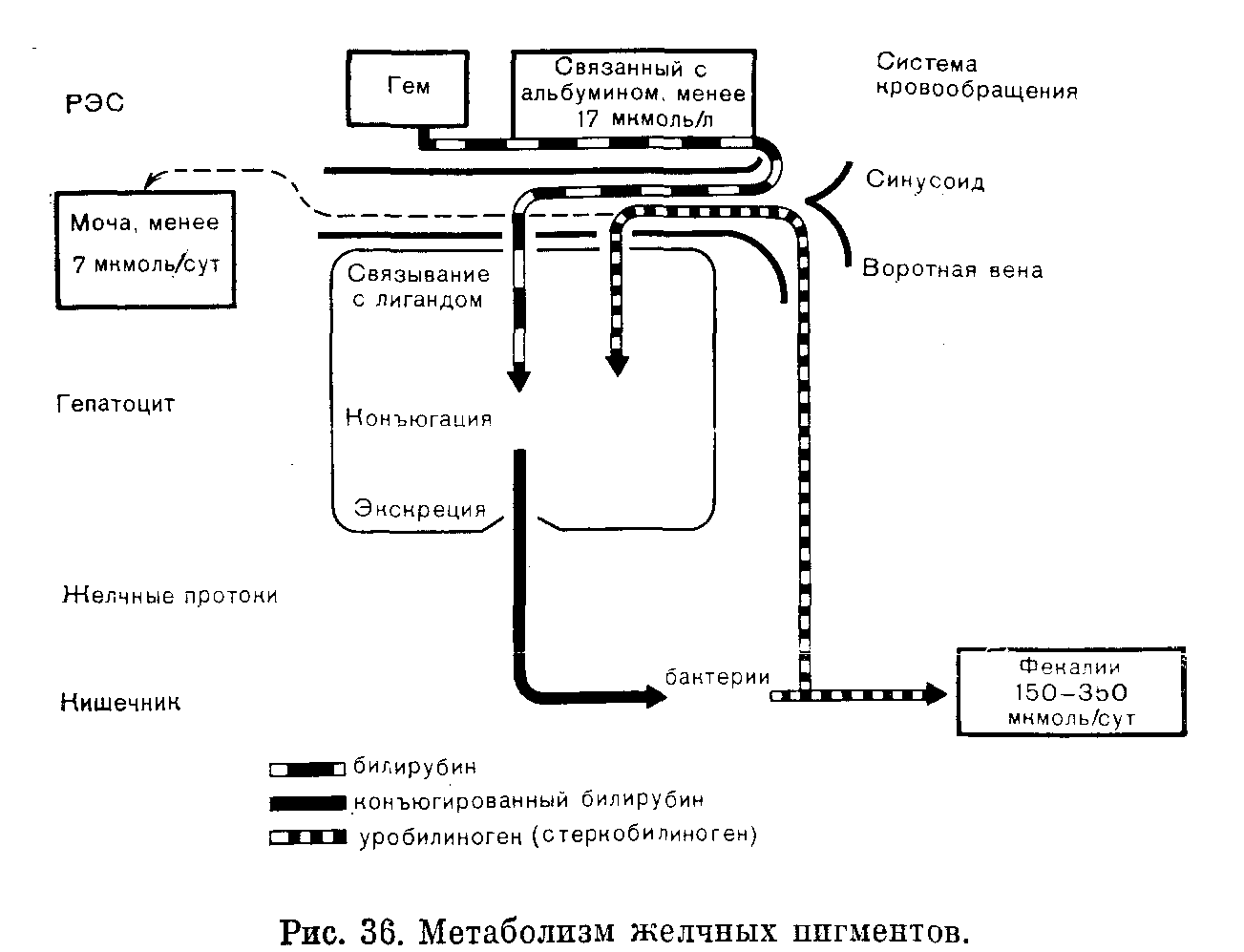 Высвобождаемый гемоглобин расщепляется до глобина, поступающего в общий фонд белков, и гема, превращающегося в билирубин после удаления железа. Это железо используется повторно. Приблизительно 80% всей массы билирубина образуется в результате процессов разрушения в ретикулоэндотелиальной системе. К числу других источников билирубина относятся распад незрелых эритроцитов в тканях костного мозга и таких химически родственных гемоглобину соединений, как миоглобин и питохромы. Этот неконъюгированный билирубин (т. е. билирубин, которому еще не была придана водорастворимость в результате конъюгации с глюкуронатом в печени) поступает в печень связанным с альбумином и у взрослых здоровых лиц составляет обнаруживаемый в плазме крови билирубин. Поскольку он связан с белком, такой билирубин не может проникать ни через почечные клубочки в мочу, ни через биомембраны мозга. Несвязанный (свободный), неконъюгированный билирубин, хотя и нерастворим в воде, растворим в липидах. Он может проникать в клетки мозга и повреждать их. У новорожденных при незрелости механизмов конъюгации в печени наиболее высока вероятность наличия концентраций свободного билирубина, превосходящих способность белка связывать его. При низком содержании альбумина в плазме или вытеснении неконъюгированного билирубина из центров связывания на поверхности альбумина высокими концентрациями жирных кислот или таких лекарственных средств, как салицилаты и сульфонамиды, возрастает доля неконъюгированного свободного билирубина, а следовательно, степень риска заметного повреждения мозга. В печени происходит перенос билирубина от альбумина плазмы через свободно проницаемую мембрану сосудистых синусов в гепатоциты, где он связывается с лигандином (Yбелком). Далее происходит активный транспорт в гладкий эндоплазматическии ретикулум и конъюгация с глюкуроновой кислотой в ходе процесса, катализируемого уридилдифосфат (УДФ)глюкуронилтрансферазой. В результате осуществления этой последовательности явлений, включающей активный транспорт и реализуемой только при наличии свободного поступления желчи, поддерживается градиент между плазмой и содержимым клеток. Другие анионы, в частности лекарственные средства, могут конкурировать за связывание с лигандином, нарушая таким образом конъюгацию и, следовательно, экскрецию билирубина. В норме за сутки приблизительно 500 мкмоль (300 мг) билирубина поступает в печень и подвергается конъюгации; клетки печени взрослого здорового человека способны справиться и со значительно большими нагрузками. Желтуха, обусловленная гипербилирубинемией (за счет неконъюгпрованного билирубина), может развиться только при следующих условиях: 1) значительное повышение нагрузки билирубином в результате гемолиза, или распада больших масс крови в тканях после кровоизлияний; 2) нарушение связывания билирубина с лигандином или недостаточность конъюгации с глюкуроновой кислотой. Поскольку неконъюгированный билирубин нерастворим в воде и в норме полностью связан с белком, он не может проникать в мочу. У больных нет билирубинурии, несмотря на повышение концентрации билирубина в плазме (ахолурическая желтуха). Экскреция билирубина с желчью. Билирубин моноглюкуронид поступает к обращенной в сторону желчных канальцев поверхности гепатоцита, где после присоединения второго остатка глюкуроната активно секретируется в желчные канальпы. Последующий транспорт зависит от нормального оттока желчи, который в свою очередь в значительной степени зависит от активной секреции желчных кислот из гепатоцитов. При поражениях печени (а также гипоксии и септицемии) и повышении давления в желчевыводящих путях наиболее высока вероятность нарушения именно этих требующих затраты энергии процессов. Повышение концентрации конъюгированного бнлирубина в плазме — наиболее раннее проявление нарушения его экскреции. У взрослого при желтухе, как правило, повышено содержание в плазме обеих фракций билирубина, но преобладает конъюгированный билирубин, который растворим в воде, менее прочно (чем свободный) связывается с белками и может экскретироваться с мочой. Отражая наличие в плазме конъюгированного билирубина, билирубинемия всегда является патологическим состоянием. Моча темного цвета — ранний симптом заболевания печени и желчных протоков. Уробилин. Конъюгированный билирубнн поступает в кишечник с желчью. В дистальных отделах подвздошной кишки и толстом кишечнике он подвергается при участии бактерий распаду до ряда соединений, обозначаемых собирательным термином стеркобилиноген (или уробилиноген кала). Небольшая доля этих соединений всасывается, попадает в систему портального кровообращения и преимущественно вновь экскретируется с желчью; очень маленькая фракция экскретируется с мочой в виде уробилиногена, который в свою очередь может быть окислен до уробилина. Уробилин (оген) в противоположность билирубину часто обнаруживают в моче здоровых лиц с помощью рутинных тестов, особенно в тех случаях, когда экскретпруется концентрированная моча. Содержание уробилин (оген) а в моче повышено при следующих условиях: 1) усиленного гемолиза, когда большие количества билирубина поступают в кишечник и превращаются в стеркобплиноген. При этом образуются и всасываются повышенные количества уробилиногена, и если превышается способность печени использовать его для повторной секреции, уробилиноген попадает в мочу; 2) поражения печени, что нарушает повторную экскрецию свойственных норме количеств уробилиногена в желчь. У здорового человека экскреция уробилиногена с мочой настолько изменчива, что только обнаружение очень высокой концентрации уробилиногена в моче во время острых приступов гемолиза клинически важно. Неабсорбированный стеркобилиноген окисляется до стеркобилина — пигмента, придающего коричневую окраску. Малоокрашенные фекалии поэтому можно рассматривать как признак закупорки желчных протоков. Билирубин, уробилин и стеркобилин окрашены (желчные пигменты) . Уробилиноген и стеркобилиноген бесцветны. Конъюгированный и неконъюгированный билирубин иногда обозначают, соответственно, терминами прямой и непрямой билирубин. Желчные кислоты, конечные продукты метаболизма холестерина, экскретируются с желчью, реабсорбируются в подвздошной кишке и вновь экскретируются печенью (внутрипеченочная циркуляция) . Биохимические тесты при заболеваниях печени Хотя нарушения функций печени и желчных протоков могут быть обусловлены многочисленными факторами, вариантов механизма их действия относительно мало. Природу основного патогенетического процесса можно охарактеризовать с помощью тестов, которые иногда неточно называют тестами функции печени. Их результаты, в сочетании с данными клинических наблюдений, могут указать ка целесообразность проведения дополнительных тестов (биохимических или других), которые могли бы помочь в диагностике. Возможны следующие патологические состояния (как таковые или в сочетаниях): 1) повреждения клеток печени; 2) холестаз; 3) уменьшение массы функционирующей ткани. Повреждения клеток печени. Повреждения (от очаговых некрозов до разрушения значительной части органа) могут быть выевады различными факторами: 1) инфекционными болезнями, как правило, вирусными; 2) токсинами или такими лекарственными средствами, как парацетамол (ацегамннофен), а также алкоголем. Гепатотоксинами являются некоторые применяемые в промышленности химические соединения, например, хлорированные углеводороды; 3) гипоксией и/или застоем крови, в частности, при сердечной недостаточности, сопровождающейся застойными явлениями, или при шоке. Повреждение клеток печени может также быть вторичным при длительной закупорке желчных протоков. Повреждение клеток печени (с некрозом или без него) вызывает быстрое высвобождение внутриклеточных компонентов в кровоток. Чувствительные индикаторы такого повреждения — концентрации в плазме ферментов аспартат (ACT, СГОТ) и аланин (АЛТ, СГПТ) трансаминаз. Максимальных величин их концентрации в плазме достигают при одновременном повреждении множества клеток, например, в условиях тканевой гипоксии (шока) или вирусного гепатита. В период выздоровления уровень обоих ферментов быстро снижается. Активность АЛТ, имеющей более длительный период полураспада, нормализуется последней. При прогнозировании существенны следующие 2 обстоятельства: 1) длительное сохранение повышенной, даже в небольшой степени, активности трансаминаз в плазме, указывающее на продолжающееся разрушение печеночных клеток, которое может привести к развитию хронического заболевания печени; 2) внезапное снижение очень высоких уровней трансаминаз без улучшения клинической картины может (в редких случаях) указывать на разрушение значительной массы ткани печени, так как только живые клеткн могут продолжать синтез ферментов. Соотношение в плазме активности ACT и АЛТ также может указывать на природу повреждения печени. Клетка печени содержит больше ACT, чем АЛТ, но ACT имеет как в митохондриях, так и в цитоплазме. В цитоплазме, где содержится только АЛТ, ее концентрация выше, чем ACT. Следовательно, при таких заболеваниях, как вирусный гепатит, когда первичным является повреждение клеточных мембран, в ВКЖ проникает относительно больше цитоплазматических, чем митохондриальных ферментов; поэтому в плазме активность АЛТ обычно повышена в относительно большей степени, чем ACT. При патологических состояниях, когда поражение, даже очаговое, приводит к полному разрушению клеток печени (например, при метастазах опухолей, циррозе и гипоксии), концентрации ACT относительно выше. Активное повреждение клеток печепи может вызывать повышение содержания в плазме и других ферментов (например, лактатдегидрогеназы), но изменения слишком неспецифичны, а методы их обнаружения не настолько чувствительны, чтобы иметь диагностическое значение. Холестаз. Холестаз обусловлен нарушением секреции желчи гепатоцитами, что приводит к накоплению в плазме некоторых или всех веществ, которые в норме экскретируются с желчью. Первичное поражение — нарушение секреции желчных кислот, что может быть обусловлено: обратным давлением, создающимся в ре зультате закупорки (внутри или внепеченочной) желчных протоков; угнетением секреторного механизма в условиях инфекционных болезней, воздействий лекарственных средств, гипоксии или других, часто неидентифицированных, метаболических факторов. Наиболее широко используемый ппдпкатор холестаза — содержание в плазме фермента щелочная фосфатаза (ЩФ). При холестазе стимулирован биосинтез ЩФ на синусоидальной поверхности гепатоцитов. Кроме того, если давление в желчных протоках нарастает, ЩФ, которая уже была секретпрована в желчевыводящие пути, может поступать вместе с другими компонентами желчи обратно в синусоиды и таким образом проникать в систему кровообращения. В случаях внепеченочной закупорки желчных протоков содержание ЩФ в плазме максимальное. Последствия холестаза зависят от степени его тяжести и продолжительности. Повышение концентрации в плазме желчных кислот может вызывать сильный зуд в результате их отложения в коже, тогда как понижение концентрации в просвете кишечника нарушает всасывание жиров и жирорастворимых витаминов. Уменьшение образования тех факторов свертывания крови, для синтеза которых необходим жирорастворимый витамин К, можно обнаружить на ранней стадии заболевания по удлинению протромбинового времени. Если парентеральное введение витамина К сокращает длительность протромбинового времени, то это указывает на нормальное функционирование клеток печени. Продолжительное отсутствие желчных кислот приводит к стеаторее со всеми характерными для нее последствиями. При холестазе обычно, но не всегда, происходит задержка в организме билирубина (преимущественно конъюгированного), что сопровождается желтухой и билирубинемией. Кроме того, нарушается экскреция холестерина и повышается его содержание в плазме. В тяжелых случаях холестаза, особенно при установленном билиарном циррозе, могут развиваться ксантомы. Уменьшение массы функционирующей ткани. Функциональные резервы и способность к регенерации ткани печени велики. При острых заболеваниях печени, когда поражена преобладающая масса органа, доминируют недостаточность экскреторной функции а повреждение клеток печени. Обычно регенерация клеток происходит быстро, до развития клинических симптомов, указывающих на расстройства функций печени. Хронические заболевания печени могут, однако, приводить к такому значительному уменьшению массы функционирующей ткани, что синтетические и метаболические функции оказываются заметно поврежденными. Поскольку резервная экскреторная мощность велика, оставшиеся неповрежденными клетки могут обеспечить экскрецию преобладающей массы поступающего в них билирубина, благодаря чему желтуха при этом обычно умеренная или вообще отсутствует. Если синтетическая функция угнетена значительно, то содержание альбумина в плазме понижается и протромбиновое время удлиняется. При этом в печены не происходит синтеза протромбипа даже после парентерального введения витамина К (сравните с удлинением протромбинового времени при холестатической желтухе, когда синтетическая способность как таковая часто бывает адекватной, но не происходит всасывания витамина К). В тех случаях, когда повреждена значительная масса ткани печени, появляются метаболические признаки печеночной недостаточности. |
