патфиз устно (1). Общая патофизиология патофізіологія як наука та навчальна дисципліна. Методи патофізіології
 Скачать 1.44 Mb. Скачать 1.44 Mb.
|
Коллапс. Виды. Причины.Коллапс — общее, остро развивающееся состояние, возникающее в результате значительного несоответствия ОЦК ёмкости сосудистого русла. Характеризуется недостаточностью кровообращения, первично циркуляторной гипоксией, расстройством функций тканей, органов и их систем. Непосредственной причиной коллапса является быстро развивающееся значительное превышение ёмкости сосудистого русла по сравнению с ОЦК. Причины коллапса• При снижении величины выброса крови из желудочков сердца в сосудистое русло развивается кардиогенный коллапс. Это наблюдается при: - острой сердечной недостаточности (вызываемой ишемией и инфарктом миокарда, значительной бради- или тахикардией); - состояниях, затрудняющих приток крови к сердцу (при стенозах клапанных отверстий, эмболии или стенозе сосудов системы лёгочной артерии); - наличии препятствий для выброса крови из левого желудочка (наиболее часто при стенозе клапанного отверстия устья аорты). • При уменьшении ОЦК развивается гиповолемический коллапс. К этому приводят: - острое массивное кровотечение; - быстрое и значительное обезвоживание организма (при профузном поносе, отравлениях, повышенном потоотделении, неукротимой рвоте); - потеря большого объёма плазмы крови (например, при обширных ожогах); - перераспределение крови с депонированием значительного её количества в венозных сосудах, кровеносных синусах и капиллярах (например, при шоке, гравитационных перегрузках, некоторых интоксикациях). • При снижении общего периферического сосудистого сопротивления развивается вазодилатационный коллапс. Это может произойти при тяжёлых инфекциях, интоксикациях, гипертермии, эндокринопатиях (при гипоти-реоидных состояниях, острой и хронической надпочечниковой недостаточности), неправильном применении ЛС (например, симпатолитиков, ганглиоблокаторов, наркотиков, антагонистов кальция), гипокапнии, избытке в крови аденозина, гистамина, кининов, глубокой гипоксии и ряде др. Основные звенья патогенеза и проявления коллапса . • Нарушение функции ССС является инициальным и главным патогенетическим звеном коллапса и характеризуется неадекватностью кровоснабжения органов и тканей. Типичны следующие циркуляторные расстройства: - сниженные ударный и сердечный выбросы крови; - острая артериальная гипотензия; - венозная гиперемия; - перераспределение кровотока (депонирование крови в ёмкостных сосудах брюшной полости, лёгких, селезёнки и гипоперфузия мозга, сердца, других органов); - нарушения микроциркуляции крови и лимфы; - развитие капиллярно-трофической недостаточности. • Расстройство функций нервной системы. Имеет важную патогенетическую значимость. Коллапс, как правило, сопровождают: - заторможенность; - апатия, безучастность к происходящему; - тремор пальцев рук; - иногда судороги; - гипорефлексия; - обморок при значительной гипоперфузии и гипоксии мозга. Нарушения газообменной функции лёгких при коллапсе. Об этом свидетельствуют: - частое и поверхностное дыхание; - гипоксемия; - гиперкапнии в оттекающей от лёгких крови. Расстройство экскреторной функции почек при коллапсе. Учитывая, что коллапс характеризуется острой системной артериальной гипотензиеи и в связи с этим — гипоперфузией почек, у пациентов часто выявляется: - олигурия; - гиперстенурия; - гиперазотемия. Расстройства систем крови и гемостаза при коллапсе: - гиповолемия; - повышение вязкости крови (в связи с выходом её жидкой части через стенки сосудов, проницаемость которых в условиях гипоксии увеличена); - гиперагрегация тромбоцитов и эритроцитов; - образование тромбов; - развитие феномена сладжа. 98. Недостатність серця внаслідок перевантаження. Причини перевантаження серця об’ємом та опором. Патофізіологічна характеристика порушень гемодинаміки при різних вадах серця. Механізми негайної та довготривалої адаптації серця до надмірного навантаження: тахікардія, гіперфункція (гетеро-, гомеометрична), гіпертрофія міокарда. Гіпертрофія серця: види, причини, механізми розвитку, стадії (за Ф.З. Меерсоном). Особливості гіпертрофованого міокарда, причини та механізми його декомпенсації. 27.6. Какие типы перегрузок сердца могут быть причиной развития его недостаточности? Выделяют два типа перегрузок сердца. 1. Перегрузка объемом возникает тогда, когда к сердцу или к отдельным его полостей притекает увеличен объем крови. В этих условиях сердце или его отдел, испытывающий перегрузки, имеют перемещать увеличенный объем крови в артериальную систему. Это достигается увеличением минутного объема сердца в соответствии с увеличенного венозного возврата. Перегрузка объемом возникает при: а) увеличении венозного возврата крови к сердцу, в частности при увеличении объема циркулирующей крови (гиперволемия) или увеличении тонуса венозных сосудов (уменьшение емкости венозной системы); б) пороках сердца - недостаточности его клапанов. Так, при недостаточности аортального и двустворчатого клапанов развивается перегрузки левого желудочка, при недостаточности клапана легочной артерии и трехстворчатого клапана - перегрузка правого желудочка. 2. Перегрузка сопротивлением возникает тогда, когда сердце или отдельные его отделы вынуждены выполнять работу против увеличенного сопротивления, препятствует перемещению всей крови в артериальную систему. При перегрузке сопротивлением сердце должно сохранить свой минутный объем, несмотря на возросший сопротивление изгнанию крови. Перегрузка сопротивлением развивается при: а) увеличении артериального давления (увеличении периферического сосудистого сопротивления). При гипертензии большого круга кровообращения перегрузки сопротивлением действует на левый желудочек, а при гипертензии малого круга - на правый желудочек; б) пороках сердца - стенозах клапанных отверстий. "Да, при стенозе отверстия аорты развивается перегрузки левого желудочка, при стенозе отверстия двустворчатого клапана - левого предсердия, при стенозе отверстия легочной артерии - правого желудочка, при стенозе отверстия трехстворчатого клапана - правого предсердия. 27.7. Какие механизмы могут обеспечивать компенсацию сердца при воздействии на него увеличенных нагрузок? При воздействии на сердце нагрузок объемом и сопротивлением увеличение работы сердца обеспечивается двумя типами компенсаторных механизмов. I. Срочные механизмы компенсации сердца. К ним относят: а) гетерюметричтш механизм; б) гомеометричний механизм; в) хроноинотропний механизм ;. г) инотропное действие катехоламинов. II . Механизмы долговременной адаптации сердца - гипертрофия миокарда. 27.8. В чем сущность гетерометричного механизма компенсации сердца? Гетерометричпиии механизм является одним из немедленных механизмов компенсации сердца к действию нагрузок объему. Его сущность заключается в увеличении силы сердечных сокращений в условиях поступления к сердцу увеличенного объема крови. Основу Гетерометрический механизма составляет закон Франка-Старлинга. Он имеет два формулировка: для отдельных мышечных волокон и для сердца в целом. В первом варианте его сущность выражено следующим положением: чем больше исходная длина м мышечного волокна (в определенных пределах), тем больше сила его сокращений. Для сердца в целом употребляемым является формулировка: чем больше конечнодиастолический объем желудочков сердца, тем больше их ударный объем. Основными проявлениями Гетерометрический механизма компенсации является увеличение кон цеводиастоличного давления за счет увеличения поступления крови в полости желудочков и увеличение ударного, а следовательно, и минутного объемов сердца за счет увеличения силы сердечных сокращений. Напряжение мышечных волокон миокарда при этом не меняется. Меняется только их длина, отсюда название механизма - гетерометрический. 27.9. В чем сущность гомеометричного механизма компенсации сердца? Гомеометричний механизм является немедленным механизмом компенсации сердца к действию нагрузок сопротивлением. Его сущность заключается в увеличении силы сердечных сокращений в условиях увеличения сопротивления изгнанию крови. Сейчас показано, что в основе этого механизма, как и Гетерометрический, закон Фран-ка-Старлинга, то есть увеличение исходной длины волокон миокарда и связанное с этим увеличение кинцеводиастоличного давления. Становление гомеометричного механизма происходит в такой последовательности. При увеличении сопротивления изгнанию крови резко падает ударный объем, вследствие чего увеличивается кинцевосистоличний объем желудочков. Поскольку поступления крови в желудочки продолжает оставаться предыдущим, то в следующем цикле сокращений сердца увеличивается конечнодиастолический объем. А это по закону Франка-Старлинга ведет к увеличению силы сокращений сердца. Для гомеометричного механизма характерны следующие изменения показателей кардиодинамикы: а) увеличение кинцевосистоличного объема; б) увеличение кинцеводиастоличного объема за счет первичного повышения предыдущего показателя, а не за счет увеличения притока крови, как при гетеро- метрическом механизме; в) ударный, а следовательно, и минутный объемы за счет увеличения силы сердечных сокращений остаются на прежнем уровне, несмотря на увеличение сопротивления изгнанию крови. При гомеометричному механизме увеличивается напряжение мышечных волокон миокарда, тогда как их длина не меняется. Отсюда название механизма компенсации - го-меометричний. 27.10. Чем характеризуется хроноинотропний механизм компенсации сердца? Хроноинотропний механизм (феномен "ступенек", феномен Боудича) является одним из немедленных механизмов компенсации сердца к действию повышенных нагрузок. Его сущность заключается в том, что при увеличении частоты сокращений сердца увеличивается сила его сокращений. При этом одновременно уменьшается время расслабления миокарда, способствует быстрому наполнению желудочков сердца кровью. Сейчас считается, что основу хроноинотропного механизма составляет увеличение поступления ионов кальция в саркоплазму кардиомиоцитов во время потенциалов действия, суммарная продолжительность которых при тахикардии растет. Повышение концентрации ионов кальция в саркоплазме приводит к увеличению количества создаваемых кальций-тропонинового комплексов и, как следствие, к увеличению силы сокращений мышечных волокон. Для хроноинотропного механизма характерны следующие изменения показателей кардиодинамикы: а) ударный объем увеличивается (при нагрузке объемом) или остается постоянным (при нагрузке сопротивлением). В результате увеличения частоты сердечных сокращений возрастает минутный объем сердца, б) конечнодиастолический объем уменьшается, если приток крови к сердцу постоянный, или остается без изменений, если приток крови возрастает; в) кинцевосистоличний объем уменьшается. 27.11. Какова роль катехоламинов в осуществлении механизмов немедленной компенсации сердца? Участие катехоламинов в осуществлении немедленной адаптации сердца к повышенным нагрузкам связана со способностью адреналина и норадреналина непосредственно увеличивать силу сердечных сокращений - с положительным инотропным эффектом. Установлено, что под влиянием катехоламинов увеличивается количество Са-каналов сарколеммы, способных открываться во время потенциала действия (катехоламины через цАМФ-опосредованный механизм вызывают фосфорилирования белков Са-каналов). В результате этих процессов увеличивается поступление ионов кальция в саркоплазму, где повышается их концентрация, и, как следствие, увеличивается сила сокращений кардиомиоцы-тов, поскольку растет количество создаваемых кальций-тропонинового комплексов. Инотропное действие катехоламинов (а не закон Франка-Старлинга) является ведущим механизмом адаптации сердца к физическим нагрузкам. При этом показатели кардиодинамикы изменяются следующим образом: а) увеличивается ударный объем; б) увеличивается минутный объем сердца как за счет увеличения ударного объема, так и за счет увеличения частоты сердечных сокращений (положительный хронотроп ный эффект катехоламинов) в) уменьшается конечнодиастолический объем (при рентгеновском исследовании определяется уменьшение объема сердца) г) уменьшается конечно систолический объем. 27.12. Назовите варианты долгосрочной адаптации сердца к действию нагрузок. По Ф. Меерсон, выделяют три варианта долговременной адаптации сердца. 1. Гипертрофия сердца у спортсменов ( "адаптированное" сердце). Развивается при периодических нагрузках, интенсивность которых постепенно возрастает, то есть в условиях тренировок. Есть сбалансированной гипертрофией, при которой равномерно увеличиваются все компоненты сердца. Благодаря такой гипертрофии существенно увеличиваются функциональные резервы сердца. 2. Компенсаторная гипертрофия сердца ( "переадаптоване" сердце). Является следствием патологических процессов, имеющих отношение к сердцу. Различают два вида компенсаторной гипертрофии: а) гипертрофию от перегрузок (развивается при пороках сердца, артериальной гипертензии) б) гипертрофию от повреждения (характерная для атеросклеротических поражений, миокардиопатии). Развитие компенсаторной гипертрофии сердца характеризуется следующими особенностями: 1) патогенный фактор, вызывающий гипертрофию, действует постоянно; 2) компенсаторная гипертрофия, в отличие от гипертрофии сердца у спортсменов, является несбалансированной; 3) при компенсаторной гипертрофии впоследствии развивается недостаточность сердца. 3. Атрофия миокарда ( " dead агитоване" сердце). Характеризуется уменьшением массы сердца в результате длительной гипокинезии и уменьшения нагрузок на сердце. 27.13. Какие механизмы лежат в основе развития гипертрофии сердца? При длительном повышении нагрузки на сердце развивается его гиперфункция, что впоследствии вызывает структурные изменения в сердце - гипертрофию миокарда. Наиболее доказательной теорией, объясняющей механизмы перехода гиперфункции сердца в его гипертрофию, является концепция Ф. Меерсон (рис. 121). Р 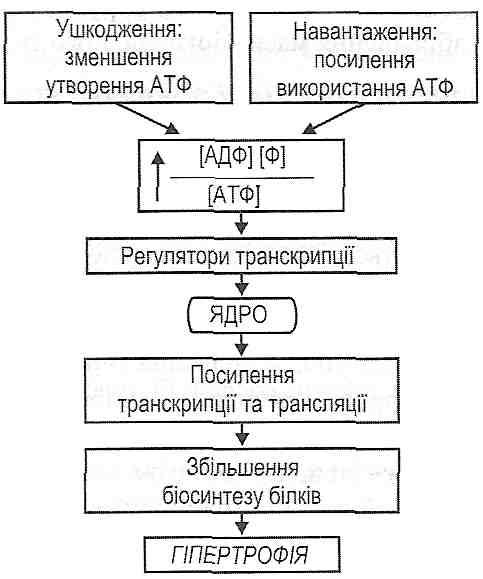 ис. 121. Механизмы компенсаторной гипертрофии миокарда ис. 121. Механизмы компенсаторной гипертрофии миокардаСогласно этой концепции, главным звеном, связывающим повышение функции клетки с работой ее генетического аппарата, является увеличение потенциала фосфорилирования (ПФ): где [АДФ], [Ф], [АТФ] - концентрации в цитоплазме клеток в соответствии АДФ, неорганического фосфата и АТФ. ПФ закономерно увеличивается в двух случаях: а) при усиленном использовании АТФ, что всегда наблюдается при увеличении функциональной нагрузки на клетки (при их гиперфункции) б) при нарушениях образования АТФ, что характерно для различных видов повреждения клеток. Увеличение показателя ПФ вызывает появление в клетках веществ - регуляторов транскрипции, которые, воздействуя на геном клетки, усиливают синтез информационной РНК на матрице генов, кодирующих структуру функционально важных белков кли- тины, в том числе сократительных белков и ферментов. На роль веществ - регуляторов транскрипции претендует целый ряд метаболитов, среди которых цАМФ, креатин, ионы Mg 2+ , полиамины (спермин, спермидин) и др. Таким образом, развитие гипертрофии сердца можно описать такой последовательностью процессов: увеличение нагрузки на сердце (гиперфункция) → усиленное использование АТФ, превышает интенсивность его ресинтеза → увеличения потенциала фосфорилирования → появление или увеличение концентрации в клетках веществ - регуляторов транскрипции → рост интенсивности синтеза информационной РНК и процессов трансляции в рибосомах → усиление биосинтеза структурных, функциональных белков и белков-ферментов → увеличение массы миокарда, его гипертрофия. 27.14. Какие стадии выделяют в процессе развития компенсаторной гипертрофии сердца? Дайте их характеристику. По динамике изменений обмена, структуры и функции миокарда в развитии компенсаторной гипертрофии сердца выделяют три основные стадии (Ф. Мсерсон). 1. Аварийная стадия. Развивается непосредственно после повышения нагрузки, характеризуется сочетанием патологических изменений в миокарде (исчезновение гликогена, снижение уровня креатинфосфата, уменьшение содержания внутриклеточного калия и повышение содержания натрия, мобилизация гликолиза, накопление лактата) с мобилизацией резервов миокарда и организма в целом. В этой стадии повышается нагрузка на единицу мышечной массы, а следовательно, интенсивность функционирования структур (ИФС), происходит быстрое, в течение недель, увеличение массы сердца за счет усиленного синтеза белков и утолщение мышечных волокон. 2. Стадия завершенной гипертрофии и относительно устойчивой гиперфункции. В этой стадии процесс гипертрофии завершен, масса миокарда увеличена на 100-120% и дальше не растет, ИФС нормализуется. Патологические изменения в обмене веществ и структуре миокарда не выявляются, потребление кислорода, образование энергии, содержание макроэргических соединений не отличаются от нормы. Нормализуются гемодинамические нарушения. Гипертрофированное сердце приспособилось к новым условиям нагрузки в течение длительного времени компенсирует их. 3. Стадия постепенного истощения и прогрессирующего кардиосклероза. Характеризуется глубокими метаболическими и структурными изменениями, которые медленно накапливаются в енергоутворюючих и сократительных элементах клеток миокарда. Часть мышечных волокон погибает и замещается соединительной тканью, ИФС снова возрастает. Нарушается регуляторный аппарат сердца. Прогрессирующее истощение компенсаторных резервов приводит к возникновению хронической недостаточности сердца, а в дальнейшем - к недостаточности кровообращения. 27.15. Какие особенности гипертрофированного сердца является предпосылкой развития его декомпенсации? Гипертрофированное сердце отличается от нормального рядом обменных, функциональных и структурных признаков, которые, с одной стороны, дают ему возможность длительное время преодолевать повышенную нагрузку, а с другой - создают предпосылки для возникновения патологических изменений. 1. Увеличение массы сердца происходит за счет утолщения каждого мышечного волокна, сопровождается изменением соотношения внутриклеточных структур. Объем клетки при этом увеличивается пропорционально кубу линейных размеров, а поверхность - пропорционально их квадрату, что приводит к уменьшению клеточной поверхности на единицу массы клетки. Известно, что через поверхность клетки происходит ее обмен с внеклеточной жидкостью - поглощение кислорода, питательных веществ, выведение продуктов метаболизма, обмен воды и электролитов. Указанные выше изменения создают условия для ухудшения снабжения м мышечного волокна, особенно его центральных отделов. 2. Клеточная мембрана играет важную роль в проведении возбуждения и сопряжении процессов возбуждения и сокращения, осуществляется через канальцевую систему и сар-коплазматичний ретикулум. Поскольку рост этих образований при гипертрофии мышечного волокна также отстает, то создаются предпосылки для нарушения процессов сокращения и расслабления кардиомиоцитов: вследствие замедления выхода ионов кальция в саркоплазму ухудшается сокращение, а в результате затруднения обратного транспорта ионов кальция в саркоплазматическая ретикулум - расслабление, иногда могут возникать локальные контрактуры отдельных кардиомиоцитов. 3. При гипертрофии объем клетки возрастает в большей степени, чем объем ядра. Поскольку роль ядра заключается в обеспечении белкового синтеза, а следовательно, и процессов восстановления внутриклеточных структур, то относительное уменьшение объема ядра (если сравнивать с цитоплазмой) может приводить к нарушению синтеза белков и ухудшение пластического обеспечения клетки. 4. В процессе развития гипертрофии масса митохондрий сначала увеличивается быстрее, чем масса сократительных белков, создавая условия для достаточного энергетического обеспечения и надлежащей компенсации функции сердца. Однако в дальнейшем, по мере усиления процесса, увеличение массы митохондрий начинает отставать от роста массы цитоплазмы. Митохондрии начинают работать с предельной нагрузкой, у них развиваются деструктивные изменения, снижается эффективность их работы, нарушается окислительное фосфорилирования. Это ведет к ухудшению энергетического обеспечения гипертрофированной клетки. 5. Увеличение массы мышечных волокон чаще всего не сопровождается адекватным увеличением капиллярной сети, особенно в случаях быстрого развития недостаточности сердца. Большие венцы артерии также не могут обеспечить необходимое приспособления. Поэтому во время нагрузки ухудшается сосудистое обеспечение гипертрофированного миокарда. 6. При развитии гипертрофии миокарда в процесс обязательно вовлекается нервный аппарат сердца. Наблюдается усиленное функционирование внутрисердечных и экстракардиальных нервных элементов. Однако рост нервных окончаний отстает от увеличения массы сократительного миокарда. Происходит истощение нервных клеток, нарушаются трофические влияния, уменьшается содержание норадреналина в миокарде, что ведет к ухудшению его сократительных свойств, затруднение мобилизации его резервов. Итак, нарушается (регуляторное обеспечение сердца. 7. Гипертрофированное сердце за счет увеличения массы его сократительного аппарата и систем энергообеспечения способно длительное время выполнять значительно большую работу, чем сердце нормальное, сохраняя при этом нормальный метаболизм. Однако способность приспосабливаться к нагрузкам изменяющимся диапазон адаптационных возможностей в гипертрофированного сердца ограничены, уменьшен функциональный резерв. Это делает гипертрофированное сердце через указанную выше несбалансированность внутриклеточных и тканевых структур более уязвимым в различных неблагоприятных обстоятельствах. 99. Міокардіальна форма серцевої недостатності. Коронарогенні ушкодження міокарда. Недостатність вінцевого кровообігу (відносна та абсолютна; гостра та хронічна), механізми розвитку. Поняття про «критичний стеноз». Наслідки ішемії міокарда: депресія скоротливої активності, електрична нестабільність, пошкодження/некроз кардіоміоцитів, додаткове пошкодження при реперфузії. Ішемічна хвороба серця як прояв вінцевої недостатності, її різновиди. Клініко-лабораторні критерії, прояви та ускладнення інфаркту міокарда. Патогенез кардіогенного шоку. Принципи профілактики і лікування ішемічної хвороби серця. 27.16. Чем может быть обусловлен развитие миокардиальной недостаточности сердца? Миокардиальная недостаточность сердца развивается в результате первичных поражений миокарда. Поскольку миокард состоит из двух типов мышечных волокон - атипичных, составляющие проводниковую систему сердца, и сократительных клеток рабочего миокарда- то развитие недостаточности сердца может быть связан с повреждением как первых, так и вторых. Отсюда можно выделить два варианта миокардиальной недостаточности сердца: а) обусловленную поражением проводящей системы сердца - аритмичную ; б) обусловленную повреждением рабочего миокарда. Иногда ее называют миокардиопатичною . 27.45. Какими особенностями характеризуется венечный кровообращения сердце? 1. Высокий уровень экстракции кислорода в капиллярах сердца. В сердце экстрагируется 70-75% 0 2 , поступающего с артериальной кровью, тогда как в тканях головного мозга - 25%, в скелетных мышцах и печени - около 20%, в почках - 10%. Высокий уровень изъятия 0 2 в сердце объясняется значительной длиной его капилляров и в связи с этим - большим временем контакта крови со стенкой капилляров. При увеличении потребности сердца в кислороде она не может быть удовлетворена увеличением экстракции 0 2 (как в скелетных мышцах), поскольку последняя и так максимально возможной в состоянии покоя. Поэтому для обеспечения увеличенных энергетических потребностей сердца остается только один путь - увеличение коронарного кровообращения. 2. Высокий базальный тонус коронарных сосудов. Он дает возможность в состоянии покоя обеспечивать венечный кровообращение на уровне 250-300 мл / мин, что составляет около 5% минутного объема крови. Высокий базальный тонус коронарных сосудов обусловливает высокий резерв коронарного кровообращения. Так, при уменьшении базального тонуса сосудов сердца Интенсивность кровообращения в них может расти в 7-10 раз. 3. Фазный характер коронарного кровообращения, связанный с периодами сердечного цикла. Во время систолы происходит сдавливание интрамуральных сосудов - кровообращение минимальный и составляет около 15% общего коронарного кровообращения. Во время диастолы сдавливания сосудов прекращается и кровообращение становится максимальным (около 85% общей величины). Фазность коронарного кровообращения наиболее выражена в субэндокардиального зоне миокарда (всего сдавливания сосудов) и наименее выражена - в субэпикардиальный зоне. 4. Подчиненность коронарного кровообращения метаболическим потребностям сердца и относительная независимость его от нервных регуляторных воздействий. В условиях патологии эта подчиненность часто нарушается и увеличивается чувствительность коронарных сосудов к нервных импульсов. 5. Исключительно высокая чувствительность коронарных сосудов к уменьшению напряжения кислорода в крови. Уменьшение р0 2 артериальной крови всего лишь на 5% существенно увеличивает интенсивность коронарного кровообращения. 6. Недостаточное развитие коллатеральных сосудов. При неблагоприятных условиях Кола-ралли в сердце не могут компенсировать нарушения кровотока в коронарных сосудах, поэтому коллатеральное кровообращение здесь функционально неполноценный. 27.46. Как осуществляется регуляция коронарного кровообращения? В регуляции коронарного кровообращения различают миогенную ауторегуляцию, метаболическую и нервную регуляцию. 1. Миогенная ауторегуляция. ее основу составляет закон Бейлиса, согласно которому при растяжении гладких мышц кровеносных сосудов увеличивается сила их сокращения. Миогенная ауторегуляция обеспечивает постоянство коронарного кровообращения и относительную независимость его от изменений артериального давления. Так, при увеличении давления крови в аорте увеличивается растяжения гладкомышечных клеток коронарных артерий, ведет к сокращению, повышение тонуса артерий и сохранение постоянства кровообращения. При уменьшении артериального давления венечный кровообращение поддерживается на постоянном уровне благодаря расслаблению гладких мышц и расширению артерий. Сейчас показано, что при растяжении гладкомышечных клеток сосудов увеличивается проницаемость их плазматической мембраны к ионам кальция. Последние проникают в клетки и вызывают их сокращение. 2. Метаболическая регуляция. Подчиняет венечный кровообращение метаболическим потребностям сердца. Осуществляется с помощью целого ряда ионов и метаболитов, среди которых ионы водорода, калия, молочная кислота, простагландины. Однако наибольшее значение имеют два фактора: уменьшение напряжения 0 2 в артериальной крови и аденозин. Последний образуется в результате гидролиза адениновых нуклеотидов при гипоксии и при усиленной работе сердца. Будучи естественным блокатором Са-каналов, аденозин уменьшает поступление ионов Са 2+ в цитоплазму гладкомышечных клеток коронарных сосудов, вследствие чего уменьшается степень их сокращения и падает базальный тонус - венечные сосуды расширяются, коронарное кровообращение возрастает (рис. 129). 3. Нервная регуляция. Нейрогенный тонус коронарных сосудов незначительный, о чем свидетельствует почти полное отсутствие изменений коронарного кровообращения после полной денерва-ции сосудов сердца. Гораздо большее значение имеет косвенное влияние нервной системы на коронарное кровообращение. Он осуществляется через изменения работы сердца и интенсивности обмена веществ в нем. В эксперименте показана возможность и непосредственного влияния нервов на тонус коронарных сосудов. Так, при раздражении парасимпатических нервов и введении ацетилхолина происходит незначительное расширение коронарных артерий. Медиаторы симпатической нервной системы (катехоламины) при воздействии на а-адренорецепторы вызывают сужение сосудов, а воздействуя на р-адренорецепторы - расширение. Поскольку в норме в венечных сосудах преобладают β-адренорецепторы, то общий эффект симпатических влияний - незначительное расширение сосудов сердца. 27.47. Что такое недостаточность коронарного кровообращения? Чем отличаются относительная и абсолютная коронарная недостаточность? Недостаточность коронарного кровообращения - это патологическое состояние, характеризующееся неспособностью венечных сосудов обеспечивать кровоснабжение сердца в соответствии с его энергетических потребностей. Иначе говоря, возникает несоответствие между энергетическими потребностями сердца и доставкой кислорода и питательных веществ коронарной сосудами. Недостаточность коронарного кровообращения может быть относительной и абсолютной. Относительная коронарная недостаточность возникает в случае первичного увеличения энергетических потребностей сердца (увеличение нагрузки на сердце при физической работе, артериальной гипертензии). При таких обстоятельствах интенсивность коронарного кровообращения может расти, но этого бывает недостаточно, чтобы удовлетворить потребности сердца. Абсолютная коронарная недостаточность возникает в случае первичного нарушения коронарного кровообращения, в результате чего уменьшается доставка кислорода и питательных веществ миокарда как в состоянии покоя, так и при увеличении энергетических потребностей сердца. 27.48. Какие патогенетические факторы могут обусловливать развитие абсолютной недостаточности коронарного кровообращения? Интенсивность коронарного кровообращения определяется формулой где Q - объемная скорость течения крови Р а и Р ВСН - давление крови соответственно в начале и в конце системы венечных сосудов; (Р а - Р) - перфузионное давление; R - сопротивление коронарных сосудов. Поскольку абсолютная коронарная недостаточность характеризуется уменьшением интенсивности коронарного кровообращения (уменьшением Q ), возможны два патогенетических варианта ее развития. И. Уменьшение перфузионного давления. При этом развивается коронарная недостаточность центрального происхождения. ее причинами могут быть: а) артериальная гипотензия (снижение Р а п ), например, при всех видах шока, коллапсе, недостаточности аортальных клапанов. При уменьшении артериального давления срабатывают механизмы миогенная ауторегуляции коронарного кровообращения, поддерживающих его на постоянном уровне. Однако, когда артериальное давление падает ниже 70 мм рт. ст., эти механизмы оказываются несостоятельными; б) нарушение венозного оттока (увеличение Р вен ). В эксперименте моделируют перевязкой вен сердца. Может иметь значение при декомпенсированной недостаточности правого желудочка, когда увеличивается центральный венозный и конечнодиастолический давление. II. Увеличение сопротивления коронарных сосудов. При этом развивается коронарная недостаточность местного происхождения.поскольку 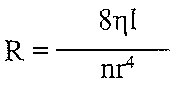 где tj - вязкость крови 1 - длина сосудов; г - радиус сосудов, то увеличение сопротивления может быть обусловлено: а) увеличением в "вязкости крови при нарушении ее реологических свойств (обезвоживание, полицитемия, ДВС-синдром). При этом развиваются нарушения микроциркуляции, до сладж-синдрома и истинного капиллярного стаза; : Б) уменьшением радиуса сосудов.Это основной фактор развития абсолютной коронарной недостаточности. Он вызывает ишемию сердца. 27.49. Какие механизмы могут лежать в основе развития ишемии миокарда? I. Обтурационная механизм - уменьшение просвета коронарных артерий. Его причинами могут быть: а) стенозуючш атеросклероз (является причиной ишемии миокарда в 90% случаев); б) тромбоз коронарных артерий (чаще всего является следствием атеросклероза); в) эмболия коронарных артерий г) воспалительные процессы в стенке сосудов сердца - коронарииты. Бывают при ревматизме, сифилисе. Для развития клинических признаков ишемии миокарда имеет значение величина «критического стеноза". Это минимальное уменьшение просвета сосудов, при котором возникает ишемия. У человека этот показатель составляет 75% (у свиней - меньше, у собак - больше). II. Ангиоспастический механизм- спазм венечных сосудов. Его причинами могут быть: а) возбуждения а-адренорецепторов на фоне блокады р-адренорецепторов; б) вазопрессин; в) ангиотензин II, г) тромбоксан ^; г) гипокапния; д) эндотелий - биологически активное вещество эндотелиального происхождения. Существует клиническая форма коронарного ангиоспазма - стенокардия Принцметала. III. Компрессионный механизм - сдавливание коронарных сосудов. Может иметь место при тахикардии (увеличивается общая продолжительность периода сдавливания венечных сосудов во время систолы сердца). Иногда его причиной является рубцы и опухоли. В эксперименте используют для моделирования ишемии и инфаркта миокарда путем наложения лигатуры на венечные артерии. 27.50. Какие патогенетические факторы влияют на миокард в условиях коронарной недостаточности? 1. Гипоксия. 2. Ацидоз. Развивается в результате накопления кислых продуктов обмена веществ вследствие нарушения оттока крови и активации гликолиза. 3. Увеличение внеклеточной концентрации ионов калия в зоне ишемии. Проявляют изначально нарушений коронарного кровообращения (через несколько минут), когда еще нет повреждения кардиомиоцитов. В этот период по неизвестным еще причинам происходит пассивный выход ионов калия из клеток (возможно, увеличивается проницаемость К-каналов), и его внеклеточная концентрация возрастает до 8 ммоль / л и более. Через несколько часов "утечки" ионов К + из клеток может быть обусловлено нарушением работы Na-K-насосов (дефицит АТФ) и увеличением проницаемости поврежденных мембран. 27.51. Какие последствия для миокарда может иметь недостаточность коронарного кровообращения? 1. Нарушение сократительной способности миокарда с развитием недостаточности сердца. 2. Появление аномальной электрической активности - электрическая нестабильность сердца, развитие аритмий. 3. Повреждение кардиомиоцитов, обусловленное ишемией (см. Разд. 11). 4. реперфузионного синдрома. 27.52. Нарушения сократительной функции миокарда могут возникать при его ишемии? При ишемии миокарда различают ранние и поздние нарушения его сократительной функции. Ранние нарушения возникают очень рано, уже при незначительном дефиците АТФ. Они являются отражением гипокальциевоговарианта нарушений сократительной функции сердечной мышцы и развиваются в результате блокады Са-каналов сарколеммы кардиомиоцитов. Нарушение проводимости Са-каналов в условиях ишемии имеет по меньшей мере два механизма: а) дефицит АТФ → нарушение фосфорилирования белков Са-каналов; б) активация гликолиза → накопления в клетках ионов Н + → непосредственная блокада Са-каналов. Следствием указанных нарушений является уменьшение поступления ионов Са 2+ в саркоплазму мышечных волокон, расстройства электромеханического сопряжения, уменьшение силы сокращений кардиомиоцитов. Поздние нарушения сократительной функции возникают при длительных расстройствах коронарного кровообращения - более ЗО мин. их относят к гиперкальциевого (контрактурных) типа нарушений. Концентрация ионов кальция в саркоплазме кардиомиоцитов увеличивается по двум основным причинам: а) нарушение удаления ионов Са 2+ с саркоплазмы вследствие дефицита АТФ б) увеличение поступления ионов Са 2+ в мышечные волокна через поврежденную плазматическую мембрану клеток. В результате увеличения содержания Са 2+ нарушаются процессы расслабления кардиомиоцитов, наступает контрактура миофибрилл, нарушается сократительная способность сердца. 27.53. Какие механизмы могут обусловливать развитие аритмий при ишемии миокарда? Развитие аритмии связан с электрической нестабильностью сердца, возникающая уже через несколько минут после начала развития ишемии миокарда. Основная ее причина - выход ионов калия из кардиомиоцитов, в результате чего увеличивается их внеклеточная концентрация. Это вызывает частичную деполяризацию сарколеммы клеток, находящихся рядом. В зависимости от уровня повышения содержания внеклеточного калия возможны такие последствия: а) в участках миокарда, где концентрация внеклеточного калия увеличивается до 8 ммоль / л, мембранный потенциал уменьшается от -90 мВ до -80 мВ, приближаясь к уровню критического потенциала деполяризации. Поэтому в этих участках увеличивается возбудимость клеток и скорость проведения импульсов; б) в участках миокарда, где внеклеточная концентрация калия превышает 8 ммоль / л, мембранный потенциал мышечных волокон становится меньше -80 мВ, уменьшается проводимость Na-каналов (происходит их инактивация), в результате уменьшается возбудимость кардиомиоцитов и скорость проведения импульсов. Одновременное существование различных участков миокарда с различными типами электрофизиологических нарушений (с одной стороны, увеличение возбудимости и проводимости, с другой стороны -уменьшение этих характеристик) создает условия для реализации механизмов повторного вхождения импульсов (re-entry), в результате чего могут развиваться трепетание ифибрилляция желудочков, приводящие к смерти. Фибрилляция желудочков, возникающая при ишемии миокарда, является основной причиной так называемой внезапной. При этом на вскрытии, как правило, никаких признаков ишемического повреждения миокарда не проявляют. 27.54. Что такое реперфузионный синдром? В чем его сущность? Какие механизмы его развития? Реперфузионный синдром - это синдром, возникающий в результате восстановления кровообращения в ишемизированной области миокарда, то есть в результате реперфузии. Возобновление коронарного кровообращения может быть обусловлено прекращением коронарного ангиоспазма, лизисом тромба, разрушением агрегатов клеток крови, хирургическим удалением .тромбу, снятием лигатуры. Клинически реперфузионный синдром проявляется значительным увеличением интенсивности повреждения миокарда сразу же после возобновления коронарного кровообращения. В результате состояние больного резко ухудшается. Минимальная продолжительность ишемии, после которой возникает выраженный реперфузионный синдром, составляет 40 мин. Если продолжительность ишемии менее 20 мин., Указанный синдром не развивается (такая продолжительность характерна для приступов стенокардии). При продолжительности ишемии 20-40 мин. иногда могут развиваться реперфузионного повреждения сердца. Патогенетической основой реперфузионного синдрома является так называемый "кислородный парадокс". Если осуществлять перфузию сердца раствором, не содержит кислорода (или содержит его мало), а через 40 мин. и более перейти на перфузию раствором с нормальным напряжением В г , то в результате такой перфузии нарушения, обусловленные предыдущей гипоксией, не только не уменьшаются, как этого следовало бы ожидать, а становятся более выраженными (парадокс!). В основе указанного парадокса резкая активация процессов перекисного окисления липидов, обусловлена поступлением кислорода в клетки, в которых содержится большое количество восстановленных компонентов дыхательной цепи. Происходит сброс электронов в обход дыхательной цепи непосредственно на молекулы кислорода, в результате чего образуется большое количество свободных радикалов. Последние инициируют реакции перекисного окисления липидов, является важным молекулярным механизмом повреждения клеточных мембран (см. Разд. 11). 27.55. Что такое ишемическая болезнь сердца? Какие ее клинические формы? Ишемическая болезнь сердца - это болезнь, развивающаяся в результате абсолютной недостаточности коронарного кровообращения и оказывается повреждениями миокарда различной степени тяжести. ее основными клиническими формами являются: 1) стенокардия - приступы кратковременной (до 20 мин.) Острой коронарной недостаточности, сопровождающиеся болевым синдромом, чувством страха и связанными с этим вегетативными реакциями. Различают стенокардию напряжения, стенокардию покоя и стенокардией принца талая (спазм венечных артерий) 2) предынфарктное состояние (промежуточный коронарный синдром, или острая очаговая дистрофия миокарда) - развивается при тривалостиьишемии миокарда от 20 до 40 мин .; 3) инфаркт миокарда- некроз сердечной мышцы, обусловленный нарушениями коронарного кровообращения. Возникает при оборотной (транзиторной) ишемии, продолжается более 40-60 мин. ? или при необратимых нарушениях коронарного кровообращения 4) кардиосклероз - склеротические изменения сердечной мышцы. Могут быть диффузными (атеросклеротический кардиосклероз) и очаговыми (постинфарктный кардиосклероз). 27.56. Назовите основные причины развития инфаркта миокарда. 1. Атеросклероз коронарных артерий (см. Разд. 28). Его развитие сопровождается нарушением снабжение миокарда кислородом. 2. Увеличение навантаоисення на сердце (физическое напряжение, артериальная гипертензия). При этом увеличивается потребность сердца в кислороде. 3. Стресс (см. Разд. 33). 27.57. Какова роль катехоламинов в развитии инфаркта миокарда? В развитии инфаркта миокарда могут иметь значение такие эффекты катехоламинов. 1. Нарушение коронарного кровообращения. Это связано с тем, что катехоламины: а) способствуют развитию атеросклероза (стресс и катехоламины, участвующих в его реализации, является фактором риска этой болезни) б) вызывают контрактурных спазм гладких мышц венечных артерий (КАТЕХ-ламини повреждения клеток сосудистой стенки); в) активируют тромбообразования и свертывания крови. 2. Увеличение потребности сердца в кислороде. Энергетические потребности сердца растут в результате реализации положительного ино- и хронотропным эффектов катехоламинов и увеличение общего периферического сопротивления, вследствие чего увеличивается нагрузка на сердце. 3. Некоронарогенные катехоламиновиушкодження кардиомиоцитов. Они не связаны с нарушением коронарного кровообращения. Возникают в результате того, что большие дозы катехоламинов активируют липидные и кальциевые механизмы повреждения клеток (см. Разд. 11). 27.58. Клинические синдромы характерны для инфаркта миокарда? 1. Болевой синдром. 2. Острая сердечная недостаточность. Развивается при поражении больших участков миокарда. Может проявлять себя синдромом сердечной астмы и отека легких или кард-огенним шоком. 3. Аритмичный синдром. Возможно развитие всех видов аритмий. Наиболее опасна появление фибрилляции желудочков. 4. резорбционно-некротический синдром. 27.59. Какие механизмы развития и значение болевого синдрома при инфаркте миокарда? В развитии болевого синдрома при некрозе сердечной мышцы имеют значение: а) химические факторы, появляющиеся в тканях при повреждении клеток. Среди них ионы Н + , К + , простагландины, лизосомальные ферменты; б) изменения сократительных свойств ишемизированного участка миокарда, в результате чего происходит патологическое растяжения (пролабирование) стенки сердца при его сокращении. Это ведет к раздражению механорецепторов сердца и развития боли. Патогенетическое значение болевого синдрома в развитии инфаркта миокарда заключается в том, что: 1) боль является мощным фактором инициации стресса и активации симпатоадреналовой системы. Большие дозы катехоламинов, высвобождаемых при этом, способствуют повреждению миокарда (см. Запрос. 27.57) 2) сильная боль вызывает сначала возбуждение, а затем и перевозбуждения жизненно важных центров головного мозга (дыхательного, сердечно-сосудистого). Это обстоятельство является важным фактором развития кардиогенного шока. 27.60. Что такое кардиотенний шок? В каких формах он может проявлять себя? Кардиогенный шок - это шок, возникающий в результате резкого падения нагнетательной (насосной) функции сердца. Это - самое опасное осложнение инфаркта миокарда, что часто приводит к смерти. Различают 4 формы кардиогенного шока. 1. Рефлекторная форма (болевой шок). Основным механизмом ее развития является длительная боль, что вызывает активацию симпатоадреналовой системы, которая переходит в торможение. Это приводит к депрессии сократительной функции сердца, брадикардии, уменьшение тонуса периферических сосудов и падение артериального давления. 2. гипокинетический форма (истинный кардиогенный шок). Основным фактором ее развития является резкое уменьшение сократительной функции сердца в результате ишемического повреждения кардиомиоцитов. Истинный кардиогенный шок развивается, когда площадь пораженного миокарда превышает 40%. 3. Дискинетическая форма. Возникает в результате асинергии (несогласованности) сокращений миокарда. Причиной такого асинергии есть грубые повреждения сердца - аневризмы, разрыв межжелудочковой перегородки, отрыв хорд клапанов. 4. аритмичным форма. Является следствием тяжелых аритмий. 27.61. Какой патогенез кардиогенного шока? В патогенезе кардиогенного шока различают несколько этапов. I этап - первичное падение артериального давления. Все патогенетические факторы кардиогенного шока (рефлекторная депрессия, увеличение площади поврежденного миокарда, асинергия сердечных сокращений, аритмии) вызывают уменьшение сердечного вы-толчок. Это, по законам гемодинамики, приводит к уменьшению минутного объема сердца и падение артериального давления. II этап - компенсаторный спазм артериол. Характеризуется активацией сим-патоадреналовои системы, поступлением в кровь катехоламинов, вазопрессина, глкжо-ГКС, образованием ангиотензина II. Высвобождение мощных сосудосуживающих факторов вызывает генерализованный спазм артериол, в результате чего увеличивается общее периферическое сопротивление. Указанная реакция является компенсаторной и направлена на предупреждение дальнейшего падения артериального давления. III этап - вторичное падение артериального давления. Длительный спазм артериол в периферических тканях вызывает нарушение микроциркуляции и гипоксию. Следствием кислородного голодания являются: а) ацидоз, что вызывает депрессию сократительной функции миокарда б) расширение артериол, что возникает в результате накопления в тканях метаболы-тов-вазодилататоров ( "метаболический симпатолиз") в) поступления в кровь из тканей так называемых ишемических токсинов. Среди них большое патогенетическое значение имеетфактор депрессии миокарда, высвобождающегося из поджелудочной железы. Все указанные изменения, ухудшая сократительную функцию сердца и "снимая" компенсаторный спазм артериол, вызывают дальнейшее падение артериального давления. IV этап - терминальные изменения. В результате существенного падения артериального давления (ниже 40 мм рт. Ст.): а) еще больше нарушается коронарное кровообращение и увеличивается ишемия миокарда -уменьшение сократительной функции миокарда прогрессирует; б) развивается острая почечная недостаточность (полностью прекращается клубочки-ва фильтрация, возникают анурия, интоксикация) в) нарушается мозговое кровообращение, развивается гипоксия головного мозга, возникают расстройства функции жизненно важных центров. Совокупность изменений приводит к смерти. 27.62. В чем сущность резорбционно-некротического синдрома, развивающегося при инфаркте миокарда? Резорбцийию-некротиичний синдром при инфаркте миокарда является следствием поступления в кровь продуктов распада омертвевших тканей сердца. Он обнаруживает себя следующим признакам: а) лихорадкой (см. разд. 15); б) нейтрофильным лейкоцитозом; в) увеличением скорости оседания эритроцитов (СОЭ); г) ферментемии - появлением в крови ферментов, поступающих с поврежденных кардиомио-цитив (креатинкиназы, аспартатаминотрансфераза, лактатдегидрогеназа I типа и др.) j) аутоиммунным синдромом (синдромом Дреслера). Развивается в результате кон-формационных изменений белков миокарда. Оказывается воспалением серозных оболочек организма - полисерозитом (перикардитом, плевритом, перитонитом). 100. Етіологія і патогенез некоронарогенних ушкоджень міокарда. Кардіоміопатії. Класифікація. Характеристика причин та механізмів виникнення, клінічних проявів. 27.63. Что такое некоронарогенные некрозы сердца? Как их моделируют в эксперименте? Некоронарогеншимы называют некрозы сердца, возникают не в результате недостаточности коронарного кровообращения, а по другим причинам. Существует несколько экспериментальных моделей некроза сердечной мышцы, причина возникновения которого не связана с патологией коронарных сосудов. Эти модели в определенной степени отражают ситуацию, которая наблюдается в природных условиях. 1. "Гипоксический некроз миокарда. Может быть воспроизведен с помощью различных видов гипоксии: гипоксической, гемической. При этом на фоне общей недостаточности кислорода в организме, что сама по себе ведет к повышению нагрузки на систему кровообращения, развивается некротическое повреждение мышечных волокон сердца . Развитию некроза способствует фиксация животного в неудобной позе, например, растяжения в станке, или дополнительная нагрузка - бег в тредбане. 2. Электролитно-стероидная кардиопатия с некрозом. По наблюдениям Селье, при введении крысам значительного количества солей натрия вместе с некоторыми анионами (сульфатной, фосфатными) в сердце появляются очаги повреждения дегенеративно-некротического типа, часто сопровождаются гиалинозом сосудов других органов. Эти повреждения становятся большими или возникают при введении меньшего количества солей, если одновременно вводить некоторые стероидные гормоны надпочечников. На этом фоне легче развиваются и имеют тяжелое течение повреждения сердца, вызванные другими причинами. Так, введение даже небольших доз норадреналина, производных кальциферола, гипоксия, мышечное напряжение или, наоборот, значительное ограничение подвижности ведут к развитию большого некроза миокарда. Соли калия и магния при этом обладают защитным действием. 3. Иммунные повреждения сердца. Возможны при введении в организм экспериментального животного гетерогенной сыворотки, содержащей антитела против белков сердца животные данного вида (кардиоцитотоксины). Доказано также, что в организме при определенных условиях могут возникать антитела и сенсибилизированные лимфоциты, которые действуют на ткани собственного сердца и вызывают его повреждение. Этому способствует проникновению в кровь денатурированных компонентов некротизированных кардиомиоцитов. В эксперименте аналогичный процесс можно вызвать введением животному суспензии миокарда со стимулятором иммунологической реакции (адъювантом Фрейнда). Сердце может быть повреждено и циркулирующими иммунными комплексами антиген-антитело, а также при фиксации на его структурах цитофильних антител типа IgE с последующей их реакцией с антигеном. 4. Нейрогенные поражения сердца.Дистрофические изменения и некроз миокарда можно воспроизвести острым или хроническим раздражением шейно-грудного узла симпатического ствола, блуждающего нерва, гипоталамуса, мозгового ствола или других отделов головного мозга. Введение в кровь больших доз адреналина или норадреналина также ведет к поражению сердца. В основе механизма нейрогенных повреждений лежит несоответствие между уровнями функции, метаболизма и кровоснабжения. Раздражение сердечных симпатических нервов сопровождается значительным увеличением потребления кислорода миокардом. При этом увеличение коронарного кровообращения недостаточно (относительная коронарная недостаточность), а потому развивается гипоксия миокарда. При склерозировании венечных артерий несоответствие интенсивности кровообращения уровню обмена веществ проявляется еще в большей степени, что может оказаться катастрофическим как для сердца, |
