практикум по биохимии. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
|
Практическое значение работы. Цитохромоксидаза как гемсодержащий белок очень чувствительна к действию цианидов, сульфидов, азидов и прочих веществ, взаимодействующих с железом гема. При отравлении этими соединениями происходит угнетение цитохромоксидазы и развивается гистотоксическая гипоксия, т.е. кислородное голодание тканей, связанное с невозможностью использовать кислород как акцептор электронов и протонов в дыхательной цепи митохондрий. Метод выявления цитохромоксидазы реактивом НАДИ используется в клинике и цитологии для выявления этого фермента в биоптатах и мазках клеток крови с целью диагностики нарушений тканевого дыхания. Работа 40. Демонстрация процесса окислительного фосфорилирования и действия на него разобщителей Для исследования окислительного фосфорилирования определяют величину поглощения кислорода в тканях и одновременно убыль добавленного в среду неорганического фосфата. Это позволяет вычислить коэффициент фосфорилирования – Р/О. Потребление кислорода тканями при окислении субстратов не является достоверным показателем интенсивности окислительного фосфорилирования, поскольку кислород расходуется и в других, немитохондриальных, реакциях. Кроме того, активная утилизация его еще не означает аналогичного по интенсивности фосфорилирования, т.е. эти два процесса могут быть в той или иной степени разобщены. Использование неорганического фосфата в реакции этерификации: Фн+АДФ→АТФ происходит не только в ходе окислительного фосфорилирования, но и в гликолизе. При отсутствии в среде субстратов гликолиза или при ингибировании его и при создании необходимых условий для функции дыхательной цепи митохондрий можно считать, что почти весь Фн расходуется в ходе окислительного фосфорилирования и его убыль является индикатором этого процесса. Реактивы. Хлорид калия, 0,15 М раствор; К-фосфатный буфер (рН 7,4), приготовленный из KH2PO4 (содержание неорганического фосфора 0.1 моль/л); малат натрия, 0,16 М раствор; хлорид магния, 0,6 М раствор; фторид натрия, 5,7 М раствор; АДФ, динатриевая соль, 9,1∙10-2 М раствор; сукцинат натрия, 0,3 М раствор; 2,4-динитрофенол, 0,01 М раствор; азид натрия, 1 М раствор; трихлоруксусная кислота, 10%-ный раствор; реактив молибдата аммония*; аскорбиновая кислота, 1%-ный раствор на 0,1 М растворе соляной кислоты. Оборудование. Штатив с пробирками; гомогенизатор с пестиком из тефлона; моторчик для гомогенизации; пипетки вместимостью 1 мл; бюретка вместимостью 25 мл; стеклянные палочки; воронка со складчатым бумажным фильтром; водяная баня с лабораторным термометром или баня аппарата Варбурга; часы; ФЭК. Материал. Печень белой крысы. Метод основан на измерении расхода добавленного неорганического фосфата Фн в ходе реакции окислительного фосфорилирования в митохондриях, содержащихся в гомогенатах печени. Использование Фн в гликолизе блокируется содержащимся в среде инкубации фторидом натрия. О действии разобщителя (2,4-динитрофенол) и ингибитора (азид натрия) окислительного фосфорилирования также судят по убыли неорганического фосфата в присутствии малата как субстрата окисления. Неорганический фосфат утилизируется по схеме H3PO4 + АДФ → АТФ + H2O Определение содержания Фн до и после инкубации основано на реакции, приведенной в работе 11. Ход определения. Животное забивают, извлекают печень и погружают ее в чашку Петри с раствором хлорида калия, стоящую на льду или на снегу. Тщательно промывают печень от крови средой выделения и промокают фильтровальной бумагой. Навеску около 2 г отмытой ткани печени переносят на часовое стекло или в чашку Петри, стоящую на льду, и мелко измельчают ножницами. Измельченную ткань помещают в стакан гомогенизатора, куда предварительно налито 18 мл охлажденного раствора хлорида калия. Стакан гомогенизатора помещают в лед или снег, находящийся в мешочке. Ткань гомогенизируют в течение 40-50 с при вращении пестика 800-1200 об/мин, делая 40-50 движений стаканчика вверх-вниз. В пять пробирок наливают по 1 мл инкубационной смеси следующего состава:
Вносят во все пробы по 2 мл полученного гомогената печени, перемешивают стеклянной палочкой и помещают в штатив водяной бани при 37˚С, снабженной устройством для встряхивания пробирок. Отмечают время начала инкубации. Через 30 мин инкубации реакции во всех пробах останавливают, добавляя к каждой по 1 мл раствора трихлоруксусной кислоты. Содержимое их перемешивают и фильтруют в другие пробирки через складчатый бумажный фильтр. Из каждой пробы отбирают по 1 мл безбелкового фильтрата в чистые пробирки и приливают к ним по 1 мл реактива молибдата аммония и по 1 мл раствора аскорбиновой кислоты. Перемешивают содержимое стеклянной палочкой, затем из бюретки добавляют по 7 мл дистиллированной воды и вновь перемешивают. Оставляют стоять 5 мин для развития окрашивания. Перед фотометрией готовят стандартную пробу, для чего в пробирку вносят 0,1 мл фосфатного буфера, 0,9 мл трихлоруксусной кислоты, 1 мл реактива молибдата аммония и 1 мл раствора аскорбиновой кислоты. Содержимое перемешивают, затем добавляют из бюретки 7 мл дистиллированной воды и опять перемешивают. Оставляют стоять 5 мин для развития окрашивания. Фотометрируют опытную и стандартную пробы против контрольной (1 мл трихлоруксусной кислоты и 9 мл дистиллированной воды) на ФЭКе при 630-690 нм (красный светофильтр) в кювете с толщиной слоя 0,5 см. Расчет. Содержание неорганического фосфора х (в мкмоль) в пробах рассчитывают по формуле Еоп∙10 х = ————— , Ест где Еоп – экстинкция опытной пробы; Ест – экстинкция стандартной пробы; 10 – количество неорганического фосфора в стандартной пробе, мкмоль. Убыль Фн рассчитывают по разнице между количеством его в стандартной и соответствующей опытной пробах. Оформление работы. Полученные данные внести в таблицу.
В выводе указать возможность протекания окислительного фосфорилирования без субстрата окисления и особенность действия на него разобщителей и ингибиторов; отметить практическое значение обнаруженных феноменов. Практическое значение работы. Клетки и ткани организма человека отличаются друг от друга скоростью дыхания и связанного с ним фосфорилированием. Наиболее активное окислительное фосфорилирование отмечается в тканях, богатых митохондриями, например, в почках, сетчатке глаза, корковом веществе головного мозга, сердце, печени; менее развит этот процесс в скелетных мышцах, коже, а в эритроцитах человека он вообще отсутствует. В клинико-биохимических исследованиях используются методы определения окислительного фосфорилирования в лейкоцитах крови и биоптатах для оценки энергетического обмена при различных патологических состояниях, а также для изучения действия лекарств и ядов, которые могут проявлять свойства разобщителей или ингибиторов. Работа 41. Выявление гликолиза в мышечной тканиДля оценки вклада гликолиза в энергетику клеток измеряют скорость этого процесса при оптимальных условиях. С этой целью добавляют в среду, содержащую исследуемый материал (клетки, срезы или кусочки тканей, гомогенат ткани), один из субстратов гликолиза (гликогенолиза), чаще всего глюкозу, гликоген, фруктозобисфосфат и др., необходимые кофакторы и создают анаэробные условия. Обязательным компонентом при изучении скорости гликолиза является неорганический фосфат, который расходуется в этом процессе на образование АТФ из АДФ. Индикаторами гликолиза служат скорость убыли глюкозы или накопления молочной кислоты, а также потребление Фн при анаэробном распаде углеводов в тканях. Реактивы. Фосфатный буфер, 0,1 М раствор с рН 8,0*; глюкоза, 10 г/л раствор, свежеприготовленный; трихлоруксусная кислота, 100 г/л раствор; сульфат меди (II), 100 г/л раствор; серная кислота, конц.; гваякол, 1,0 г/л раствор в 70%-ном этаноле; о-толуидиновый реактив*; фторид натрия, 3 М раствор; вазелиновое масло; оксид кальция, порошок, навески по 0,25 г в бумажных пакетиках. Оборудование. Водяная баня с лабораторным термометром; штатив с пробирками; пипетки вместимостью 1 и 2 мл; глазные пипетки; воронки со складчатыми бумажными фильтрами; стеклянные палочки; аптечные весы с разновесами. Материал. Мышечная ткань (свежая) забитого животного. Метод основан на выявлении убыли глюкозы и накопления молочной кислоты в среде под действием ферментов гликолиза мышечной ткани в присутствии и в отсутствие фторида натрия, являющегося ингибитором гликолиза. Глюкоза обнаруживается по реакции с о-толуидином, в результате чего образуется окрашенное соединение зеленого цвета при нагревании в среде с уксусной кислотой. Молочная кислота при нагревании с концентрированной серной кислотой превращается в ацетальдегид, дающий с гваяколом характерное красное окрашивание. Ход определения. В три пробирки отмеривают по 2 мл фосфатного буфера и по 1 мл раствора глюкозы. Затем в первую пробу добавляют 1 мл раствора трихлоруксусной кислоты, а во вторую – 0,2 мл раствора фторида натрия. Мышечную ткань мелко измельчают ножницами и вносят во все пробирки по 1 г мышечной кашицы, содержимое тщательно перемешивают стеклянной палочкой и приливают 10 капель вазелинового масла (для защиты от кислорода воздуха). Пробирки выдерживают на водяной бане при 37˚С в течение 30 мин. После инкубации во вторую и третью пробы добавляют по 1 мл раствора трихлоруксусной кислоты и перемешивают. Содержимое всех пробирок фильтруют через бумажный фильтр в чистые пробирки. С фильтратом проделывают реакции на глюкозу и молочную кислоту. Для проведения реакции на глюкозу берут по 0,1 мл фильтрата, переносят его в чистые пробирки и добавляют в них по 0,4 мл воды и по 2,0 мл о-толуидинового реактива. Помещают пробирки в водяную кипящую баню на 8 мин, после чего охлаждают под струей холодной воды. Сравнивают интенсивность окраски исследуемых проб. Для проведения реакции на молочную кислоту к оставшемуся фильтрату в обеих пробах добавляют по 5 капель раствора сульфата меди и по 0,25 г оксида кальция (для осаждения углеводов, которые мешают обнаружению молочной кислоты). Пробы оставляют стоять 10 мин при комнатной температуре, периодически встряхивая их. Затем содержимое пробирок фильтруют через бумажный фильтр в две чистые пробирки, помещенные в лед или снег. Отбирают по 10 капель фильтрата и осторожно добавляют в каждую из них по 30 капель концентрированной серной кислоты. Все пробирки помещают на 5 мин в кипящую водяную баню (для превращения молочной кислоты в ацетальдегид). Затем пробирки охлаждают и добавляют по 2 капли спиртового раствора гваякола. Через 20 мин сравнивают интенсивность окрашивания в пробах. Оформление работы. Результаты оформить в виде таблицы.
Сделать вывод о наличии гликолиза в мышечной ткани и о методических подходах к его изучению. Практическое значение работы. При анаэробном распаде углеводов образуется две молекулы АТФ на одну молекулу расщепленной глюкозы, что является важным дополнительным источником образования энергии. В эритроцитах гликолиз является единственным способом производства энергии. В анаэробных условиях, когда организм испытывает недостаток кислорода, этот путь образования энергии является основным для сохранения жизнедеятельности тканей. В эксперименте и клинике определение скорости гликолиза в клетках крови и биоптатах широко используется для оценки образования энергии анаэробным путем. Кроме того, этот метод позволяет изучить механизм действия различных лекарственных препаратов и ядов, которые могут оказывать отрицательное действие, блокируя одну из стадий ферментативного процесса. Работа 42. Анализ адениннуклеотидов методом ионообменной тонкослойной хроматографии Реактивы. Стеклянные пластинки (9х12 см) с нанесенным тонким слоем диэтиламиноэтилцеллюлозы (ДЭАЭ-целлюлоза), являющейся анионообменной смолой; соляная кислота, 0,02 М раствор. Оборудование. Химический стакан; глазная пипетка; лист белой бумаги; вентилятор; хроматоскоп. Материал. Аденозинтрифосфат натрия, 1%-ный раствор для инъекций. Метод основан на эффекте ионного обмена, состоящего в том, что адениннуклеотиды, имеющие отрицательный заряд, взаимодействуют с положительными группами ДЭАЭ-целлюлозы (неподвижная фаза), а при прохождении по адсорбенту раствора соляной кислоты нуклеотиды замещаются на анионы Clˉ. При этом легче всего вытесняется АМФ, из-за чего он продвигается дальше всех, затем АДФ и АТФ, который остается рядом с линией старта1. Просматривают хроматограмму в ультрафиолетовом свете, в котором нуклеотиды, вследствие поглощения при 260 нм, выглядят в виде темных пятен. Ход определения. Стеклянную пластину с ДЭАЭ-целлюлозой кладут адсорбентом вверх на лист белой бумаги и, отступив от края пластинки на 2 см, проводят простым карандашом линию старта, а в центре очерчивают кружок диаметром 3-4 мм для нанесения исследуемой пробы. Наносят глазной пипеткой каплю раствора натрия аденозинтрифосфата в центр кружка и подсушивают пятно на воздухе в течение 5 мин с помощью вентилятора. В химический стакан, который используют как хроматографическую камеру, наливают раствор соляной кислоты так, чтобы слой жидкости был высотой примерно 1 см. Опускают конец пластинки с нанесенной пробой в раствор соляной кислоты. Для герметичности стакан закрывают лоскутом резиновой перчатки, натянув его и закрепив с помощью резинового колечка. После того как фронт растворителя достигает верхнего края пластинки, ее вынимают из стакана и подсушивают на воздухе с помощью вентилятора. Хроматограмму помещают в хроматоскоп и в ультрафиолетовом свете очерчивают простым карандашом темные пятна разделившихся адениннуклеотидов. Оформление работы. Зарисовать положение пятен адениннуклеотидов на хроматограмме и сделать вывод о качестве исследуемого препарата АТФ для инъекций. Практическое значение работы. Разделение нуклеотидов методом тонкослойной ионообменной хроматографии используется для изучения состава нуклеотидов и определения их содержания в тканях, а также для расчета энергетического заряда адениловой системы в норме и при различных патологических состояниях. В фармации этот метод используется для контроля качества препаратов, содержащих адениннуклеотиды. Работа 43. Определение активности креатинфосфокиназы в сыворотке крови по Эннору и Розенбергу Реактивы. Креатинфосфат, 0,006 М раствор; аденозиндифосфат динатриевая соль, 6,0 г/л раствор; трис-буфер, 0,1 М раствор с рН 7,2, содержащий 0,1 моль/л хлорида магния; сульфат цинка, 50 г/л раствор; гидроксид бария, 50 г/л раствор; щелочной реактив, содержащий 160 г/л карбоната натрия и 60 г/л гидроксида натрия; диацетил, рабочий раствор; α-нафтол, 10 г/л раствор; креатин, стандартный раствор концентрации 0,1 ммоль/л. Примечание. Все перечисленные реактивы, кроме трис-буфера, готовят перед употреблением. Оборудование. Штатив с пробирками; стеклянные палочки; пипетки вместимостью 1 мл; водяная баня с лабораторным термометром; центрифуга лабораторная с центрифужными весами. Материал. Сыворотка крови. Метод основан на определении креатина, образующегося из креатинфосфата под действием креатинфосфокиназы, об активности которой судят по количеству выявляемого креатина. 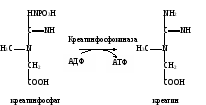 Креатин образует с диацетилом и α-нафтолом комплексное соединение, интенсивность розовато-желтой окраски которого пропорциональна концентрации креатина. Ход определения. В две пробирки последовательно вносят следующие реактивы (объемы растворов указаны в миллилитрах):
Обе пробирки помещают на 3 мин в водяную баню при 37˚С, не вынимая из бани, прибавляют в них по 0,2 мл раствора АДФ (запускают креатинкиназную реакцию). Отмечают время начала инкубации. Через 30 мин реакцию останавливают, последовательно добавляя в обе пробы по 0,2 мл гидроксида бария и сульфата цинка. Содержимое пробирок охлаждают и оставляют стоять 10 мин (для осаждения белка). Затем осадок отделяют центрифугированием при 3000 об/мин в течение 5-10 мин. Отбирают по 0,5 мл надосадочной жидкости в две чистые пробирки и приливают в них по 3 мл дистиллированной воды, по 1 мл раствора α-нафтола и по 0,5 мл рабочего раствора диацетила. Пробы тщательно перемешивают стеклянной палочкой и помещают на 20 мин в темное место для развития окрашивания. Перед фотометрией готовят стандартную пробу и контроль стандарта. Для этого в одну пробирку (стандартная проба) вносят 0,5 мл раствора креатина, 3 мл дистиллированной воды, 1 мл α-нафтола и 0,5 мл рабочего раствора диацетила, а в другую (контроль стандарта) – те же реактивы, только вместо раствора креатина добавляют 0,5 мл дистиллированной воды. Обе пробирки выдерживают в темноте 20 мин. Измеряют экстинкцию опытной пробы против контрольной и стандартной против контроля стандарта на ФЭКе при 520-540 нм (светофильтр зеленый) в кювете с толщиной слоя 1,0 см. Расчет. Активность креатинфосфокиназы рассчитывают по формуле 0,00005Еоп1,2∙2∙10000 х = ———————————— , Ест0,5 где х – активность креатинфосфокиназы, ммоль/(ч∙л); 0,00005 – содержание креатина в стандартной пробе, ммоль; Еоп – экстинкция опытной пробы против контроля; Ест – экстинкция стандартной пробы против контроля стандарта; 2 – коэффициент пересчета на час инкубации; 1,2 – объем проб до центрифугирования; 0,5 – объем надосадочной жидкости, взятой на исследование; 10000 – коэффициент пересчета на литр сыворотки крови. После сокращения формула приобретает следующий вид: 2,4Еоп х = ———— Ест Оформление работы. Рассчитать активность креатинфосфокиназы в сыворотке крови и по полученным данным сделать вывод о возможных изменениях активности фермента и причинах этих отклонений. Практическое значение работы. Больше всего креатинфосфокиназы в мышечной (скелетная мышца и сердце) и нервной тканях, в которых она участвует в переносе энергии. В остальных тканях и органах ее активность в 100-1000 раз ниже. Поэтому при повреждении мышечной и нервной тканей или при заболеваниях, вызывающих повышение их проницаемости, имеет место «утечка» фермента из тканей и повышение его количества в крови. В норме активность креатинфосфокиназы в сыворотке крови составляет 0,30-0,70 ммоль/(ч∙л). В клинической практике определение активности этого фермента используется при диагностике инфаркта миокарда (причем повышение активности его наблюдается через 3 ч после начала некротического процесса и достигает максимума через 24 ч), а также при дистрофии скелетных мышц, поражении нервной ткани.
фотосинтезирующих организмов В клетках фотосинтезирующих организмов имеется система пигментов (хлорофиллы, фикобилины, каротиноиды) избирательно улавливающие кванты света в видимой области спектра, которые затем трансформируются в энергию фосфатных связей АТФ. В темновой период суток эти организмы преобразуют энергию окислительно-восстановительных реакций в энергию АТФ как хемотрофы. В митохондриях животных и растительных клеток функционируют сходные ферменты биологического окисления и системы трансформации энергии в дыхательной цепи. Исследование этих процессов проводится аналогичными методами, что и в гетеротрофных организмах. В то же время в растениях отмечается высокая активность ряда оксидаз (пероксидаза, полифенолоксидаза и др.), принимающих участие в окислении вторичных продуктов обмена. Работа 44. Качественные реакции на пигменты растенийРеактивы. Этанол, 96%-ный; бензин; гидроксид бария, насыщенный раствор; аскорбиновая кислота, кристаллическая; соляная кислота, 10%-ный раствор. Оборудование. Водяная баня с лабораторным термометром; штатив с пробирками; капельницы; пипетки вместимостью 5 мл; аптечные весы с разновесками; ступка с пестиком. Материал. Листья крапивы, сушеные. а. Экстрагирование пигментов из листьев крапивы. Метод основан на способности хлорофилла и других пигментов под действием горячего спирта переходить в раствор, при этом хлорофилл при взаимодействии со спиртом превращается в этилхлорофиллид – сложный эфир, в котором остаток фитола замещен остатком этилового спирта. Ход определения. 0,5 г сушеной крапивы растирают в ступке с 5,0 мл этилового спирта, переносят в пробирку и нагревают на водяной бане при 90-100˚С до закипания спирта. Содержимое фильтруют через бумажный фильтр в другую пробирку. Фильтрат, содержащий хлорофиллид, ксантофилл и другие пигменты, имеет зеленый цвет с интенсивной красной флюоресценцией. Его используют для исследования. б. Разделение пигментов по Краусу. Метод основан на различной способности пигментов растворяться в бензине: хлорофилл, хлорофиллид растворимы, а ксантофилл нерастворим в нем. Ход определения. К 10 каплям полученного фильтрата прибавляют равный объем бензина, содержимое тщательно встряхивают, постукивая пальцем по дну пробирки. Наблюдают за окраской пигментов, содержащихся в разных растворителях. в. Осаждение хлорофилла. Метод основан на способности эфирных групп при омылении раствором гидроксида бария образовывать бариевые соли хлорофиллидов А и В, нерастворимых в воде; жидкость над осадком имеет желтую окраску вследствие присутствия в вытяжке каротина и ксантофилла. Ход определения. К 10 каплям фильтрата добавляют 20 капель раствора гидроксида бария и тщательно взбалтывают. Наблюдают за происходящими изменениями. г. Восстановление хлорофилла аскорбиновой кислотой. Метод основан на способности аскорбиновой кислоты восстанавливать хлорофилл, приобретающий вследствие этого желтое окрашивание. Ход определения. К 10 каплям фильтрата добавляют 2 капли воды, несколько кристалликов аскорбиновой кислоты и в течение 3-5 мин нагревают в водяной бане при 70-80˚С. Наблюдают за изменением окраски. д. Получение феофитина из хлорофилла. Метод основан на способности соляной кислоты связывать ион магния, входящий в состав хлорофилла, с образованием феофитина, имеющего оливково-бурый цвет. Ход определения. К 5 каплям фильтрата прибавляют 1 каплю раствора соляной кислоты. Наблюдают за изменением окраски. Оформление работы. Дать оценку качественным реакциям на пигменты растений. В выводах обосновать значение хлорофилла и других пигментов для фотосинтетических процессов. Практическое значение работы. Методы разделения и анализа пигментов фотосинтетического аппарата растений используются для изучения физико-химических свойств, фотохимической активности и характеристики их состава на разных стадиях онтогенеза растений и влияния на него факторов внешней среды. Работа 45. Определение активности пероксидазы в растительном материале по методу А.Н.Бояркина Реактивы. Ацетатный буфер, 0,1 М раствор с рН 5,4*; пероксид водорода, 0,03%-ный раствор; бензидин, 0,92 г/л раствор на ацетатном буфере*. Оборудование. Колбы вместимостью 25 мл; пипетки вместимостью 5 мл; центрифуга лабораторная с центрифужными весами; ФЭК. Материал. Листья растений, свежие. Метод основан на непрерывном измерении светопоглощения бензидиновой сини, образующейся при окислении бензидина под действием пероксидазы. 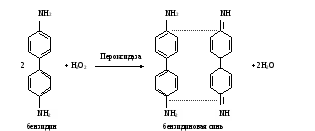 Реакция описывается уравнением. Реакция описывается уравнением.Ход определения. Навеску 100 мг растительного материала помещают в ступку и растирают, прибавляя порциями 10 мл дистиллированной воды. Растертую массу переносят в мерную колбу вместимостью 25 мл и доводят водой до метки. Содержимое колбы настаивают 10 мин, затем сливают в центрифужные пробирки и центрифугируют 10 мин при 3000 об/мин. Для определения активности фермента берут кювету с толщиной слоя 2 см и наливают в нее по 2 мл водной вытяжки из листьев, ацетатного буфера и раствора бензидина. Ставят кювету в кюветодержатель и устанавливают стрелку прибора на нулевую отметку, затем добавляют 2 мл раствора пероксида водорода пипеткой с широким носиком (чтобы сильная струя перемешала жидкость в кювете) и одновременно с добавлением пероксида включают секундомер. Раствор в кювете начинает синеть и по мере нарастания интенсивности окраски стрелка прибора отклоняется. Отмечают время от начала приливания раствора пероксида водорода до достижения стрелкой гальванометра отметки 0,250. Повторяют определение трижды и берут среднее значение времени. Расчет. Активность фермента рассчитывают по формуле ∆Е 25∙1000 х = ———————— , t∙d 0,1∙2 где х – активность пероксидазы, Е∙с-1∙кг-1 (Е – единица экстинкции); ∆Е – изменение экстинкции, равное 0,250; t – время реакции, с; d – толщина слоя кюветы, равная 2; 1000 – коэффициент пересчета граммов в килограммы; 0,1 – навеска, г; 2 – объем пробы, мл. После сокращений формула принимает вид 15625 х = ————— t Оформление работы. Рассчитать и сравнить активность пероксидазы в исследуемом материале; в выводе отметить биологическое значение фермента. Практическое значение работы. Пероксидаза выполняет две функции: собственно пероксидазную, т.е. окисляет вещества с участием пероксида водорода, и оксидазную, т.е. катализирует окисление субстратов за счет молекулярного кислорода без участия пероксида водорода. Этот фермент проявляет перокисдазную активность в отношении практически всех фенолов (пирокатехин, пирогаллол, галловая кислота, гваякол и др.), ароматических аминов (бензидин, n-фенилендиамин и др.), аскорбиновой кислоты, нитритов и т.д. В то же время пероксидаза, обладая оксидазной функцией, способна участвовать в окислении флороглюцина, НАД∙Н2, НАДФ∙Н2, индолилуксусной кислоты, оксалата, фенилпирувата и т.д. В практике широко используют определение активности пероксидазы для оценки метаболизма ростовых веществ, лигнина и других вторичных продуктов обмена при физиологических и патологических процессах. Пероксидаза, выделенная из хрена, широко используется как аналитический реагент при проведении клинико-биохимических исследований. Поэтому метод измерения активности фермента необходим для контроля качества продажного препарата фермента. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
