практикум по биохимии. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
ОБМЕН ЛИПИДОВДля изучения состояния липидного обмена в организме используется определение содержания липидных компонентов в биологических жидкостях. Разные липиды входят в состав сложноорганизованных комплексов – липопротеидов – или адсорбируются белками, в основном альбуминами, плазмы или сыворотки крови. В крови содержатся хиломикроны, образующиеся в слизистой тонкого кишечника и поступающие в нее с лимфой, пре-β-липопротеиды (липопротеиды очень низкой плотности), β-липопротеиды (липопротеиды низкой плотности) и α-липопротеиды (липопротеиды высокой плотности). Апопротеиды трех последних классов липопротеидов синтезируются в печени, поэтому по содержанию липопротеидов в крови судят не только о липидном обмене, но и функции печени. При исследовании обмена липидов в клинике определяют содержание липопротеидов, общих липидов, включающих сумму всех липидных веществ сыворотки или плазмы крови, а также отдельные их фракции – триацилглицерины, неэтерифицированные жирные кислоты, свободный и этерифицированный холестерин, фосфолипиды. Работа 50. Определение содержания суммарных липидов в сыворотке крови по реакции с сульфофосфованилиновым реактивом Реактивы. Серная кислота, конц.; фосфованилиновый реактив*. Оборудование. Штатив с пробирками; пипетки для отмеривания сильных кислот; пипетки вместимостью 0,1; 1 и 10 мл; стеклянные палочки; водяная баня; ФЭК. Материал. Сыворотка крови. Метод основан на способности продуктов распада ненасыщенных липидов образовывать с фосфованилиновым реактивом соединение, интенсивность окраски которого пропорциональна содержанию общих липидов в сыворотке крови. Ход определения. В опытную пробирку (сухую!) вносят 0,1 мл сыворотки крови и 2,9 мл концентрированной серной кислоты (осторожно! Специальными пипетками!), а в контрольную – 0,1 мл дистиллированной воды и 2,9 мл концентрированной серной кислоты. Содержимое обеих пробирок тщательно перемешивают стеклянной палочкой и помещают в кипящую водяную баню на 10 мин (осторожно!). Затем обе пробирки быстро охлаждают под струей холодной воды до комнатной температуры. Из опытной и контрольной пробирок отбирают по 0,2 мл охлажденного содержимого в другие пробирки, в которые предварительно наливают фосфованилинового реактива по 3 мл в обе пробирки. После тщательного перемешивания стеклянной палочкой пробы ставят на 45 мин в темное место при комнатной температуре (для развития окрашивания). Фотометрируют опытную пробу против контрольной на ФЭКе при 500-560 нм (зеленый светофильтр), в кювете с толщиной слоя 0,5 см. Расчет. Содержание общих липидов в сыворотке крови х (г/л) рассчитывают по формуле m10000∙3 х = ——————— , 0,2∙1000 где m – масса общих липидов в пробе, найденная по калибровочному графику (рис.6), мг; 10000 – коэффициент пересчета на 1 л сыворотки крови; 1000 – коэффициент пересчета миллиграммов в граммы; 3 – общий объем исходной смеси (0,1 мл сыворотки крови + 2,9 мл концентрированной серной кислоты), мл; 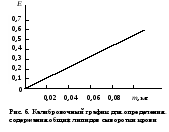 0,2 – объем смеси, взятой для проведения цветной реакции, мл. 0,2 – объем смеси, взятой для проведения цветной реакции, мл.Оформление работы. По найденному значению экстинкции рассчитать содержание общих липидов в крови, указав на возможные изменения в их содержании и причину этих изменений. В выводах отметить практическое использование метода определения общих липидов в клинической лаборатории для выявления нарушений липидного обмена. Практическое значение работы. Нормальное содержание общих липидов в сыворотке крови (нормолипемия) составляет 4,0-8,0 г/л. При физиологических условиях увеличение содержания липидов в крови (гиперлипемия) наблюдается через 1-4 ч после принятия богатой жирами пищи. Натощак уровень общих липидов снижается (гиполипемия). Гиперлипемия проявляется при многих патологических состояниях: у больных сахарным диабетом отмечается резко выраженная гиперлипемия (до 20,0 г/л), при заболеваниях почек (липоидном нефрозе), при поражении печени (циррозе печени и остром гепатите), при ожирении, при врожденной гиперлипемии, атеросклерозе и у лиц, злоупотребляющих алкоголем. Работа 51. Определение содержания β- и пре- β-липопротеидов сыворотки крови турбидиметрическим методом по Бурштейну и Самай Реактивы. Хлорид кальция, 0,025 М раствор; гепарин, содержащий 1000 единиц в 1 мл. Оборудование. Микропипетки; ФЭК. Материал. Сыворотка крови. Метод основан на способности гепарина образовывать с β- и пре-β-липопротеидами сыворотки крови комплекс, который под действием хлорида кальция выпадает в осадок. Степень помутнения раствора пропорциональна содержанию этих липопротеидов в сыворотке крови. Ход определения. В контрольную и опытную кюветы ФЭКа с толщиной слоя 0,5 см наливают по 2 мл хлорида кальция. Устанавливают шкалу прибора на нулевую отметку при 720 нм (красный светофильтр). В опытную кювету приливают микропипеткой 0,2 мл сыворотки, несколько раз промывая пипетку. Отмечают исходное значение экстинкции (Е1). Затем добавляют микропипеткой 0,04 мл гепарина, несколько раз промывая ее, и перемешивают содержимое кюветы. Ровно через 4 мин (по секундомеру) вновь измеряют экстинкцию (Е2). Расчет. Содержание β- и пре-β-липопротеидов х (г/л) в сыворотке крови рассчитывают по формуле х = (Е2 – Е1)11,65 , где 11,65 – эмпирический коэффициент пересчета содержания β- и пре-β-липопротеидов на г/л. Оформление работы. По полученным значениям экстинкции рассчитать содержание определяемых липопротеидов в сыворотке крови и сделать вывод о возможных их изменениях. Практическое значение работы. В норме содержание липопротеидов в сыворотке крови составляет 3,6-6,5 г/л. Наиболее часто наблюдается увели чение содержания β-липопротеидов в сыворотке крови. Повышение уровня липопротеидов тесно связано с повышением содержания холестерина в крови; им наиболее богаты β-липопротеиды. Повышение β- и пре-β-липопро теидов имеет место при заболеваниях, связанных с нарушением липидного обмена (атеросклероз, сахарный диабет и др.). Концентрация β- и пре-β-ли попротеидов в сыворотке крови имеет значение не только для выявления на рушений липидного обмена, но и как показатель функции печени (гепатиты). Работа 52. Определение содержания холестерина в сыворотке крови по методу Илька Реактивы. Реактив Илька*. Оборудование. Пипетка для отмеривания концентрированных кислот; термостат, отрегулированный на 37˚С; микропипетки; штатив с пробирками; ФЭК. Материал. Сыворотка крови. Метод основан на реакции Либермана-Бурхарда (см. работу 18, б). Интенсивность изумрудно-зеленой окраски пропорциональна содержанию холестерина. Ход определения. В пробирку вносят 2,1 мл реактива Илька и приливают 0,1 мл негемолизированной сыворотки крови, которую добавляют медленно, так чтобы она стекла по стенке пробирки. Пробирку энергично встряхивают 10-12 раз и помещают в термостат на 20 мин при 37˚С. Фотометрируют на ФЭКе при 630-690 нм (красный светофильтр) в кювете с толщиной слоя 0,5 см против реактива Илька. 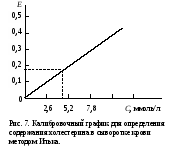 Примечание. При проведении реакции нужно пользоваться абсолютно чистыми и сухими пробирками и пипетками. Соотношение компонентов реактива Илька рассчитано так, что белки сыворотки крови не выпадают в осадок. Появление мути может быть вызвано лишь наличием воды в реактиве или посуде. Примечание. При проведении реакции нужно пользоваться абсолютно чистыми и сухими пробирками и пипетками. Соотношение компонентов реактива Илька рассчитано так, что белки сыворотки крови не выпадают в осадок. Появление мути может быть вызвано лишь наличием воды в реактиве или посуде.Расчет. Содержание холестерина определяют по калибровочному графику (рис. 7). Оформление работы. Рассчитать содержание холестерина в исследуемой сыворотке крови и по результатам сделать вывод о возможных нарушениях в обмене холестерина. Практическое значение работы. Содержание холестерина в сыворотке крови у здоровых людей, определенное методом Илька, составляет 3,0-6,2 ммоль/л. Повышенная концентрация холестерина в сыворотке крови (гиперхолестеринемия) наблюдается при атеросклерозе, сахарном диабете, врожденных нарушениях обмена, заболеваниях печени и т.д. Работа 53. Определение содержания общих фосфолипидов в сыворотке крови Метод основан на определении концентрации органического фосфата, освободившегося при кислотном гидролизе. Измерение содержания неорганического фосфата проводится реакцией с молибдатом аммония, принцип которой см. работу 11. Реактивы. Трихлоруксусная кислота, 0,6 М раствор; реактив молибдата аммония*; хлорная кислота, конц.; восстанавливающий реактив*. Оборудование. Фильтровальная бумага; центрифуга с центрифужными весами; штатив с пробирками; пипетки для забора концентрированных кислот; пипетки вместимостью 0,1; 1 и 5 мл; песчаная баня; ФЭК. Материал. Сыворотка крови. Ход определения. В опытную пробирку вносят 0,2 мл сыворотки и 2,8 мл дистиллированной воды, в контрольную – 3 мл дистиллированной воды. Добавляют в обе пробирки по 3 мл раствора трихлоруксусной кислоты и встряхивают для перемешивания содержимого. Центрифугируют опытную пробу 15 мин при 3000 об/мин. Надосадочную жидкость сливают, пробирку переворачивают на фильтровальную бумагу до полного стекания жидкости. Затем в обе пробирки приливают по 1 мл концентрированной хлорной кислоты (специальной пипеткой, осторожно!), помещают в каждую из них по две стеклянные бусинки и встряхивают их содержимое. Пробы ставят на гидролиз в песчаную баню при 180˚С на 20-30 мин (до обесцвечивания раствора). Пробирки охлаждают на воздухе до комнатной температуры, прибавляют по 3 мл дистиллированной воды, по 1 мл реактива молибдата аммония и по 1 мл свежеприготовленного восстанавливающего реактива. Тщательно перемешивают содержимое пробирок и оставляют на 10 мин при комнатной температуре. Фотометрируют опытную пробу против контрольной на ФЭКе при 630 нм (красный светофильтр) в кювете с толщиной слоя 0,5 см. Расчет. Содержание общих фосфолипидов х (г/л) в сыворотке крови рассчитывают по формуле m5000∙25 х = —————— , 10 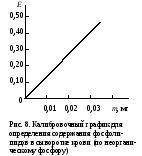 где m – масса неорганического фосфата в пробе, найденная по калибровочному графику (рис. 8), мг; где m – масса неорганического фосфата в пробе, найденная по калибровочному графику (рис. 8), мг;5000 – коэффициент пересчета на литр сыворотки крови; 10 – коэффициент пересчета миллиграммов в граммы; 25 – коэффициент пересчета (липидный фосфор составляет 4% относительной молекулярной массы фосфолипидов). Для пересчета липидного фосфора на ммоль/л необходимо полученные результаты умножить на коэффициент 0,323. Оформление работы. По полученному значению экстинкции рассчитать содержание общих фосфолипидов и липидного фосфора в сыворотке крови. Сделать вывод относительно полученных данных. Практическое значение работы. Фосфолипиды сыворотки (плазмы) крови входят в состав липопротеидов, обусловливая вместе с белком полярные свойства этих смешанных макромолекул и их растворимость. В норме содержание общих фосфолипидов составляет 1,5-3,6 г/л, или 2,0-3,5 ммоль/л липидного фосфора. Важным показателем является индекс фосфолипиды/холестерин, который в физиологических условиях равен 1-1,5. Этот индекс снижается при атеросклерозе, гипертонической болезни, заболеваниях печени. Повышение концентрации фосфолипидов в сыворотке крови (гиперфосфолипидемия) наблюдается при сахарном диабете, гипотиреозе, при поражении почек и т.д. Пониженный уровень их встречается при тяжелых формах острого гепатита, жировом перерождении печени, тиреотоксикозе. Работа 54. Разделение липидов сыворотки крови методом тонкослойной хроматографии Метод основан на различной скорости перемещения липидных фракций сыворотки крови (фосфолипиды, свободные жирные кислоты, холестерин, глицериды) в тонком слое адсорбента при движении через него органического растворителя. Скорость разделения фракций зависит от их относительной полярности, и для их обнаружения полученные хроматограммы обрабатывают парами иода. Реактивы. Этанол – диэтиловый эфир (3:1); хлороформ; растворитель для хроматографии: н-гексан – диэтиловый эфир – уксусная кислота (73:25:2); иод металлический. Оборудование. Пластинки хроматографические Силуфол УФ254; камера для хроматографии; водяная баня; камера для проявления хроматограмм; хроматоскоп. Материал. Сыворотка крови. Ход определения. В мерной колбе вместимостью 25 мл смешивают 1 мл исследуемой сыворотки крови с 10 мл приготовленной спирто-эфирной смеси. Колбу с содержимым помещают на 30 с в кипящую водяную баню, охлаждают под струей холодной воды и доводят объем спирто-эфирной смесью до 25 мл. Полученный липидный экстракт отфильтровывают через обезжиренный бумажный фильтр в широкогорлую пробирку, выпаривают досуха в кипящей водяной бане, а осадок растворяют в 0,2 мл хлороформа. В хроматографическую камеру наливают 2-3 мл растворителя. Пастеровской пипеткой наносят на хроматографическую пластину, отступя 1 см от края, 0,01-0,02 мл хлороформного экстракта, помещают пластину в камеру этим концом вниз, погрузив его на 3-5 мм в растворитель. Камеру закрывают крышкой для поддержания равномерной концентрации паров. Хроматографию проводят при комнатной температуре до тех пор, пока фронт растворителя не приблизится к верхнему краю, не доходя до него 0,5 см. Полученную хроматограмму извлекают из камеры, высушивают на воздухе и вносят в камеру для проявления, на дно которой предварительно насыпают кристаллы металлического иода. Сосуд закрывают и подогревают в водяной бане при 60˚С. Возгоняющийся иод вступает в реакцию с липидными фракциями. Через 1 мин хроматограмму извлекают и просматривают в ультрафиолетовом свете на хроматоскопе. Фракции липидов обнаруживают в виде коричневых пятен. Ближе к линии старта расположены фосфолипиды, затем неидентифицированные соединения, холестерин, моноглицериды, свободные жирные кислоты, триглицериды и эфиры холестерина. Оформление работы. Зарисовать полученную хроматограмму, указав на ней соответствующие липидные фракции сыворотки крови. Указать в выводах возможность дальнейшего количественного определения липидных компонентов. |
