практикум по биохимии. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
КатепсиныГлобин ——————— (n + 1) Фрагменты глобина + nН2О Экстинкцию кислоторастворимых продуктов гидролиза глобина (пептиды, свободные аминокислоты) измеряют при 280 нм на спектрофотометре. В этой области спектра в основном поглощает тирозин и в меньшей степени триптофан и фенилаланин. Ход определения. В опытную пробирку вносят 1 мл раствора гемоглобина и 0,5 мл сыворотки крови, а в контрольную – те же вещества в том же объеме и 2 мл раствора трихлоруксусной кислоты. Пробы перемешивают встряхиванием. Ставят пробирки на 60 мин в водяную баню при 37˚С, после этого приливают к опытной пробе 2 мл раствора трихлоруксусной кислоты и перемешивают содержимое встряхиванием. Центрифугируют пробы 10 мин при 3000 об/мин, надосадочную жидкость сливают в чистые пробирки. Измеряют экстинкцию опытной пробы против контрольной на спектрофотометре при 280 нм в кювете с толщиной слоя 1 см. Расчет. Проводят с использованием калибровочного графика на тирозин или молярного коэффициента экстинкции тирозина: Е5000 х = —————— , 0,436 где х – активность катепсинов, ммоль тирозина/(ч∙л); Е – экстинкция опытной пробы против контрольной; 5000 – коэффициент пересчета на 1 л сыворотки крови; 0,436 – коэффициент экстинкции 1 ммоля тирозина. Оформление работы. По экстинкции рассчитать активность катепсинов в сыворотке крови, сделать вывод и отметить практическое значение определения данного фермента. Практическое значение работы. Катепсины, гидролизующие белки в кислой зоне рН, специфичны для лизосом тканей, поэтому в научных исследованиях их определяют как индикаторы чистоты лизосомальной фракции. При поражении органов, особенно при некрозах, активность катепсинов в сыворотке крови увеличивается. Это явление отмечено при инфаркте миокарда, причем степень повышения ферментативной активности в сыворотке крови зависит от глубины и распространенности некротического очага в сердце. Работа 57. Определение активности аспартат- и аланин - аминотрансферазы в сыворотке крови по Райтману и Френкелю Реактивы. Субстратные растворы № 1 и № 2*; 2,4-динитрофенилгидра зин, 0,1%-ный раствор на 2 М растворе соляной кислоты; гидроксид натрия, 0,4 М раствор. Оборудование. Штатив с пробирками; пипетки вместимостью 0,2; 1 и 5 мл; водяная баня; ФЭК. Материал. Сыворотка крови. Метод основан на определении пировиноградной кислоты, которая является одним из продуктов реакции, катализируемой аланинаминотрансферазой, или продуктом декарбоксилирования оксалацетата, образующегося в реакции, катализируемой аспартатаминотрансферазой. Образовавшаяся пировиноградная кислота определяется по цветной реакции с 2,4-динитрофенилгидразином (см. работу 31). Ход определения. Определение активности ферментов проводят по схеме
Фотометрируют опытные пробы против контрольной на ФЭКе при 500-560 нм (зеленый светофильтр) в кювете с толщиной слоя 1 см. Расчет производят по формулам: m10000 m10000∙2 х(АсАТ) = ———— или х(АлАТ) = ———— , 1000 1000 где х – активность ферментов, ммоль/(ч∙л); m – количество пировиноградной кислоты в пробе, найденное по калибровочному графику (рис. 9), мкмоль; 10000 – коэффициент пересчета на 1 л сыворотки; 1000 – коэффициент пересчета мкмоль в ммоль; 2 – для пересчета на 1 ч. 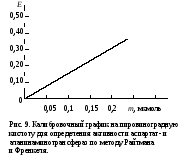 Практическое значение работы. В норме активность аланинаминотрансферазы составляет 0,1-0,68, а аспартатаминотрансферазы 0,1-0,45 ммоль/(ч∙л). Практическое значение работы. В норме активность аланинаминотрансферазы составляет 0,1-0,68, а аспартатаминотрансферазы 0,1-0,45 ммоль/(ч∙л).Определение активности АсАТ и АлАТ и их отношения широко используется в клинической практике для выявления патологических процессов в различных органах. В миокарде более высокая активность АсАТ, чем АлАТ, в печени обратное соотношение активности этих ферментов. При инфаркте миокарда значительно увеличивается активность АсАТ в сыворотке крови с одновременным повышением коэффициента АсАТ/АлАТ. При поражении печени (цирроз, сывороточный гепатит и т.д.) более выраженно повышается активность АлАТ и снижается коэффициент АсАТ/АлАТ. Работа 58. Определение активности гистидазы в сыворотке крови по Табору и Мелеру в модификации В.А.Буробина Реактивы. L-гистидина моногидрохлорид, 0,2 М раствор (418 мг в 100 мл), доведенный с помощью 1 М раствора NaOH до рН 8,2; пирофосфатный буфер, 0,1 М раствор с рН 8,2*; трихлоруксусная кислота, 20%-ный раствор; активирующий раствор, содержащий восстановленный глутатион и альбумин*; уроканиновая кислота, 0,001 М раствор для построения калибровочного графика (8,7 мг дигидрата уроканиновой кислоты растворяют в 0,001 М растворе NaOH в мерной колбе вместимостью 50 мл). Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 5 мл; водяная баня с лабораторным термометром; термостат, отрегулированный на 37˚С; центрифуга с центрифужными весами; спектрофотометр. Материал. Сыворотка крови. Метод основан на измерении экстинкции уроканиновой кислоты, образующейся из гистидина под действием гистидазы, в зоне ее максимального поглощения при 264 нм в кислой среде. Ферментативная реакция протекает по уравнению 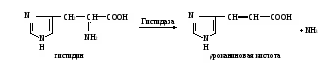 Ход работы. В две пробирки – контрольную и опытную – вносят по 0,3 мл пирофосфатного буфера, по 0,5 мл исследуемой сыворотки и по 1 мл активирующего раствора. В опытную пробирку приливают 1 мл раствора гистидина и доводят объем пробы до 3 мл дистиллированной водой. Перемешивают содержимое встряхиванием. Обе пробирки помещают на 2 ч в водяную баню или термостат при 37˚С, затем добавляют в пробирки по 1 мл раствора трихлоруксусной кислоты. После этого в контрольную пробу приливают 1 мл активирующего раствора, объем ее доводят до 3 мл дистиллированной водой и перемешивают содержимое встряхиванием. Пробы центрифугируют 5 мин при 3000 об/мин, после чего надосадочную жидкость сливают в чистые пробирки. Измеряют экстинкцию опытной работы против контрольной на спектрофотометре при 264 нм в кювете с толщиной слоя 1 см. Для построения калибровочного графика в семь пронумерованных пробирок вносят компоненты, перечисленные в приведенной ниже таблице, в указанных количествах. Для приготовления рабочего раствора уроканиновой кислоты берут ее исходный 0,001 М раствор и разбавляют в 10 раз дистиллированной водой. Доводят объем всех проб до 3 мл дистиллированной водой, добавляют во все пробирки по 1 мл раствора трихлоруксусной кислоты, перемешивают содержимое. Центрифугируют пробы 5 мин при 3000 об/мин, надосадочную жидкость сливают в чистые пробирки и измеряют экстинкцию, как указано выше.
Расчет производят по формуле | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
