практикум по биохимии. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
|
Практическое значение работы. Качественные реактивы (или, как их часто называют, цветные реакции) используются в клинико-биохимических лабораториях, фармацевтической практике и биохимических исследованиях для обнаружения присутствия белка и аминокислот в биологических средах, качественного анализа белковых лекарственных средств, препаратов гидролизатов белков и аминокислот, пептидов и белков на хроматограммах и электрофореграммах. Многие качественные реакции положены в основу методов количественного определения белков и аминокислот. Работа 2. Качественный анализ некоторых белковых препаратов Реактивы и оборудование те же, что и в работе 1. Материалы.
Метод анализа основан на использовании качественных реакций, рассмотренных в предыдущей работе, для выявления присутствия отдельных аминокислот в составе белковых препаратов. Ход определения. С белковыми препаратами проводят качественные реакции – биуретовую, нингидриновую, ксантопротеиновую, Миллона, Фоля, Адамкевича и нитропруссидную. Для проведения каждой реакции используют по 5 капель гидролизата белков и препарата желатина. Оформление работы. Полученные данные оформить в виде таблицы, приведенной в работе 1. В выводе показать наличие, согласно проведенному анализу, отдельных аминокислот и сравнительную полноценность исследуемых белковых препаратов. Практическое значение работы. Состав аминокислот определяет не только свойства белка, но и его питательную и лекарственную ценность. Биологически полноценными считаются белки, содержащие все незаменимые аминокислоты. Поэтому представляет интерес наличие именно этих аминокислот в белковых гидролизатах. Гидролизаты белков различной природы используются в медицине как лекарственные препараты для парентерального обмена. В лечебных целях применяются различные белки плазмы крови, желатина и др. В практике контроль качества и количественный анализ таких лекарственных средств, как гидролизаты белков и препаратов, содержащих смеси аминокислот или отдельные аминокислоты, основываются на качественном и количественном анализе конкретных аминокислот. Так, одним из основных показателей качества гидролизатов белков является содержание триптофана, которое составляет в аминопептиде и в фибриносоле около 0,5 г/л, а в растворах гидролизина и гидролизата казеина не менее 0,15 г/л. Работа 3. Хроматографический метод разделения аминокислот Хроматография – один из эффективных и широко применяемых в биохимических исследованиях методов разделения аминокислот. Наиболее простой и доступной является распределительная хроматография на бумаге. Для проведения ее используют систему растворителей, составляющих подвижную и неподвижную фазы, от правильного подбора которых зависит эффективность разделения аминокислот. В частности, применяют фенол, насыщенный водой. При обработке хроматографической бумаги этой смесью растворителей вода с небольшим количеством фенола впитывается в бумагу и образует неподвижную фазу, а фенол, насыщенный водой, служит подвижной фазой. В зависимости от направления фронта передвижения растворителя различают следующие виды хроматографии: восходящую, нисходящую, одномерную, двухмерную и радиальную. Расположение отдельных аминокислот обнаруживают путем проявления хроматограмм. Для этого высушенную бумагу обрабатывают раствором нингидрина и затем нагревают ее в сушильном шкафу при 100°С, т.е. проводится качественная нингидриновая реакция на аминокислоты, находящиеся на бумаге. Скорость перемещения аминокислот выражают коэффициентом Rf, который представляет собой отношение расстояния, пройденного данной аминокислотой, к пути, пройденному фронтом растворителя: Rf = a/b, где a – расстояние от места нанесения раствора смеси аминокислот (линия старта) до центра пятна конкретной аминокислоты; b – путь, пройденный растворителем от линии старта до его фронта окончания хроматографии, мм. Для каждой аминокислоты характерно свое значение Rf, которое зависит от сорта хроматографической бумаги, системы растворителей, температуры, рН среды и т.д. Реактивы. Фенол, насыщенный водой*; нингидрин, 0,2%-ный раствор в ацетоне. Оборудование. Термостат, отрегулированный на температуру 37-38°С; сушильный шкаф, отрегулированный на температуру 100-105°С и имеющий перекладины с крючками для подвешивания хроматограмм; большие пробирки (диаметр 2,0-2,5 см, длина 18-20 см) с плотно подогнанными пробками и штатив для них; полоски хроматографической бумаги (ленинградская, лучше марки «быстрая», 12х150 мм); простой карандаш и линейка; игла с ниткой; микропипетка; чашка Петри или пульверизатор; пинцет; ножницы; пипетка вместимостью 5 мл. Материалы. Раствор смеси L-аланина, лейцина и глутаминовой кислоты, 0,04 моль/л. Метод основан на разной скорости передвижения аминокислот по бумаге в зависимости от коэффициента распределения их между неподвижной (вода с примесью фенола) и подвижной (фенол, насыщенный водой) фазами растворителя. Ход определения. Берут пинцетом за конец полоску бумаги (не касаться бумаги пальцами!), прокалывают его иглой с ниткой, которую завязывают петлей длиной 5-6 см. На противоположном конце полоски, отступив от края 2 см, проводят простым карандашом линию старта и в центре ее очерчивают кружок диаметром 3-4 мм для нанесения раствора смеси аминокислот. Полоску укладывают на лежащие стеклянные пробирки и наносят 0,2 мл раствора смеси аминокислот, но не сразу, а порциями. После нанесения каждой порции пятно подсушивают, чтобы оно не расплывалось за пределы очерченного карандашом кружка. В сухую пробирку с помощью пипетки вносят 2 мл фенола, насыщенного водой (при работе с фенолом соблюдать осторожность: вызывает ожоги! Не насасывать его в пипетку ртом!), следя за тем, чтобы не смочить стенки пробирки. Ставят пробирку в штатив строго вертикально. Осторожно, держа за нитку, опускают в пробирку полоску бумаги, погружая ее нижний конец в растворитель не более чем на 2-3 мм, и закрепляют ее в висячем положении, прижав петлю плотно закрытой пробкой (рис.4). Помещают штатив с пробиркой в термостат (при 37-38°С) на 1,5 ч. 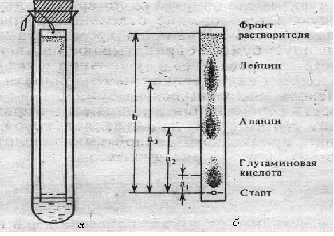 Рис. 4. Прибор для хроматографии (а) и хроматограмма аминокислот (б) Затем вынимают полоску, подвешивают ее за петлю в сушильном шкафу и выдерживают при 100-105°С в течение 10 мин. Для проявления хроматограммы полоску переносят в чашку Петри, в которую налито 15 мл раствора нингидрина, держа ее пинцетом, проводят через раствор и вновь помещают в сушильный шкаф на 5 мин при той же температуре. Оформление работы. Зарисовать в рабочем состоянии прибор, отметив положение аминокислот на хроматограмме. Измерить линейкой расстояния (в мм) a и b для каждой аминокислоты и рассчитать их Rf. В выводе отметить возможность разделения хроматографией на бумаге разных аминокислот. Практическое значение работы. Хроматографический анализ свободных аминокислот в сыворотке крови, моче и других жидких средах применяется в клинике для диагностики наследственных заболеваний обмена аминокислот, патологии печени, почек, а также при оценке степени тяжести сахарного диабета: в фармации – для контроля качества белковых гидролизатов и препаратов смеси аминокислот, а в научных экспериментах – для изучения аминокислотного состава гидролизатов очищенных белков. 2. Исследование физико-химических свойств белков Физико-химические свойства белка определяются особенностями его структурной организации, которая придает ему новые качества, отсутствующие у составляющих полипептидную цепь мономеров. Особенности физико-химических свойств белка лежат в основе многих приемов и методов, применяемых в клинико-биохимических лабораториях, фармацевтической практике и в экспериментальной биохимии для его выделения и очистки, качественного и количественного анализа. Работа 4. Диализ белков Диализ демонстрирует макромолекулярную природу белка. Как и все высокомолекулярные соединения, белок не проникает через искусственные (например, целлофан, пергамент и др.) и биологические мембраны, что позволяет использовать диализ как метод очистки белка от низкомолекулярных органических и неорганических примесей. С этой целью применяется специальный прибор – диализатор (или электродиализатор). Простейший из них представляет собой сделанный из целлофана или другого подобного ему материала мешочек, наполненный раствором очищаемого белка и погруженный в стакан с дистиллированной водой. Реактивы. Сульфат аммония, насыщенный раствор; хлорид бария, 5%-ный раствор; биуретовый реактив*. Оборудование. Целлофан, предварительно разрезанный на куски размером 125х125 мм (можно применять заводской диализаторный материал); стакан с дистиллированной водой; стеклянные палочки; резиновые колечки; штатив с пробирками; пипетки. Материал. Раствор яичного белка (приготовление см. работу 1) или сыворотка крови. Метод основан на способности мембран задерживать макромолекулы белка и пропускать неорганические ионы. Ход определения. К 5 мл раствора яичного белка (или сыворотки крови) добавляют каплю насыщенного раствора сульфата аммония и перемешивают. Отбирают в две пробирки по 10 капель раствора и проделывают в одной из них биуретовую реакцию, а в другой – пробу на сульфаты. При проведении пробы на сульфаты добавляют 2-3 капли раствора хлорида бария. Целлофану, предварительно замоченному в дистиллированной воде, придают форму мешочка, который примерно на 1/3 заполняют исследуемым раствором белка. Края мешочка зажимают между двумя стеклянными палочками, которые прижимают друг к другу с помощью надетых с двух концов резиновых колечек. Мешочек погружают в стакан с дистиллированной водой, положив зажимающие его стеклянные палочки на края стакана. Уровень жидкости в мешочке не должен быть выше уровня жидкости в стакане (рис.5). 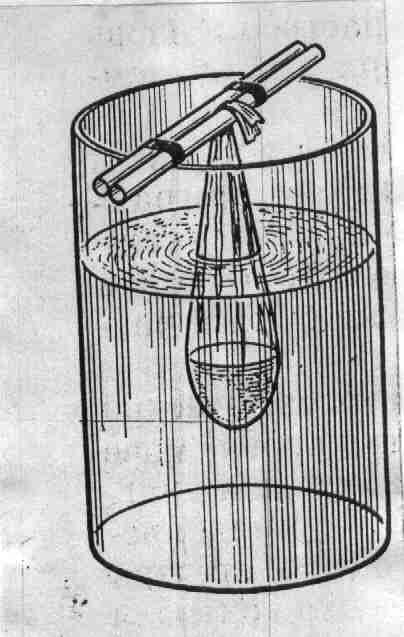 |
