практикум по биохимии. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
Работа 10. Выявление углеводного компонента гликопротеидовГликопротеиды – это сложные белки, содержащие углеводный компонент. Он составляет, как правило, примерно 10-20% от массы всей макромолекулы. Исключение представляют так называемые вещества групп крови, содержащиеся в эритроцитах. У этих гликопротеидов углеводная часть составляет до 80% от массы макромолекулы. В гликопротеидах углевод с белком соединен ковалентной связью. В состав небелкового фрагмента гликопротеидов входят разнообразные моносахариды и их производные: глюкоза, галактоза, манноза, ксилоза, арабиноза, фукоза, рамноза, глюкозамин, ацетилглюкозамин, нейраминовая кислота, глюкуроновая кислота и др. Гликопротеиды широко распространены в организме человека и животных и выполняют многочисленные биологические функции. Например, гликопротеидами являются транспортные белки плазмы (гаптоглобин, трансферрин, транскортин и др.), факторы свертывания крови (протромбин, фибриноген), иммуноглобулины, ферменты (холинэстераза, рибонуклеаза В), гормоны (гонадотропины, кортикотропин). Эта группа сложных белков содержится во внутрисуставной жидкости, где они выполняют механическую функцию. Гликопротеиды входят в состав слизистых секретов – слюны, желудочного и кишечного соков, облегчая движение пищи по кишечнику. Особенность моносахаридного состава углеводной части гликопротеидов определяет методы их качественного и количественного анализа. Реактивы. Уксусная кислота, конц.; α-нафтол, 1%-ный спиртовой раствор; серная кислота, конц. Оборудование. Штатив с пробирками; глазные пипетки; пипетки вместимостью 5 мл; стеклянные палочки; фильтровальная бумага. Материал.
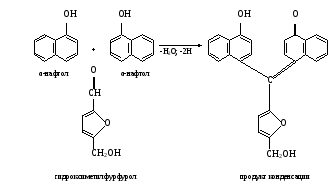 Метод основан на способности гидроксиметилфурфурола, образующегося из гексоз гликопротеидов под влиянием концентрированной серной кислоты, давать с α-нафтолом продукт конденсации красно-фиолетового цвета: Метод основан на способности гидроксиметилфурфурола, образующегося из гексоз гликопротеидов под влиянием концентрированной серной кислоты, давать с α-нафтолом продукт конденсации красно-фиолетового цвета:Ход определения. В пробирку вносят 2 мл слюны и прибавляют по каплям половинный объем концентрированной уксусной кислоты, помешивая содержимое стеклянной палочкой. Муцин слюны осаждается в виде комочка. Жидкость осторожно сливают, придерживая комочек муцина стеклянной палочкой. Обсушивают сгусток полоской фильтровальной бумаги. К муцину добавляют 10-20 капель спиртового раствора α-нафтола и по стенке пробирки, наклонив ее, осторожно наслаивают 20 капель концентрированной серной кислоты. Образуется окрашенное кольцо. При осторожном встряхивании пробирки постепенно окрашивается ее содержимое. Ту же реакцию, что и с муцином, проделывают с препаратами кортикотропина и хорионического гонадотропина, используя для этих целей по 5 капель исследуемых веществ. Оформление работы. Результаты оформить в виде таблицы.
В выводе отметить наличие соответствующих простетических групп в изучаемых объектах. Практическое значение работы. Качественные реакции на простетическую группу гликопротеидов используются для выявления их в различном биологическом материале и лекарственных препаратах. Эти реакции лежат в основе методов количественного определения гликопротеидов. Работа 11. Качественные реакции на фосфопротеиды(на примере казеина молока) Простетической группой фосфопротеидов является остаток фосфорной кислоты, который эфирной связью соединен с гидроксилом серина или треонина белковой части. Фосфорная кислота составляет 0,4-0,9% от массы молекулы фосфопротеида. К фосфопротеидам относятся казеиноген (казеин) молока, вителлин, вителленин и витин яичных желтков, ферменты – фосфорилаза, фосфоглюкомутаза и многие другие. Казеиноген является полноценным белком, содержащим все незаменимые аминокислоты. В молоке он связан не только с остатком фосфорной кислоты, но и с ионами кальция. Свертывание молока при подкислении объясняется выпадением осадка казеиногена. Под действием пищеварительных ферментов (пепсин, химозин) казеиноген превращается в казеин, что сопровождается свертыванием (створаживанием) молока. Присутствие фосфопротеидов в материале можно обнаружить реакциями на фосфаты. Реактивы. Биуретовый реактив*; молибдат аммония в азотной кислоте*; азотная кислота, конц.; гидроксид натрия, 10%-ный раствор; аскорбиновая кислота, 1%-ный раствор на 1 М растворе соляной кислоты. Оборудование. Весы аптечные с разновесом; штатив с пробирками; стеклянные палочки; пипетки вместимостью 5 мл; водяная баня. Материал. Казеин, сухой порошок. Метод основан на обнаружении в гидролизатах казеина белкового компонента по биуретовой реакции, а фосфорной кислоты – по реакции с молибдатом аммония, в результате которой образуется фосфомолибденовый комплекс: H3PO4 + 12(NH4)2MoO4 + 21HNO3 → (NH4)3(PO4∙12MoO3) + 21NH4NO3 + 12H2O молибдат фосфомолибдат аммония аммония Под действием восстановителей (аскорбиновая кислота) фосфомолибдат аммония переходит в молибденовую синь. Ход определения. В пробирку отвешивают 0,1 г сухого порошка казеина. Добавляют 5 мл раствора гидроксида натрия и ставят в кипящую водяную баню на 30 мин. После охлаждения отбирают в пробирку 10 капель гидролизата и проводят реакцию с биуретовым реактивом, добавляя его 3-5 капель. Отмечают появление характерного окрашивания. В другую пробирку вносят 20 капель гидролизата и нейтрализуют его, прибавляя по каплям концентрированную азотную кислоту до слабой реакции (по лакмусовой бумаге, кусочек которой заранее помещают в пробирку). Затем добавляют 10 капель раствора молибдата аммония, перемешивают содержимое встряхиванием и наливают 10 капель раствора аскорбиновой кислоты. Вновь перемешивают и оставляют стоять пробы до развития специфического окрашивания. Оформление работы. Отметить результат проведенных качественных реакций, в выводе указать химическую природу казеина молока. Практическое значение работы. Качественные реакции на фосфатную группу используются для обнаружения фосфопротеидов в исследуемых образцах. Работа 12. Количественное определение содержания сиаловых кислот в сыворотке крови методом Гесса Реактивы. Раствор трихлоруксусной кислоты, 10%-ный раствор; уксусно-сернокислый реактив (95 мл ледяной кислоты и 5 мл концентрированной серной кислоты). Оборудование. Штатив с пробирками; пипетки вместимостью 1,0; 5,0; центрифуга; водяная баня; ФЭК. Материал. Сыворотка крови. Метод основан на способности нейраминовой кислоты, освобождающейся при гидролизе сывороточных гликопротеидов, образовывать окрашенные соединения при нагревании с уксусно-сернокислым реактивом. Ход определения. В центрифужную пробирку вносят 1,0 мл сыворотки крови и добавляют 1,0 мл 10% раствора трихлоруксусной кислоты. Пробирку помещают в кипящую водяную баню точно (!) на 5 минут. Охлаждают под струей воды в течение 5 минут. Встряхивают и центрифугируют 5 минут при 3000 об/мин. Отбирают 0,4 мл надосадочной жидкости, переносят в пробирку, наливают 5,0 мл уксусно-сернокислого реактива и помещают на 30 минут в кипящую водяную баню. Охлаждают до комнатной температуры и интенсивность окраски определяют на ФЭКе при длине волны 500-560 нм (зеленый светофильтр) в кювете толщиной 10 мм против контроля. Контролем служит уксусно-сернокислый реактив. Расчет. Определите количество сиаловых кислот по калибровочному графику и рассчитайте содержание по формуле: а∙5∙100 Х = ————— , 1000∙1000 где а – содержание сиаловых кислот в исследуемой пробе в мкг, найденное по калибровочному графику; 5 – расчет на 1 мл сыворотки; 1000 (в числителе) – для перевода на 1 л сыворотки; 1000 (в знаменателе) – для пересчета в мг и г. Оформление работы. По полученным значениям экстинкций сделать расчет содержания сиаловых кислот в г/л. Пересчитать их содержание в ммоль/л согласно формуле: а∙103 Х = ———— , 309 где а – количество сиаловых кислот в г/л; 103 – перевод г в мг; 309 – молекулярный вес сиаловых кислот. Практическое значение работы. В норме содержание сиаловых кислот в сыворотке крови колеблется от 2,0 до 2,36 ммоль/л (0,62-0,73 г/л). Их количество значительно возрастает при заболеваниях, связанных с деструкцией соединительной ткани, при туберкулезе, инфаркте миокарда, опухоли головного мозга. Снижение содержания отмечается при пернициозной анемии, болезни Вильсона, дегенеративных процессах центральной нервной системы. Работа 13. Химическая природа нуклеопротеидов Нуклеиновые кислоты присутствуют во всех клетках (за исключением эритроцитов) организма человека в виде комплекса с белками, т.е. образуют нуклеопротеиды. Они в большом количестве содержатся в селезенке, зобной железе, печени и других органах и тканях, богатых ядрами. Из этих органов проще выделять и изучать нуклеопротеиды и нуклеиновые кислоты. Нуклеопротеиды делятся на дезоксирибонуклеопротеиды (ДНП) и рибонуклеопротеиды (РНП), в которых фосфатные группы ДНК или РНК электростатически взаимодействуют с белками. Нуклеиновые кислоты – высокомолекулярные соединения, состоящие из мононуклеотидов, соединенных 3’, 5’- фосфодиэфирными связями. Они плохо растворимы в воде, образуя вязкие гелеподобные растворы. Хорошо растворимы в щелочах, растворах минеральных кислот и солей. Реактивы. Хлорид натрия, 5%-ный раствор, содержащий 0,04% трехзамещенного цитрата натрия; гидроксид натрия, 0,4%-ный раствор; дифениламиновый реактив*; биуретовый реактив*. Оборудование. Штатив с пробирками; ступка с пестиком; стеклянный порошок; пипетки; мерные цилиндры вместимостью 50 и 300 мл; пипетки вместимостью 1 мл; кристаллизатор; деревянные палочки с насечками; водяная баня; круглодонная колба с обратным холодильником; марля для фильтрования. Материал.
а. Выделение дезоксирибонуклеопротеида из ткани селезенки. Метод основан на способности дезоксирибонуклеопротеидов растворяться в солевых растворах большой ионной силы и выпадать в осадок при снижении их концентрации. Ход определения. 2/3 г ткани селезенки тщательно растирают в ступке со стеклянным порошком, приливая постепенно небольшими порциями 35-40 мл раствора хлорида натрия. Полученный вязкий раствор фильтруют через 2 слоя марли в малый кристаллизатор. Отмеряют цилиндром шестикратный (по отношению к фильтру) объем дистиллированной воды и медленно выливают ее в фильтрат. Образовавшиеся нити дезоксинуклеопротеида осторожно наматывают на деревянную палочку, переносят в пробирку для использования в последующей работе. б. Качественная реакция на ДНК (реакция Дише). Метод основан на способности дезоксирибозы, входящей в ДНК дезоксирибонуклеопротеида, образовывать соединение синего цвета с дифениламином при нагревании в среде, содержащей смесь ледяной уксусной и концентрированной серной кислот. С рибозой РНК аналогичная реакция дает зеленое окрашивание. Ход определения. К ¼ части осадка дезоксирибонуклеопротеида приливают 1 мл 0,4%-ного раствора гидроксида натрия (до растворения). Добавляют 0,5 мл дифениламинового реактива. Содержимое пробирки перемешивают и ставят на кипящую водяную баню на 15-20 мин. Аналогичную реакцию выполняют в другой пробирке с 1 мл раствора РНК. Отмечают характерное окрашивание в пробах. в. Выявление белкового компонента дезоксирибонуклеопротеида (ДНП). Метод основан на биуретовой реакции (описана в работе 1). Ход определения. Переносят часть полученных ранее нитей ДНП в пробирку, добавляют 0,5 мл раствора гидроксида натрия до растворения нитей и 5 капель биуретового реактива. Наблюдают за появлением окрашивания. г. Гидролиз дезоксирибонуклеопротеидов. Ход определения. Оставшуюся часть осадка дезоксирибонуклеопротеидов, полученных из ткани селезенки, помещают в колбочку для гидролиза, добавляют 30-40 мл 5%-ного раствора серной кислоты. Закрывают колбочку пробкой с обратным холодильником и осторожно кипятят содержимое на асбестовой сетке на медленном огне в течение 30-40 мин. Полученный гидролизат охлаждают и используют для определения составных компонентов ДНК в последующей работе (гидролизат хранить в холодильнике). Оформление работы. В выводе отметить возможность выделения нуклеопротеидов с помощью солевых растворов и их идентификации с помощью реакций на нуклеиновый компонент. Практическое значение работы. Выделение и очистку дезоксирибонуклеопротеидов из гомогенатов и ядер клеток с помощью растворов хлорида натрия разной концентрации используют в экспериментальной биохимии. Дифениламиновая проба лежит в основе методов качественного и количественного определения нуклеопротеидов и нуклеиновых кислот в биологическом материале. В клинической цитологии эти реакции применяют при нативной окраске нуклеиновых кислот, например, в мазках клеток крови. НУКЛЕИНОВЫЕ КИСЛОТЫ При гидролизе нуклеопротеиды и нуклеиновые кислоты распадаются на составные части. Обнаружение и методы количественного определения нуклеиновых кислот и их мономеров (нуклеотидов) в биологическом материале и препаратах основаны на особенностях химической природы этих соединений. 1. Исследование химической природы нуклеиновых кислот ДНК и РНК, имея сходство в строении, несколько отличаются по составным компонентам: в ДНК содержится тимин, а в РНК – урацил. Кроме того, углеводная часть в ДНК представлена дезоксирибозой, а в РНК – рибозой. Поэтому по специфическим реакциям на эти моносахариды можно выявить соответствующие нуклеиновые кислоты и нуклеотиды. Работа 14. Качественные реакции на компоненты нуклеиновых кислот Реактивы. Нитрат серебра, 2%-ный аммиачный раствор*; раствор аммиака, конц.; аскорбиновая кислота, 1%-ный раствор; молибдат аммония, раствор в азотной кислоте*; орциновый реактив*; дифениламиновый реактив*. Оборудование. Глазные пипетки; пипетки вместимостью 1 мл; штатив с пробирками; водяная баня. Материал.
OH а. Проба на пуриновые основания. Метод основан на способности пуриновых оснований с аммиачным раствором нитрата серебра образовывать осадок серебряных солей пуриновых оснований (аденина, гуанина), окрашенных в светло-коричневый цвет, по уравнению N N OH CH↓ + NH4NO3 + H2O N N N N + AgNO3 + NH4OH → H2N HN2 N H N CH Ag серебряная соль гуанина гуанин Ход определения. В пробирку вносят 10 капель гидролизата, помещают в него кусочек лакмусовой бумаги и приливают по каплям примерно 10 капель концентрированного раствора аммиака до щелочной реакции по лакмусу. Добавляют 10 капель аммиачного раствора нитрата серебра. При стоянии образуется осадок с характерной окраской. б. Дифениламиновая проба на пентозы. Принцип метода см. работу 13, б. Ход определения. Для определения берут 5 капель гидролизата и проделывают реакцию, как описано в работе 13, б. в. Молибденовая проба на фосфорную кислоту. Принцип метода см. работу 11. Ход определения. Берут 10 капель гидролизата и проделывают реакцию, как описано в работе 11. г. Качественные реакции на лекарственные препараты нуклеотидной природы. Метод основан на обнаружении рибозы в препаратах нуклеотидной природы с помощью дифениламиновой реакции и пробы с орциновым реактивом. Последняя состоит в том, что фурфурол, образующийся из рибозы при нагревании в среде с соляной кислотой, дает с орцином окрашенное соединение зеленого цвета. Ход определения. В две пробирки добавляют по 5 капель соответственно раствора фосфадена и аденозинтрифосфата натрия. К ним приливают по 10 капель дифениламинового реактива, нагревают 10 мин на кипящей водяной бане. Отмечают результат реакции. В две другие пробирки вносят по 5 капель тех же веществ и добавляют по 5 капель орцинового реактива. Нагревают в течение 20 мин на кипящей водяной бане. Отмечают результат реакции. Оформление работы. По результатам работы сделать вывод о возможности использования реакции для обнаружения компонентов нуклеиновых кислот и нуклеотидов и их применения в практике. Данные оформить в виде таблицы.
Практическое значение работы. Реакции на компоненты нуклеиновых кислот и нуклеотиды могут применяться для их идентификации и количественного анализа в биохимических исследованиях, а в фармации – для контроля качества препаратов нуклеотидной и нуклеозидной природы.
нуклеиновых кислот Для количественного определения нуклеиновых кислот используют методы, основанные на регистрации их светопоглощения или на специфических реакциях на отдельные компоненты этих соединений. Нуклеиновые кислоты имеют максимум поглощения света при 260 нм, который обусловлен присутствием в них азотистых оснований. Все основания полинуклеотидов обладают тем же максимумом абсорбции, за исключением цитозина, зона наибольшего поглощения которого находится при 270 нм. Поэтому по интенсивности светопоглощения азотистых оснований нуклеотидов можно определить содержание нуклеиновой кислоты в экстрактах из биологического материала или растворах. Однако светопоглощение природной ДНК на 40-50% ниже, чем составляющих ее нуклеотидов. Этот так называемый «гипохромный эффект» связан с двуспиральной структурой природной ДНК. Гипохромный эффект характерен также и для РНК, содержащих спиральные участки или петли. Учитывая эти особенности нуклеиновых кислот, А.С.Спирин разработал метод измерения светопоглощения гидрализатов ДНК и РНК при двух длинах волн – 270 и 290 нм, поскольку при этих условиях на определение концентрации нуклеиновых кислот практически не влияют различия в их нуклеотидном составе. Количество нуклеиновых кислот в пробах можно измерить, используя реакции на пентозы с дифениламином и орцином. Однако следует учитывать, что при кислотном гидролизе ДНК разрушается N-гликозидная связь в пуриннуклеотидах, но не в пиримидиннуклеотидах. Поэтому только часть дезоксирибозы становится реакционноспособной, причем величина ее определяется нуклеотидным составом (отношением пуринов к пиримидинам) ДНК. Практическое значение работ по количественному определению нуклеиновых кислот. Количественное определение нуклеиновых кислот, выделяемых при биохимических исследованиях тканей и клеток, можно проводить прямой спектрофотометрией в ультрафиолетовой области или с помощью специфических реакций на пентозы: дифениламиновой – на дезоксирибозу, а с орциновой – на рибозу. Эти же методы можно использовать и при хроматографическом разделении пуриновых и пиримидиновых нуклеозидов или нуклеотидов. Количественные методы определения нуклеиновых кислот применяются в экспериментальной и клинической биохимии, а также для количественного анализа лекарственных средств нуклеотидной или нуклеозидной природы в контрольно-аналитических лабораториях. Работа 15. Спектрофотометрический метод количественного определения нуклеиновых кислот по А.С.Спирину Реактивы. Хлорная кислота, 1 М раствор. Оборудование. Штатив с пробирками и капельницами; пипетки вместимостью 2 мл; водяная баня; спектрофотометр. Материал.
Метод основан на измерении светопоглощения нуклеиновых кислот при 270 и 290 нм, интенсивность которого пропорциональна их количеству в пробах. Ход определения. В одну пробирку вносят 1,0 мл гидролизата ДНК, в другую – тот же объем раствора РНК и доводят дистиллированной водой до 1,5 мл. Добавляют в каждую пробу по 1,5 мл раствора хлорной кислоты, закрывают пробирки капельницами и ставят на гидролиз в кипящую водяную баню на 20 мин. Гидролизаты охлаждают. Определяют экстинкцию содержимого каждой пробы на спектрофотометре в кювете с толщиной слоя 1 см при 270 и 290 нм. Расчет. Содержание ДНК рассчитывают по формуле (Е270 – Е290) · 10,1 х1 = —————————— , 0,19 а РНК – по формуле (Е270 – Е290) · 10,5 х2 = —————————— , 0,19 где х1 и х2 – концентрации ДНК и РНК, мг/л; Е270 – экстинкция исследуемого гидролизата при 270 нм; Е290 – экстинкция исследуемого гидролизата при 290 нм; 0,19 – удельная экстинкция фосфора нуклеиновых кислот в концентрации 1 мг/л; 10,1 и 10,5 – коэффициенты пересчета содержания фосфора на концентрацию нуклеиновых кислот исходя из теоретического содержания фосфора в ДНК 9,9% и в РНК 9,5%. Примечание. Предварительно проверяют чистоту образца. Для этого измеряют экстинкцию исследуемых растворов ДНК и РНК при 260, 270 и 290 нм. Отношение Е260/Е270 не должно быть выше 1,2, а отношение Е270/Е290 – не меньше 2,0. Если эти условия не соблюдаются, то пробы содержат примеси нуклеиновой природы. Оформление работы. По результатам измерений отметить чистоту образцов нуклеиновых кислот, рассчитать их концентрацию в исследуемых пробах. В выводе указать возможности данного метода определения содержания нуклеиновых кислот. Работа 16. Фотоколориметрические методы количественного определения нуклеиновых кислот Реактивы. Хлорная кислота, 1 М раствор; дифениламиновый реактив*; орциновый реактив*. Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 2 мл; водяная баня; ФЭК. Материал.
а. Определение содержания ДНК (по Дише). Метод основан на образовании окрашенного комплекса дезоксирибозы с дифениламином (см. работу 13, б), интенсивность которого пропорциональна концентрации этой пентозы в гидролизатах ДНК. Ход определения. В пробирку наливают 0,5 мл стандартного раствора ДНК и равный объем раствора хлорной кислоты. Ставят пробирку в кипящую водяную баню на 10 мин. Затем охлаждают содержимое. Во вторую пробирку вносят 1 мл гидролизата ДНК ткани селезенки (опытная проба), затем прибавляют в обе пробирки по 2 мл дифениламинового реактива Дише. Пробы перемешивают стеклянной палочкой и ставят пробирки в кипящую водяную баню на 10 мин для развития окраски. Затем содержимое пробирок охлаждают. Опытную и стандартные пробы фотометрируют против контрольной пробы на ФЭКе при красном светофильтре (длина волны 595 нм) в кювете с толщиной слоя 0,5 см. Контрольную пробу готовят перед фотометрией. Она содержит 0,5 мл дистиллированной воды, 0,5 мл раствора хлорной кислоты, 2 мл реактива Дише. Кипятят содержимое пробирки в течение 10 мин на водяной бане. Охлаждают. Расчет. Содержание ДНК в опытной пробе х (г/л) рассчитывают по формуле Еоп х = ———— , Ест , где Еоп – экстинкция опытной пробы против контрольной; Ест – экстинкция стандартной пробы против контрольной. Оформление работы. По экстинкции рассчитать концентрацию опытного образца ДНК, указать в выводе возможность использования дифениламиновой реакции для количественного определения ДНК. б. Определение содержания РНК. Метод основан на образовании окрашенного комплекса рибозы, входящей в состав РНК, с орцином. Интенсивность окрашивания пропорциональна концентрации РНК в растворе. Ход определения. В две пробирки добавляют по 2 мл соответственно исследуемого (опытного) и стандартного растворов РНК, приливают по 2 мл орцинового реактива и нагревают на кипящей водяной бане 20 мин. Пробы охлаждают. Фотометрию опытной и стандартной проб проводят против контрольной на ФЭКе при красном светофильтре (длина волны 670 нм) в кювете с толщиной слоя 0,5 см. Контрольная проба обрабатывается так же, только вместо раствора РНК используется такое же количество дистиллированной воды. Расчет. Концентрацию РНК в опытном образце х (г/л) рассчитывают по формуле Еоп х = —————— , Ест где Еоп – экстинкция опытной пробы против контрольной; Ест – экстинкция стандартной пробы против контрольной. Оформление работы. По экстинкциям рассчитать концентрацию опытного образца РНК, указать в выводе возможность количественного определения РНК по орциновой реакции на пентозы. ЛИПИДЫ Липиды – разнородная по химическому строению группа органических веществ биологического происхождения, практически нерастворимых в воде и легко растворимых в органических неполярных (хлороформ, эфир, бензол, дихлорэтан и др.) и полярных (этанол, метанол, ацетон и др.) жидкостях. Разнообразие химического строения липидов затрудняет их классификацию. Эту группу веществ можно разделить на липидные мономеры (жирные кислоты, высшие алифатические и аминоспирты и др.), простые липиды (ацилглицерины, воска, диольные липиды), сложные липиды (фосфолипиды и гликолипиды) и стероиды (наиболее распространенный из них – холестерин и его эфиры). Биологические функции липидов в живых организмах многообразны. Они содержатся в жидких средах и входят в состав биологических мембран клеток организма. Ввиду плохой растворимости в воде липиды образуют соединения с гидрофильными молекулами – белками, углеводами. Образование липид-белковых комплексов (липопротеидов) придает липидам растворимость в воде и позволяет транспортироваться с кровью и лимфой в организме. Своеобразие растворимости используется при исследовании липидов, поскольку позволяет отделить их от других веществ, которые находятся в биологическом материале. Поэтому подбор растворителей в ходе извлечения липидов из образцов имеет большое значение при их анализе. Для обнаружения и количественного определения отдельных представителей липидов, экстрагированных из биологического материала, существуют различные физико-химические методы и реакции на функциональные группы. Анализ липидов проводят путем постановки специфических реакций на составные части в целой молекуле или после ее гидролиза. Работа 17. Исследование фосфолипидовФосфолипиды содержат высшие насыщенные и ненасыщенные жирные кислоты и их альдегиды, которые соединены эфирной связью с глицерином или сфингозином, фосфорную кислоту и остаточный спирт (холин, этаноламин, серин, инозит). В зависимости от строения различают фосфатидилхолины, фосфатидилинозиты, ацетальфосфатиды, кардиолипин и сфингофосфатиды. Особенно богаты фосфолипидами нервная ткань, желток яиц. Реактивы. Этиловый спирт; 96%-ный; сульфат кальция (гипс, порошок); ацетон; хлорид калия, насыщенный раствор в 96%-ном этаноле; гидроксид натрия, 10%-ный раствор; соляная кислота, 10%-ный раствор; гидросульфит калия, безводный порошок; реактив молибдата аммония*; нитрат калия, порошок; карбонат калия, порошок; азотная кислота, 10%-ный раствор; лакмусовая бумага. Оборудование. Весы аптечные; ступка с пестиком; стеклянные пластинки (100х50 мм); стеклянные палочки; скальпель; глазные пипетки; пипетки вместимостью 2 и 5 мл; воронки с бумажными фильтрами; водяная баня; тигли; сушильный шкаф, отрегулированный на 60˚С. Материал. Головной мозг лабораторного животного. а. Извлечение фосфатидилхолинов из ткани мозга. Метод основан на экстракции горячим этанолом фосфатидилхолинов из мозга, осаждении их ацетоном и гидролизе в среде с гидроксидом натрия на составные части (жирные кислоты, глицерин, холин и фосфорная кислота). Ход определения. Помещают навеску 1 г ткани мозга в ступку и тщательно растирают с 2-3 г гипса до получения густой кашицы. Кашицу распределяют тонким слоем на стеклянной пластинке при помощи скальпеля и высушивают в сушильном шкафу при 60˚С досуха. Сухую массу соскабливают со стекла скальпелем в сухую ступку, растирают и затем переносят в сухую пробирку. Приливают 5 мл этанола, пробирку закрывают пробкой с обратным холодильником (стеклянная трубка длиной 70-80 см). Пробирку ставят в водяную баню и нагревают 10-15 мин при 70˚С (для экстракции). Затем спиртовой экстракт отфильтровывают через бумажный фильтр. Если раствор будет мутным, то фильтрование повторяют через тот же фильтр. Фильтрат используют для анализа. б. Обнаружение фосфатидилхолинов в экстрактах. Метод основан на нерастворимости фосфатидилхолинов в ацетоне, способности их образовывать эмульсии в воде и давать комплексное соединение с хлоридом кадмия, выпадающее в виде хлопьевидного осадка. Ход определения. Наливают в сухую пробирку 2 мл ацетона и по каплям прибавляют спиртовой фильтрат, полученный в предыдущем опыте. Наблюдают за помутнением жидкости и выпадением осадка. В пробирку вносят 20 капель дистиллированной воды и постепенно приливают 5 капель спиртового фильтрата мозга. Встряхивают содержимое и наблюдают за образованием устойчивой белой эмульсии. К смеси добавляют 1 мл спиртового фильтрата мозга и прибавляют 0,5 мл спиртового раствора хлорида кадмия. Отмечают выпадение хлопьевидного осадка. в. Выявление составных компонентов фосфатидилхолинов. Метод основан на гидролизе выделенных фосфатидилхолинов в растворе гидроксида натрия и постановке качественных реакций на составные части их молекул: жирные кислоты, глицерин, холин и фосфорную кислоту. Жирные кислоты обнаруживают добавлением соляной кислоты к гидролизату, содержащему растворимые натриевые соли жирных кислот; в результате образуются нерастворимые свободные жирные кислоты, всплывающие на поверхность. Холин при нагревании превращается в триметиламин, имеющий запах селедочного рассола нагревание HOCH2 — CH2 — N+(CH3)3 → N(CH3)3 + НО — CH2 — CH2 — OH холин триметиламин этиленгликоль Триметиламин обладает выраженными основными свойствами, поэтому выявляется по посинению лакмусовой бумажки. Акролеин обнаруживается по характерному раздражающему запаху. Реакция, на которой основано обнаружение фосфорной кислоты, изложена в работе 11. Ход определения.
Оформление работы. Результаты оформить в виде таблицы и описать признаки, по которым обнаруживается соответствующее вещество.
|
