Расшифровка маркировки, область применения (агрессивное воздействие среды, давление, температура)
 Скачать 7.79 Mb. Скачать 7.79 Mb.
|
|
Гидродинамические режимы течения жидкости в противоточных насадочных и тарельчатых колоннах. Первый режим – пленочный - наблюдается при небольших плотностях орошения на малых скоростях газа. В этом режиме отсутствует влияние газового потока на скорость стекания по насадке жидкой пленки и, следовательно, на количество задерживаемой в насадке жидкости. Второй режим - режим подвисания (или торможения}.Повышение скорости газа приводит к заметному увеличению сил трения о жидкость на поверхности контакта фаз и подтормаживанию жидкости газовым потоком. Вследствие этого скорость течения пленки жидкости уменьшается, а ее толщина и количество удерживаемой жидкости в насадке увеличиваются. В режиме подвисания с повышением скорости газа нарушается спокойное течение пленки жидкости, появляются завихрения,брызги, увеличивается смоченная поверхность насадки и соответственно интенсивность процесса массопередачи. Третий режим - режим эмульгирования — возникает при превышениискорости. В результате происходит накопление жидкости в свободном объеме насадки до тех пор, пока сила трения между стекающей жидкостью и поднимающимся по колонне газом не уравновесит силу тяжести жидкости, находящейся в насадке. При этом наступает обращение, или инверсия, фаз (жидкость становится сплошной фазой, а газ - дисперсной). Образуется газожидкостная дисперсная система, по внешнему виду напоминающая барботажный слой (пену) или газожидкостную эмульсию. Режим эмульгирования начинается в самом узком сечении насадки, плотность засыпки которой неравномерна по сечению колонны. Путем тщательного регулирования подачи газа режим эмульгирования может быть установлен по всей высоте насадки . Режим эмульгирования соответствует максимальной эффективности насадочных колонн преимущественно вследствие увеличения контакта фаз, который в этом режиме определяется не столько поверхностью насадочных тел, сколько поверхностью образующейся газожидкостной эмульсии, заполняющей весь свободный объем насадки. Следует отметить, что это повышение эффективности насадочной колонны сопровождается резким увеличением ее гидравлического сопротивления. В насадочных колоннах без специальных устройств поддерживать режим эмульгирования очень трудно, так как мал интервал изменения скоростей газа, при котором насадочная колонна работает в этом режиме. Поэтому разработана специальная конструкция эмульгационной колонны . Как правило, работа в режиме подвисания и эмульгирования целесообразна только в случае, если повышение гидравлического сопротивления аппарата не имеет существенного значения (например, если абсорбер работает при повышенных давлениях). Поэтому большинство насадочных адсорберов работает в пленочном режиме. Пределом устойчивой работы насадочных колонн является скорость газа, соответствующая точке инверсии (или захлебывания). Четвертый режим - режим уноса, или обращенного движения жидкости, выносимой из аппарата газом. Этот режим в технике не используется. 45 Расчет высоты массообменных аппаратов. Число теоретических ступеней изменения концентрации и высота эквивалентная теоретической ступени. Графический метод расчета числа теоретических тарелок.    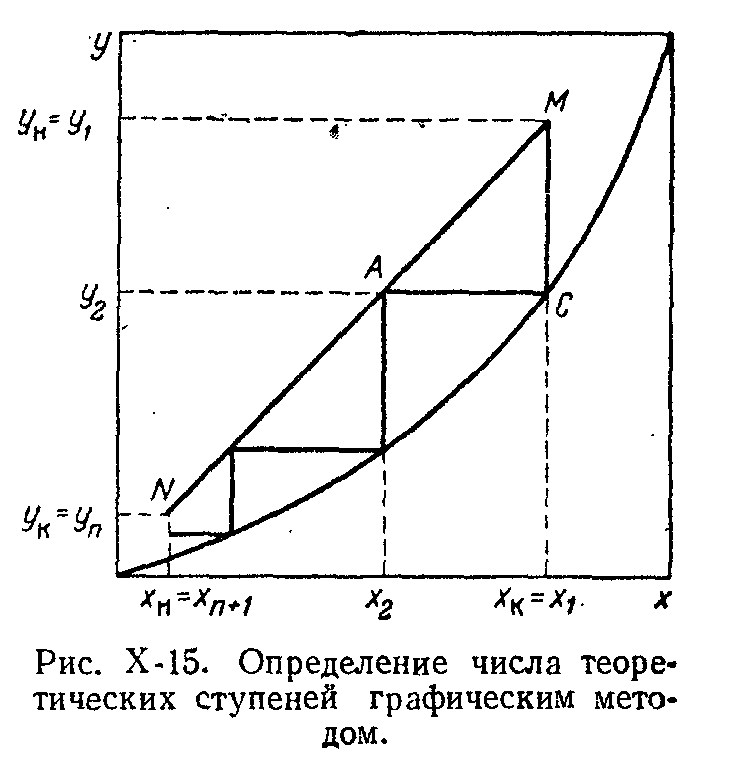   46. Абсорбция. Физико-химические основы абсорбции. Закон Генри и закон Дальтона, и их применение в расчетах абсорбционных процессов. Константа Генри, коэффициент распределения, их зависимость от температуры и давления. Абсорбция — процесс избирательного поглощения компонентов газовой смеси жидким поглотителем (абсорбентом). Процесс абсорбции происходит в том случае, когда парциальное давление извлекаемого компонента в газовой смеси выше, чем в жидком абсорбенте, вступающем в контакт с этим газом, т.е. для протекания абсорбции необходимо, чтобы газ и абсорбент не находились в состоянии равновесия. Различие в парциальном давлении извлекаемого компонента в газе и жидкости является той движущей силой, под действием которой происходит поглощение (абсорбция) данного компонента жидкой фазой из газовой фазы. Чем больше эта движущая сила, тем интенсивнее переходит этот компонент из газовой фазы в жидкую. По своей природе различают два вида абсорбции: физическую, при которой извлечение компонентов из газа происходит благодаря их растворимости в абсорбентах и химическую(хемосорбцию), основанную на химическом взаимодействии извлекаемых компонентов с активной частью абсорбента. Скорость физической абсорбции определяется диффузионными процессами, скорость хемосорбции зависит от скорости диффузии и химической реакции. Поглощение компонентов газовой смеси при абсорбции сопровождается выделением тепла, величина которого пропорциональна массе и теплоте растворения qAпоглощенных компонентов. Процесс абсорбции обратимый, поэтому он используется не только для получения растворов газов в жидкостях, но и для разделения газовых смесей. Обратный процесс – выделение из абсорбента растворенных в нём газов носит название – десорбции. При выборе абсорбента учитывают состав разделяемого газа, давление и температуру процесса, производительность установки. Выбор абсорбента определяется также его селективностью, поглотительной способностью, коррозионной активностью, стоимостью, токсичностью и другими факторами. В нефтяной и газовой промышленности процесс абсорбции применяется для разделения, осушки и очистки углеводородных газов. Из природных и попутных нефтяных газов путем абсорбции извлекают этан, пропан, бутан и компоненты бензина. В качестве абсорбентов при разделении углеводородных газов используют бензиновые или керосиновые фракции, а в последние годы и газовый конденсат, при осушке — диэтиленгликоль. Поскольку процесс абсорбции осуществляется в двухфазной (газ — жидкость) и трехкомпонентной (один распределяемый и два распределяющих компонента) системе, число степеней свободы — три. Таким образом, равновесие в системе газ (пар) — жидкость может характеризоваться тремя параметрами, например температурой, давлением и составом одной из фаз. Равновесие в системе газ — жидкость определяетсязаконом ра створимости Генри, согласно которому при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором: х=р/Е, (1) где р — парциальное давление газа над раствором, Па; х — мольная концентрация газа в растворе, моль/м3; Е — коэффициент пропорциональ ности (константа Генри). Закон Генри распространяется в первую очередь на слабора створимые газы, а также на растворы с низкими концентрациями хорошо растворимых газов при отсутствии химической реакции. При повышенных давлениях (порядка десятков атмосфер и выше) рав новесие между газом и жидкостью не следует закону Генри, так как изме нение объема жидкости вследствие растворения в ней газа становится соизмеримым с изменением объема данного газа. Коэффициент Е имеет размерность давления, совпадающую с размерностьюр, и зависит от природы растворяющегося веще ства и температуры. Установлено, что с увеличением температуры растворимость газа в жидкости уменьшается. Когда в равновесии с жидкостью находится смесь газов, закону Генри может следовать каждый из компонентов смеси в отдельности. Зависимость Е от температуры выражается уравнением  (2) (2)гдеq— дифференциальная теплота растворения газа; R— газовая постоянная; С — постоянная, зависящая от природы газа и поглотителя. Для идеальных растворов на диаграмме р — х (рисунок 1) зависимость равновесных концентраций от давления изображается пря мой, имеющей наклон, равный Е — коэффициенту Генри. Из рисунка 1 следует, что с повышением температуры (при прочих равных условиях) увеличивается значение Е и соответственно умень шается растворимость газа в жидкости.. 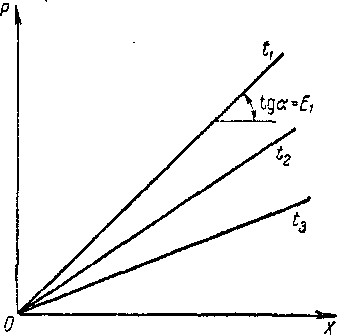 Рисунок 1 Парциальное давление растворяемого газа в газовой фазе, со ответствующее равновесию, может быть определено по закону Дальтона, согласно которому парциальное давление компонента в газовой смеси равно общему давлению, умноженному на моль ную долю этого компонента в смеси, т.е. р = Р·у или у = р/Р, (3) гдеР — общее давление газовой смеси; у — мольная концентра ция распределяемого в смеси газа. Сопоставляя уравнения (1) и (3), найдем у = Е·х/Р = Н·х (4) Н = Е/Р — коэффициент распределения (константа фазового равновесия), применяемый для областей действия законов Генри и Дальтона. Уравнение (4) показывает, что зависимость между концентрацией данного компонента в газовой смеси и в равновесной с ней жидкости выражается прямой линией, проходящей через начало координат и имеющей угол наклона, тангенс которого равен m. 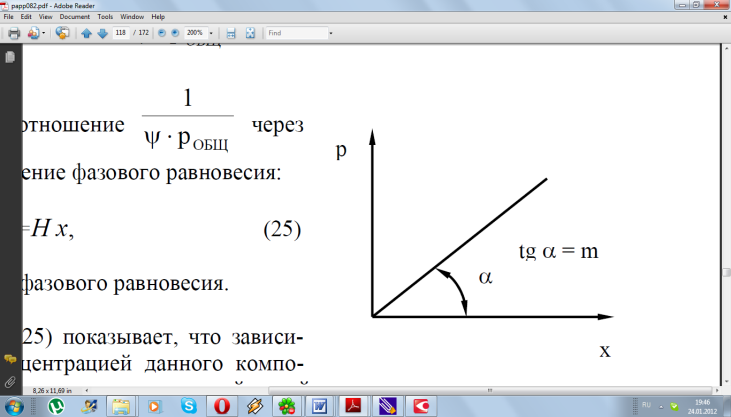 Рисунок 2. Численные значения m зависят от температуры и давления: уменьшаются с увеличением давления и понижением температуры. Таким образом, растворимость газа в жидкости увеличивается с повышением давления и снижением температуры. Анализ факторов, влияющих на равновесие в системах газ (пар) — жидкость, позволил установить, что к параметрам, улучшающим условия абсорбции, относятся повышенное давление и пониженная температура, а к факторам, способствующим десорбции, — пониженное давление, повышенная температура и введение в абсорбент добавок, уменьшающих растворимость газов в жидкостях. 47. Жидкостная экстракция, физико-химические основы, схемы жидкостной экстракции. Экстракторы с подводом механической энергии к поверхности контакта фаз: роторно-дисковые, пульсационные и вибрационные экстракторы. Смесительно-отстойные экстракторы. Жидкостная экстракция- процесс избирательного извлечения компонентов жидкой фазы при помощи жидкого р-рителя(очистка масла, диз топлива и тд). Подбирают такой р-ритель, чтобы в нем хорошо р-рялись извлекаемые и мало р-рялись остальные. Р-р должен иметь 2 осн свойства избирательность и селективность. При смещение раств с сырьем происх процесс перераспределения компонентов между ними. Чтобы извлечь нужный компонент необх получ гетерогенную систему, которая состояла бы из 2 жид фаз. При этом образуются 2 р-ра: экстрактый – содержит извлекаемые компоненты, рафинат – не извлекаемые комп. Эти 2 р-ра образуют расслаивающуюся сист, которую можно разделить при помощи отстаивания под действ грав и центроб силы. Любой процесс экст проходит в 2 этапа: смещения и разделения. В зависимости от числа ступеней экстракции и способа их соединения различают следующие разновидности процесса экстракции: однократную, многократную и противоточную. 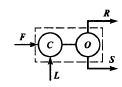 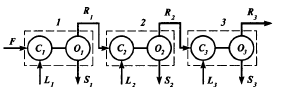 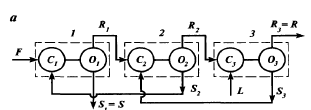 F-сырье, I-р-ритель, С- смесителе, о-отстойник, R - рафинатный и S экстрактный р-ры. В промышленности применяется большое число различных конструкций экстракционных аппаратов; их можно подразделить на две основные группы: I. По способу смешения фаз экстракторы делятся на подгруппы:1) аппараты ступенчатого типа, имеющие определенное число ступеней (типа смеситель-отстойник), в каждой из которых происходит контактирование и последующее разделение фаз. 2) аппараты колонного типа с непрерывно изменяющимся составом фаз. II. По способу разделения фаз экстракторы делятся на подгруппы:1) аппараты отстойного типа;2) центробежные аппараты. Далее рассмотрим аппараты типа смеситель-отстойник. Для смешения контактирующихфаз применяют смесители различных типов, в том числе пропеллерные насосы, которые одновременно с перемешиванием обеспечивают транспортирование взаимодействующих легкой и тяжелой фаз. Из контактной зоны образовавшаяся смесь выводится в отстойную зону, где происходит разделение легкой и тяжелой фаз, поступающих затем в соответствующие ступени аппарата. Р-р легкой фазы из смежной ступени экстракции по трубопроводу 1, а р-р тяжелой фазы по трубопроводу 4 поступают на прием пропеллерного насоса 5. Сюда же по трубопроводу 10 и кольцевому каналу 3 поступает эмульсия из верхнего и нижнего слоя отстойного пространства. Уровень установки трубы 10 и канала 3 определяет долю рециркулирующей легкой и тяжелой фазы. Пройдя камеру смешения 7, смесь легкой и тяжелой фаз попадает в кольцевую камеру 9, а оттуда в отстойное пространство 11. Тяжелая фаза из низа отстойника выводится по трубе 12 в следующую ступень экстрактора. Легкая фаза выводится из верхней части отстойной зоны через коллектор 6. 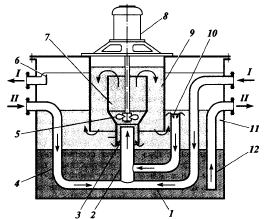 Эффективность насадочных и тарельчатых колонн во многих случаях может быть повышена за счет применения пульсирующих потоков. Существует два способа введения низкочастотных колебаний в массообменные аппараты: первый основан на создании возвратно-поступательного движения контактирующих фаз, такие аппараты называются пульсационными; второй предусматривает низкочастотные колебания контактных устройств внутри аппаратов, которые называются вибрационными. Пульсационный экстрактор оснащен жестко закрепленными в корпусе контактными устройствами 1 в виде чередующихся по высоте шайб и дисков и пульсационной трубой 4 для передачи пульсационных импульсов от автономного генератора колебаний, называемого пульсатором 5. В качестве рабочего тела при создании пульсационных колебаний обычно используют газ (воздух). В вибрационном экстрактора горизонтальные перфорированные пластины 5 жестко связаны системой стержней 4 со штангой 2 и при работе совершают идентичные по частоте и амплитуде (синхронные) колебания. Для более равномерного перемешивания контактирующих фаз между пакетами перфорированных пластин расположены отбойные перегородки б. К достоинствам вибрационных аппаратов следует отнести низкие удельные капитальные вложения и эксплуатационные затраты. Они просты по конструкции, обладают малой металлоемкостью, имеют простейший привод, обладают большой производительностью при высокой эффективности массообмена. 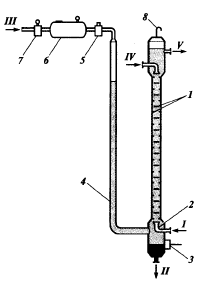 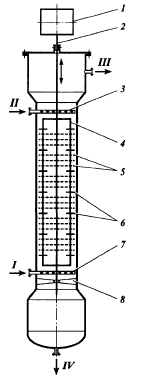  Вибрационный экстрактор: 1 — вариатор частоты колебаний; 2 — штанга; 3, 7 - распределители; 4 - стержень; 5 —перфорированные пластины; 6 - отбойные перегородки, 8 — нижняя опора штанги.Потоки: сырье: I — легкая фаза; IV — тяжелая фаза; продукты разделения: II — тяжелый;III — легкий 48. Дистилляционные процессы. Физико-химические основы. Закон Рауля. Уравнение равновесной линии, относительная летучесть. Изображение процессов дистилляции на у-х и t-x-y диаграммах. Дистилляция (distillatio — стекание каплями) — перегонка, разделение жид смесей на отличающиеся по составу фракции. Основана на различии в составах жидкости и образования из нее паров. Дистилляция обычно осуществляется путем частичного испарения и последующей конденсации пара. Отогнанная фр (дистиллят Д) обогащена относительно более летучими (низкокипящими) компонентами, а не отогнанная жидкость (кубовый остаток) менее летучими (высококипящими). Если из исходной отгоняется не одна фракция, а несколько , то такой дистиллят называется фракционной или дробной. В зависимости от условий процесса, дистилляция бывает молекулярной и простой. Простая дистилляция — проводиться при таких р, когда длина свободного пробега молекул намного меньше, чем расстояние между поверхностями испаряющийся Ж и конденсацией пара. t такого процесса опр-ся условиями фазового равновесия между Ж и паром. Если необходимо понизить t, то применяют Д под вакуумом, с вод паром или инерт газами. Аппараты, кот исп-ся при простой Д дел-ся на емкостные и пленочные. В емкостных аппаратах нах-ся большой объем Ж и происходит интенс перемещивание в результате кипения. Молекулярная Д – основана на зависимости скорости испарения в-ва от его молекулярной m при t ниже t кипения Ж и низких р. При этом длина своб пробега молекул уже соизмерима с расстояниями между поверх конденсации пара и испар Ж. При этом молекулы соударяются от-но редко и двигаются незав друг от друга. Расход и состав паровой фазы оп-ря скоростями испарения отд компонентов. Но не один из процессов не дают возможность получить продукт с опр концентрации. Для получ продукт с опр концентрацией и высоким выходом ис-ся процесс ректификации Закон Рауля связывает давление насыщенного пара над р-ром с его составом; он формулируется следующим образом: Парциальное давление i-ого компонента в идеальном р-ре равен произв парц р насыщенных паров, при данной t, на мольную концентрацию компонента в жид фазе. рi=Pixi, Р нас паров каждого комп вычисляетсч по формуле Антуана tgP=A-B/(C+t). А,В,С опр-ся экспериментально. Ж начинае кипеть при t, при кото рой р ее насыщ паров =р внешн среды. π=∑рi=рнккх`+рвкк(1-х`). получаем уравнение для построения нижней изобары х`=(π- рвкк)/ (рнкк-рвкк). По з-ну Дальтона, парц р компонента газ смеси = произв р в системе на мольную долю компонента в газ смеси. При р=const,з-н Рауля-Дальтона: рi=Pixi= πуi, получаем уравнение верхней изобары у`=(рнкк х`)/ π. Уравнение равновесия фаз: для НКК - у`=(рнкк х)/ π, ВКК – (1-у`)=(р2 (1-х`))/ π. если разделить, р1/р2=α-получим коэффициент летучести. Уравнение равновесия фаз бинарной смеси и устанавливает зависимость между равновесными концентрациями в жидкой и паровой фазах.у`/(1- у`)=α(x`/(1-x`)). уравнение представляет собой гиперболу, изгиб которой зависит от α. 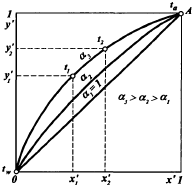 на х-у диаграмме построена кривая равновесия жидкой и паровой фазы при внешнем давление π при ta-w. полученные при разных температур t равновесные составы жидкой x` и паровой y` фаз при давление π могут быть представлены в системе координат t-x,y. по оси абсцисс отложениы концентрации x` и y`, отвечающие разным температурам t. 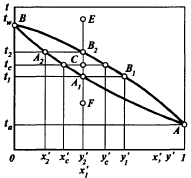 |
