Медицинская микробиология и вирусология ч1 (1). Т. П. Гажеева, Т. Х. Гордеева, Е. И. Хорошавина Медицинская микробиология и вирусология Часть 1
 Скачать 5.4 Mb. Скачать 5.4 Mb.
|
ЗАНЯТИЕ 11,12. Генетика микроорганизмов. Молекулярно-генетические методы, их практическое использование.Цель занятия: Изучить механизмы мутаций и рекомбинаций у прокариот. Материалы и оборудование: Суточные культуры ауксотрофных штаммов Escherichiacoli, Bacillussubtilis. Чашки Петри с МПА, раствор ДНК прототрофного штамма, стерильные пробирки, пипетки на 1 мл.,0.1 мл., физиологический раствор. План занятия Генетический аппарат бактериальной клетки. Репликация ДНК. Генотип и фенотип. Изменчивость микроорганизмов и ее виды. Модификации. Мутации. Механизм мутаций. Мутагенные факторы. Рекомбинации – обмен генетической информацией. Механизмы рекомбинации у прокариот. Трансформация. Открытие явления трансформации. Механизм и стадии процесса трансформации. Трансдукция. Типы трансдукций. Роль умеренного бактериофага. Фаговая конверсия. Коньюгация. Значение F, Hfr, F1 факторов. Механизм образования , Hfr клеток. Плазмиды. Виды плазмид. Использование в генной инженерии. Транспозоны. Генетические методы диагностики инфекционных заболеваний. Задание: Изучить механизм образования фагорезистентных форм в культуре кишечной палочки по данным флуктуационного опыта С. Луриа и М. Дельбрюка. Провести опыт по трансформации бактерий: а) сделать смыв культуры сенной палочки (ауксотрофный штамм, нуждающийся в треонине) и разделить по 0.5 мл в две стерильные пробирки; б) в первую пробирку добавить 0.5 мл раствора ДНК прототрофного штамма, во вторую – 0.5 мл физиологического раствора, поставить в термостат на 30 минут; в) произвести высев (по 0.1 мл) на чашки с минимальной средой; г) по демонстрационным посевам учесть рост микроорганизмов, записать результат. Ауксотрофные штаммы микроорганизмов, в отличие от прототрофных, требуют наличия определенных питательных веществ в среде, поскольку сами их синтезировать не могут. На минимальной питательной среде они не растут. На питательной среде, где сделан посев сенной палочки или ДНК, роста колоний не будет. В третьем секторе, если произошла трансформация и бактерии получили фрагмент ДНК с информацией о ферменте триптофансинтетазе, произойдет рост микроорганизмов. Провести опыт коньюгации: а) сделать смыв культур кишечной палочки тимин-зависимого штамма (Hfr клетки) и штамма кишечной палочки (F клетки), нуждающегося в треонине и лейцине; б) по 0.5 мл суспензии каждого штамма смешать в отдельной пробирке и поставить в термостат на 30 минут; в) произвести высев суспензии на чашку с минимальной средой; г) по демонстрационным посевам учесть и записать результаты опыта. Посев исходных штаммов микроорганизмов на минимальную питательную среду роста не дает, так как не хватает питательных веществ (ауксотрофные штаммы). Методические рекомендации к практическому занятию. Теоретические основы. Генетические методы диагностики инфекционных заболеваний Молекулярно-генетический метод позволяет осуществить раннюю и более полную диагностику различных заболеваний, своевременно проводить дифференциальную диагностику и осуществлять контроль эффективности терапии. В настоящее время имеется два направления генетической диагностики: 1 – гибридизационный анализ нуклеиновых кислот; 2 – диагностика с использованием амплификации (полимеразная цепная реакция). Гибридизационный анализ нуклеиновых кислот (НК) основывается на способности НК специфически соединяться (гибридизироваться) с комплементарными фрагментами гомологичных ДНК или РНК искусственно созданных нитей, меченных изотопами или ферментами (пероксидаза, щелочная фосфатаза). Полимеразная цепная реакция (ПЦР). ПЦР – метод, позволяющий провести многократное образование (амплификацию) копий определенных молекул ДНК в анализируемом образце (в том числе в биологическом материале или чистой культуре). Главные преимущества ПЦР как диагностического метода в микробиологии – очень высокая чувствительность, позволяющая обнаружение крайне малых концентраций возбудителей в образцах, а также регулируемая специфичность, позволяющая обнаруживать или идентифицировать возбудителей на родовом, видовом или субвидовом уровне. Основной недостаток ПЦР вытекает из его крайне высокой чувствительности – образцы очень легко загрязнить ДНК из положительного контроля, другого образца или продукта ПЦР, что приведет к ложноположительной реакции. Это накладывает жесткие ограничения на условия, в которых производится смешивание ПЦР и работа с готовыми продуктами ПЦР. Проведение исследования ПЦР требует дорогостоящего оборудования, высокой квалификации персонала. Техника ПЦР На начальном этапе готовится реакционная смесь, содержащая следующие компоненты: выделенную ДНК из исследуемого образца, буферный раствор, ионы Mg2+ (необходимы для работы фермента), два праймера – одноцепочечныекороткие молекулы ДНК (длина чаще всегоот 18 до 24 нуклеотидов), комплементарные концам разных цепей обнаруживаемой последовательности ДНК, смесь дезоксинуклеотидтрифосфатов, термостойкую ДНК-полимеразу (чаще всего используется Taq-полимераза – полимераза, выделенная из Thermus aquaticus ).Затем данная реакционная смесь помещается в амплификатор, который фактически представляет собой программируемый термостат. В амплификаторе проводится 30-40 циклов смены температур. Каждый из этих циклов состоит из трех этапов: Денатурация ДНК; Отжиг ДНК-затравок с матрицей; Синтез ДНК с помощью ДНК-полимеразы с каждой из затравок навстречу друг другу с использованием противоположных цепей ДНК в качестве матриц. 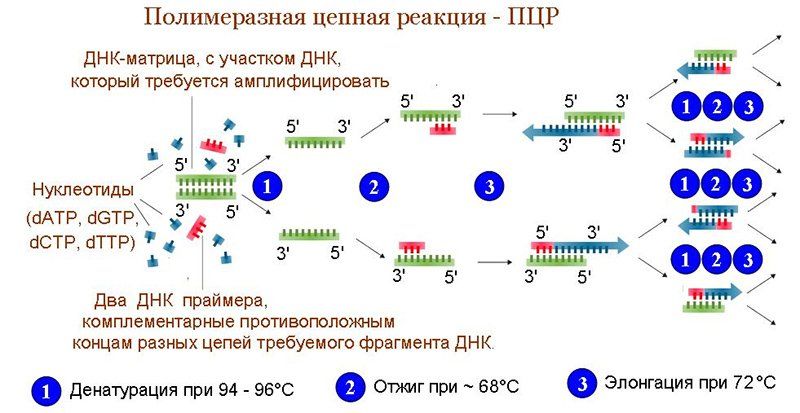 ppt-online.org |
