УЧЕБНИК Онкология. Ш. X. Ганцев 2006. Учебник для студентов медицинских вузов. 2е изд., испр и доп. М. Ооо Медицинское информационное агентство
 Скачать 4.2 Mb. Скачать 4.2 Mb.
|
|
Глава 6. Принципы лечения злокачественных образований Таблица 6.1 Физические величины (единицы измерения) (по А. Л. Дудареву)_
В зависимости от радиочувствительности опухолей суммарная очаговая доза колеблется в широких пределах — от 30 до 100-120 Гр. Для уничтожения клеток плоскоклеточного рака и аденокарциномы требуется суммарная доза 65-75 Гр, для сарком костей и мягких тканей — до 80 Гр. При выборе дозы учитывают не только гистологическое строение опухоли, скорость и формы ее роста. Быстро растущие злокачественные опухоли и экзофитные формы роста более радиочувствительны, чем медленно растущие злокачественные опухоли и эндофитные, инфильтрирующие формы рака. Эффективность биологического действия различных ионизирующих излучений неодинакова. За стандарт принимают действие рентгеновского излучения с энергией 200 кэВ и со средней линейной потерей энергии 3 кэВ/мм; относительная биологическая эффективность такого излучения принимается за единицу. Биологическое действие излучения определяется не только величиной суммарной дозы, но и временем, в течение которого она поглощается. Путем подбора оптимального соотношения доза/время можно добиться максимального эффекта. Данный принцип реализуют путем дробления суммарной дозы на отдельные фракции — разовые дозы. При дробном фракционном облучении клетки опухоли облучаются в разных фазах размножения. При этом используется способность здоровых тканей более полно восстанавливать свою структуру и подведенное за курс лечения. Доза, при подведении которой происходит полное уничтожение опухоли, называется канцерицидной. Часть I. Общая онкология функции, чем это происходит в опухоли, а также функцию резорбции погибшей опухоли и ликвидации образовавшегося дефекта за счет репарации. Методы лучевой терапии по способу распределения дозы во времени Наибольшее распространение получил режим классического фракционирования. Опухоль облучают в дозе 1,8-2 Гр 5 раз в неделю до суммарной очаговой дозы в течение 1,5 месяцев. Режим применим для опухолей, обладающих высокой и умеренной радиочувствительностью. Нетрадиционные режимы фракционирования дозы представляют собой один из самых привлекательных способов радиомодификации. При адекватно подобранном варианте фракционирования дозы удается добиться существенного повышения повреждений опухоли с одновременной защитой окружающих здоровых тканей. При крупном фракционировании ежедневную дозу увеличивают до 4-5 Гр, а облучение выполняют 3-5 раз в неделю. Такой режим предпочтительнее для радиорезистентных опухолей, однако при этом чаще наблюдаются лучевые осложнения. С целью повышения эффективности лечения быстро пролиферирующих опухолей применяют мулътифракционирование: облучение в дозе 2 Гр проводят 2 раза в день с интервалом не менее 4-5 ч. Суммарная доза уменьшается на 10-15 %. Гипоксические опухолевые клетки не успевают восстановиться после сублетальных повреждений. При медленно растущих новообразованиях используют режим гиперфракционирования, то есть увеличения количества фракций — ежедневную дозу облучения 2,4 Гр разбивают на 2 фракции по 1,2 Гр. Несмотря на увеличение суммарной дозы на 15-20 %, лучевые реакции не выражены. Динамическое фракционирование — режим дробления дозы, при котором проведение укрупненных фракций чередуется с классическим фракционированием. Усиление радиопоражаемости опухоли достигается за счет увеличения суммарных очаговых доз без усиления лучевых реакций нормальных тканей. Особым вариантом является так называемый расщепленный курс облучения, или «сплит»-курс. После подведения суммарной очаговой дозы (около 30 Гр) делают перерыв на 2-3 недели. За это время клетки здоровых тканей восстанавливаются лучше, чем опухолевые. Кроме того, в связи с уменьшением размеров опухоли, оксигенация ее клеток повышается. Следующим методом лучевой терапии по способу распределения дозы во времени является непрерывный режим облучения в течение нескольких дней. Примером этого метода является внутритканевая лучевая терапия, когда в опухоль имплантируют радиоактивные источники. Достоинством такого режима является воздействие излучения на все стадии клеточного цикла, наибольшее количество раковых клеток подвергается облучению в фазе митоза, когда они наиболее радиочувствительны. Одномоментная лучевая терапия — суммарная очаговая доза подводится за один сеанс облучения. Примером является методика интраоперационного облучения, когда суммарная однократная доза на ложе опухоли и зоны регионарного метастазирования составляет 15-20 Гр. Глава 6. Принципы лечения злокачественных образований Основные принципы лучевой терапии злокачественных опухолей: 1. Подведение оптимальной дозы к опухоли для ее разрушения при минимальном повреждении окружающих опухоль здоровых тканей. 2. Своевременное применение лучевой терапии в наиболее ранних стадиях злокачественного процесса. 3. Одновременное лучевое воздействие на первичную опухоль и пути регионарного метастазирования. 4. Первый курс лучевой терапии должен быть, по возможности, радикальным и единовременным. 5. Комплексность лечения больного, то есть использование наряду с лучевой терапией средств, направленных на улучшение результатов лечения, а также на предотвращение лучевых осложнений. Показание для проведения лучевой терапии — точно установленный клинический диагноз с морфологическим подтверждением. Исключение составляет только ургентная клиническая ситуация: поражение средостения с синдромом сдавления верхней полой вены либо трахеи, лучевая терапия проводится по жизненным показаниям. Лучевая терапия противопоказана при очень тяжелом состоянии больного, кахексии, анемии и лейкопении, не поддающихся коррекции, острых септических состояниях, декомпенсированных поражениях сердечно-сосудистой системы, печени, почек, при активном туберкулезе легких, распаде опухоли (угроза кровотечения), распространении опухоли на соседние полые органы и прорастании опухолью крупных сосудов. Одним из условий успеха лучевой терапии является тщательно составленный индивидуальный план облучения, включающий определение объема облучения, локализации опухоли, уровней поглощенных доз в зоне опухоли и регионарного метастазирования. Планирование лучевой терапии включает клиническую топо-метрию, дозиметрию и последующий контроль за воспроизведением намеченного плана лечения от сеанса к сеансу. Лучевая терапия сопровождается реакциями и осложнениями. Степень выраженности лучевых реакций зависит от разовых и суммарных доз, объема облучения, времени подведения суммарной очаговой дозы и индивидуальных особенностей организма. В течение всего курса лучевой терапии проводится тщательное наблюдение за состоянием больного, скоростью и степенью регрессии опухоли, профилактика развития общих и местных реакций и осложнений. Целевые функции лучевой терапии При использовании лучевой терапии как самостоятельного метода в зависимости от конкретной ситуации, которая определяется особенностями злокачественного новообразования и общим состоянием больного, различают/>аЭ1/-калъное, паллиативное и симптоматическое лечение. Целью радикальной лучевой терапии является полное уничтожение опухолевых элементов в зоне первичного роста и зонах регионарного метастазирования с минимально возможным повреждением нормальных тканей, что в Часть I. Общая онкология конечном счете должно привести к излечению больного с хорошей социальной и трудовой реабилитацией. Радиоонколог должен добиваться максимально возможного подведения радикальных канцерицидных доз к очагу опухолевого роста, которые составляют 60-80 Гр, а в зоны вероятного субклинического распространения — 40-50 Гр. С радикальными целями используют наружное облучение, а чаще — соче-танное, при котором наружное облучение дополняют внутриполостной или внутритканевой методы лучевой терапии. Паллиативная лучевая терапия направлена на остановку роста опухоли, в результате чего удается добиться улучшения общего состояния, улучшения качества жизни, продления жизни больного за счет уменьшения интоксикации и болевого синдрома. При паллиативной лучевой терапии подводимые дозы составляют 40-50 Гр. Однако эти дозы не носят обязательного характера, и величина паллиативной дозы определяется общим состоянием больного, реакцией опухоли на повреждающее действие ионизирующего излучения. В процессе лечения возможны изменения дозы в сторону ее увеличения или уменьшения. Симптоматическая лучевая терапия преследует цель снять тяжесть клинических симптомов, обусловленных распространением первичной или метастатической опухоли (уменьшение болевого синдрома, устранение компрессионного синдрома, остановка кровотечения). Дозы при симптоматической лучевой терапии составляют 20-30 Гр. При генерализации злокачественных опухолей применение паллиативной и симптоматической лучевой терапии в комплексе с другими противоопухолевыми воздействиями не только повышает качество жизни пациентов, но и может продлить жизнь на месяцы и годы, например, при метастазах рака молочной железы в кости. Методы лучевой терапии по способу подведения доз к опухоли (по И. А. Переслегину) I. Дистанционные методы лучевой терапии. Дистанционная лучевая терапия (рентгенотерапия, гамма-терапия, терапия тормозным излучением высокой энергии, терапия быстрыми электронами, терапия протонным излучением и нейтронным излучением). а) статическая: открытыми полями, через свинцовую решетку, через свинцовый клиновидный фильтр, через свинцовые экранирующие блоки; б) подвижная: ротационная, маятниковая (секторная), тангенциальная или эксцентричная, ротационно-конвергентная, ротационная с управляемой скоростью. II. Контактные методы лучевой терапии: а) внутриполостной; б) внутритканевой; в) радиохирургический; г) аппликационный; д) близкофокусная рентгенотерапия; е) метод избирательного накопления изотопов в тканях. Глава 6. Принципы лечения злокачественных образований III. Сочетанные методы лучевой терапии — сочетание одного из способов дистанционного и контактного облучения. IV. Комбинированные методы лечения злокачественных опухолей: а) лучевая терапия и хирургическое лечение; б) лучевая терапия и химиотерапия, гормонотерапия,. Источники излучения, обеспечивающие проведение того или иного метода лучевой терапии, отражены в рис. 6.1. Дистанционное облучение Излучение Гамма-излучение б0Со, 137Cs Рентгеновское 100-250 кэВ Тормозное 6-45 МэВ Электроны 6-20 МэВ Протоны 70-100 МэВ Нейтроны 6-15 Мэв 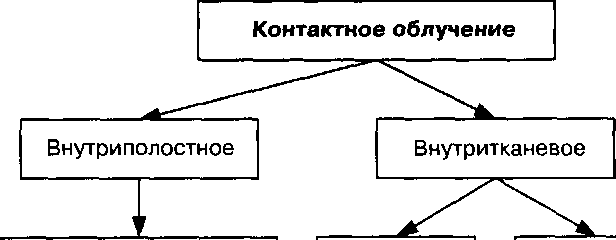 Излучение Рентгеновское 100 кэВ Гамма-излучение 60Со, 137CS, т Гамма-излучение + нейтроны 252Cf Закрытые источники 60Co,137Cs, 192lr,252Cf, Открытые источники °Au, "Р, 132| 125-1 Рис. 6.1. Методы лучевой терапии и источники излучения (по Е. С. Киселевой) I. Дистанционные методы лучевой терапии Дистанционными методами называются способы лучевого воздействия, при которых источник излучения находится на расстоянии от поверхности тела больного. Пучок излучения входит в тело человека всегда через определенный участок поверхности тела, который называется полем облучения. Дистанционная рентгенотерапия при генерировании напряжения в 200-250 кэВ находит в настоящее время ограниченное применение в связи с низкой энергией квантов и меньшей проникающей способностью. Однако она применяется по строгим показаниям при некоторых локализациях опухолевого процесса. Источниками такого излучения являются рентгенотерапевтические аппараты (РУМ). Дистанционная гамма-терапия — наиболее распространенный метод дистанционного облучения. Она проводится с помощью гамма-аппаратов серии «АГАТ», «РОКУС» (рис. 6.2, см. вклейку). Гамма-аппарат состоит из следующих основных частей: радиационной головки, штатива, стола для укладки больного и пульта управления. В радиационной головке размещается источник излучения 60Со высокой активности. При дистанционном облучении используются терапия тормозным излучением высокой энергии и быстрые электроны. Источниками излучения являются линейные ускорители, которые генерируют пучки фотонов или электронов Часть I. Общая онкология высокой энергии. Лечение пучками высокой энергии имеет ряд преимуществ: к опухоли удается подвести большую дозу энергии, предохранив от нежелательного облучения здоровые ткани, уменьшается интегральная доза (общее количество энергии, поглощенной в облучаемом объеме) в организме больного. Преимуществом применения высоких энергий является уменьшение интегральной дозы в организме больного. Из других видов корпускулярного излучения (излучения, состоящие из частиц) используют нейтроны и протоны. В связи с особенностью протонного пучка, отдающего энергию коротким импульсом в пределах «пика Брегга» (максимум дозы в конце пробега), его применяют для прицельного облучения небольших, глубоко расположенных опухолей (гипофиз, сетчатка). Нейтроны обеспечивают большую плотность ионизации. При этом нивелируется кислородный эффект, в связи с чем нейтроны применяют при лечении радиорезистентных опухолей или рецидивов. Все дистанционные методы лучевой терапии могут проводиться статическим и подвижным способами. При статическом облучении источник и больной неподвижны. При подвижных способах облучения источник, как правило, автоматически перемещается относительно больного (рис. 6.3, см. вклейку). При статическом способе дистанционной лучевой терапии злокачественная опухоль облучается через одно или несколько полей, расположенных на поверхности тела пациента. Дистанционное облучение с одного кожного поля называется однопольным облучением. Оно применяется редко, так как не представляется возможным подведение необходимой опухолевой дозы без повреждения кожи. Известно, что основным принципом лучевой терапии является поражение опухоли с наименьшим повреждением окружающих тканей. Поэтому лучевые терапевты всегда стремятся к созданию наибольшей разницы в дозах, получаемых опухолью и нормальными тканями, окружающими ее. С этой целью применяются прежде всего методики многопольного перекрестного облучения открытыми полями, с применением свинцовых экранирующих блоков, клиновидных фильтров, решеток. Следствием совершенствования многопольного облучения явилось создание подвижных методик лечения. Они могут проводиться путем ротационного, ротационного с переменной скоростью, ротационно-конвергентного, маятникового и тангенциального облучения. Эти методики применяются с целью максимального поглощения излучения в патологическом очаге с одновременным резким падением дозы в окружающих опухоль здоровых тканях и коже. Однако основным недостатком подвижных методик является облучение гораздо больших объемов здоровых тканей, чем при статическом облучении. Следовательно, именно интегральная доза при подвижных методах выше, чем при статическом способе. При ротационном (круговом) облучении источник совершает движение вокруг больного с постоянной скоростью. Оптимальное распределение доз можно получить путем применения ротационного облучения с переменной скоростью движения источника. При конвергентном облучении источник совершает спиралевидные движения по отношению к опухоли. | ||||||||||||||||||||||||||||||||||||||||||||
