ТОЗОС часть2. Учебнометодические разработки для самостоятельной работы студентов по курсу
 Скачать 7.02 Mb. Скачать 7.02 Mb.
|
|
Глава 3. Физические основы электродных процессов при очистке сточных вод от примеси 3.1. Явления электролиза, поляризации и перенапряжения 3.1.1 Электролиз Пропускание тока через раствор электролита сопровождается химическими процессами на электродах, называемыми электролизом. Явления электролиза обратны процессам, происходящим в замкнутом элементе, где, наоборот, электрический ток возникает за счет химических реакций. В электролитической ячейке будем называть катодом электрод, соединенный с отрицательным электродом источника тока, а анодом тот электрод, который соединен с положительным электродом источника. Соединим гальванический элемент, например элемент Даниеля, с внешним источником тока так, чтобы его отрицательный цинковый электрод был соединен с отрицательным электродом источника тока, т.е. был бы катодом, а положительный медный - с положительным электродом источника так, чтобы он был анодом. Тогда, если приложенная электродвижущая сила достаточна, через элемент будет проходить ток в направлении, обратном направлению его собственного тока, и на электродах будут происходить процессы, обратные процессам, идущим в замкнутом элементе. На цинковом катоде будет идти осаждение цинка, а на медном аноде - растворение меди Zn+++2ē→Zn и Cu→Cu+++2ē. Обобщая это, можно установить, что при электролизе на катоде идут процессы восстановления, а на аноде идут процессы окисления. Для того чтобы через элемент Даниеля проходил обратный ток, достаточно, чтобы приложенная внешняя электродвижущая сила E была немного больше собственной электродвижущей силы Ep самого элемента. Тогда между электродами установится разность потенциалов E – Ep,позволяющая преодолеть омическое сопротивление w элемента, и возникает ток, сила i которого определяется законом Ома: E – Ep = i w. (1) Сила тока растет с увеличением приложенной электродвижущей силы E. В тех случаях, когда оба электрода элемента имеют одинаковый потенциал, имеем Ep=0, и электролиз начинается при как угодно малой приложенной электродвижущей силе. Так будет идти, например, электролиз раствора CuSO4 между двумя медными электродами с выделением меди на катоде Cu2+ +2ē→Cu (восстановление). и растворением ее на аноде Cu→Cu2++2ē (окисление). Далеко не всегда явления электролиза точно повторяют в обратном направлении процессы, происходящие в работающем гальваническом элементе. Это возможно лишь тогда, когда обе электродные реакции и все остальные процессы, происходящие в элементе, термодинамически обратимы. В противном случае процессы при электролизе могут быть иными, чем в замкнутом элементе, и тогда величина Ep не равна электродвижущей силе элемента. Разные случаи и причины необратимости будут рассмотрены ниже. Необратимость увеличивается с повышением скорости электролиза, т.е. силы тока, проходящего через ячейку. Она поэтому особенно существенна в технических электрохимических процессах, где применяют токи большой силы и где, в частности, она вызывает увеличение расхода необходимой для электролиза энергии. 3.1.2. Кривая напряжения Соединим с внешним источником тока два платиновых электрода, опущенных в раствор серной кислоты, включив в цепь гальванометр. Приложим сначала небольшую электродвижущую силу, например 1 В. После короткого выброса стрелка гальванометра вернется почти к нулю, т.е. через цепь почти не будет проходить тока, и не будет наблюдаться электролиза. То же будет происходить при последовательном увеличении приложенной электродвижущей силы E до тех пор, пока она не превзойдет некоторую величину Ep (в данном примере 1,7 В), называемую электродвижущей силой разложения. При этой электродвижущей силе начинается разложение воды с выделением водорода на катоде и кислорода на аноде и появляется длительный ток, сила которого растет с увеличением приложенной электродвижущей силы E. Кривая силы тока в функции от электродвижущей силы называется кривой напряжения. В простых случаях, не осложненных побочными факторами, она имеет вид, показанный на рис. 3.1. 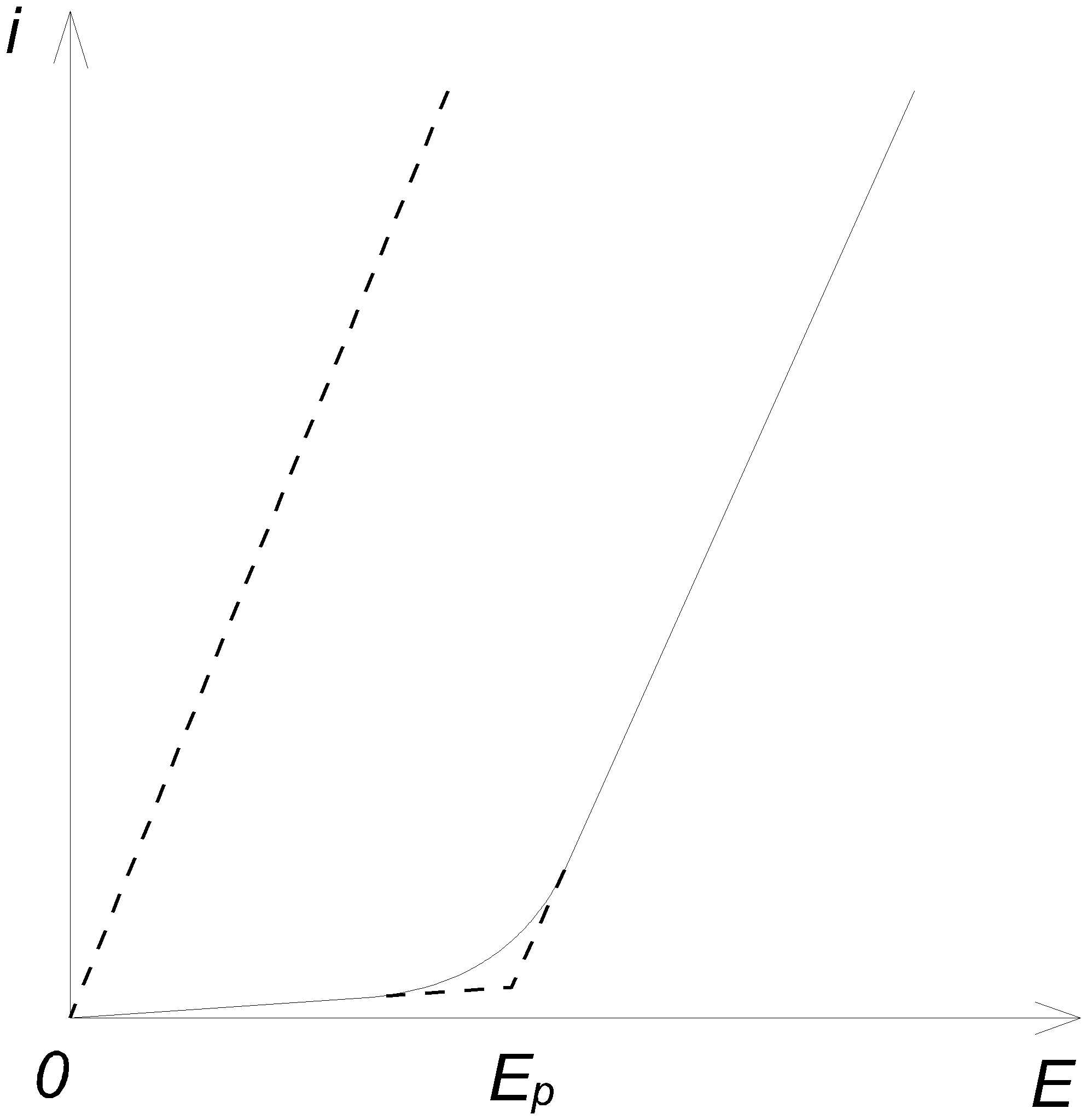 Рис.3.1 Кривая напряжения Электродвижущую силу разложения можно найти как из положения точки изгиба этой кривой, так и по началу электролиза (появление пузырьков газов на электродах). Однако оба способа не очень точны. Эти явления объясняются так. После включения внешней электродвижущей силы на электродах начинается выделение водорода и кислорода, что превращает катод в водородный электрод, а анод - в кислородный. При этом ячейка превращается в водородно-кислородный гальванический элемент, дающий собственную обратную электродвижущую силу, растущую по мере насыщения электродов газами до тех пор, пока она не станет равной приложенной электродвижущей силе E, после чего ток прекратится. Если увеличить E, то снова через короткое время наступит стационарное состояние с более высокой степенью насыщения электродов газами. Последнее не может однако расти безгранично. Когда достигнуто равновесие с внешним давлением, газы начинают покидать электроды в виде пузырьков, и дальнейший рост приложенной электродвижущей силы не будет сопровождаться ростом обратной электродвижущей силы, которая достигла наибольшей возможной величины Ep. Дальнейшее увеличение E сверх Ep будет давать длительный ток, растущий согласно (3.1), т.е. линейно, как это показано на рис.3.1. Наклон прямой определяется величиной сопротивления w ячейки. Из рисунка видно, что при E Рассмотрим теперь более простой случай, когда электролиз не изменяет природы электролитов, например ячейку из двух серебряных электродов в растворе AgNO3. Если пренебрегать концентрационными изменениями у электродов, сопровождающими электролиз, то обратная электродвижущая сила равна нулю и (3.1) превращается в E = iw. Тогда кривая напряжения имеет форму прямой, выходящей из начала координатных осей, как изображено пунктиром на рис.3.1. Если электролиз сопровождается необратимыми процессами, из которых наиболее часто встречаются рассматриваемые ниже перенапряжение и концентрационная поляризация, то кривая напряжения имеет более сложный вид. Изменения, происходящие в гальванической цепи при прохождении через нее тока, называют поляризацией (не смешивать с диэлектрической поляризацией молекул в электрическом поле.), а вызываемую ими обратную электродвижущую силу называют электродвижущей силой поляризации. Эти изменения, большей частью термодинамически необратимые, могут быть как химическими, так и концентрационными. 3.1.3. Электродвижущие силы разложения Как говорилось выше, электродвижущая сила разложения Ep должна быть равной по величине и обратной по закону электродвижущей силе того гальванического элемента, который образуется при электролизе. Следует, однако, отметить, что из-за побочных осложнений обе электродвижущие силы редко вполне совпадают. Электродвижущая сила разложения водных растворов всех неорганических оснований и кислородных кислот между гладкими платиновыми электродами одна и та же: около 1,7 В при 20°C с колебаниями не больше 0,05 В в обе стороны. Объясняется это тем, что все они при электролизе дают одни и те же электродные реакции: выделение водорода на катоде и кислорода на аноде. Электродвижущая сила разложения в этих случаях равна электродвижущей силе водородно-кислородного элемента, которая действительно не зависит от рода и концентрации электролита. Соли щелочных или щелочноземельных металлов дают при электролизе одни и те же продукты на электродах. Например, суммарная схема электродных реакций при электролизе раствора Na2SO4 может быть представлена в следующем виде: Na*+ H2O + ē = NaOH + 1/2H2 и SO4 + H2O = H2SO4 + 1/2O2 + 2ē. Их электродвижущая сила разложения, однако, выше, чем для кислот и щелочей, а именно 2,1÷2,2 В, так как образование щелочи на катоде повышает положительный потенциал водородного электрода, а образование кислоты на аноде повышает отрицательный потенциал кислородного электрода. В кислотах и щелочах этого явления нет, так как избыток их поддерживает равенство pH около обоих электродов. Если металл находится ниже водорода в ряду напряжений, то величина Ep другая и зависит от рода металла. Она, например, равна 0,8 и 0,7 В для растворов AgNO3 и Ag2SO4 и 1,5 В для раствора CuSO4. Объясняется это тем, что здесь электродный процесс на катоде иной, чем в рассмотренных выше примерах: выделяется не водород, а серебро или медь. При сравнении величин Ep с электродвижущими силами соответствующих обратимых элементов следовало бы брать последние для тех же активностей, какие имеет электролизуемый раствор, однако и тогда не следует ожидать полного согласия из-за уже упоминавшейся и ниже более подробно рассматриваемой необратимости многих электродных процессов. 3.1.4. Потенциал разложения Вместо измерения электродвижущих сил разложения следует находить потенциал разложения каждого электрода отдельно. Для этого обыкновенно применяют схему, изображенную на рис. 3.2, и ее варианты. 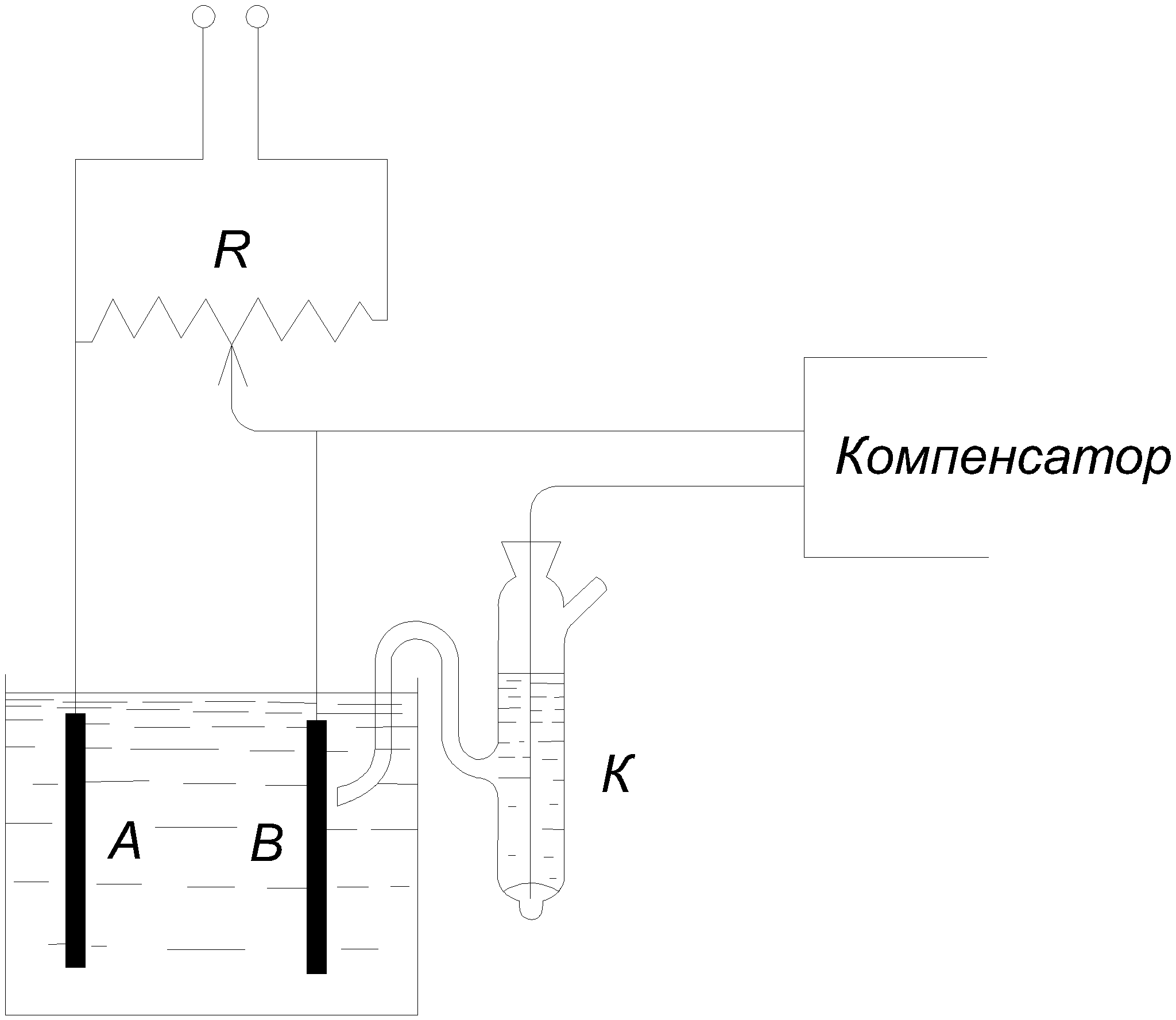 Рис. 3.2. Измерение кривой напряжения Ток, отбираемый от потенциометра, поляризует ячейку AB; потенциал электрода A измеряют обычным методом против вспомогательного неполяризующего электрода K, например каломельного. Дополнительную электродвижущую силу, равную iw, необходимую для преодоления омического сопротивления, по возможности уменьшают, подводя носик сифона вспомогательного электрода вплотную к измеряемому электроду, или же ее вычитают из измеренных E. Измерение силы тока производят или во время прохождения поляризующего тока, или непосредственно после его выключения. Второй, так называемый коммутаторный метод, при котором чередуют включение поляризующего тока и цепи, измеряющей ток поляризации, раньше считали более точным, что оказалось неверным. Им, однако, пользуются для изучения скорости возникновения и падения поляризации после включения или выключения поляризующего тока. Зависимость силы тока от поляризующего потенциала дает такие же кривые напряжения, как изображенная на рис. 3.1. Разность потенциалов разложения обоих электродов равна, очевидно, электродвижущей силе разложения данного раствора; если один из электродов не поляризующийся, то она совпадает с потенциалом разложения второго электрода. Большей частью, по крайней мере, при не слишком больших силах поляризующего тока, потенциалы разложения металлов на платине равны по величине и обратны по знаку электродным потенциалам этих металлов с соответствующими поправками на активности раствора. Например, для меди в 1 н. растворе Cu++(точнее, при активности Cu++, равной единице) получим 0,34 В. Почти ту же величину, немного увеличенную из-за концентрационной поляризации, имеет потенциал разложения медного раствора той же концентрации на платине. Когда он достигается, платина начинает покрываться мелью и превращаться в медный электрод. При выделении газов на электродах, а также в некоторых других случаях нарушается из-за перенапряжения. 3.1.5. Концентрационная поляризация Электролиз сопровождается изменением концентрации электролита около электродов, что ведет к появлению обратной электродвижущей силы. Это явление называется концентрационной поляризацией. Сущность его можно пояснить на приводившемся примере электролиза раствора азотнокислого серебра между двумя серебряными электродами. Выделение серебра на катоде уменьшает около него концентрацию растворенного AgNO3, а растворение серебра на аноде увеличивает ее около последнего. В результате получается концентрационный элемент с обратной электродвижущей силой концентрационной поляризации. Возникающая разность концентраций выравнивается путем диффузии, но лишь частично; даже при перемешивании раствора, значительно уменьшающем концентрационную поляризацию, около электродов всегда остаются так называемые диффузионные слои, не участвующие в общем движении жидкости при размешивании. После того как приложенная электродвижущая сила достигла потенциала разложения, дальнейший ее рост увеличивает силу тока, однако не безгранично. Скорость диффузии растет пропорционально разности концентраций электролита в общем объеме раствора и около электрода. Первая остается практически постоянной, вторая же падает с увеличением скорости разряда. Когда они доходит до малой величины, то разность концентраций достигает наибольшей величины, практически равной концентрации в объеме, и скорость диффузии достигает предела, пропорционального ей. Дальнейшее увеличение приложенной электродвижущей силы уже не вызывает увеличения силы тока, так как скорость подвода ионов к электроду достигла предела. Эта максимальная сила тока, называемая током насыщения, дает на кривой напряжения горизонтальный участок BC. В точке C достигается потенциал разложения какого-нибудь другого иона (например, H+ из воды), и ток снова растет за счет разряда этого иона до тез пор, пока не будет достигнут его ток насыщения DF, и т. д. 3.1.6. Деполяризация Деполяризацией называют уменьшение обратной электродвижущей силы поляризации путем более или менее полного устранения ее причин. В случае концентрационной поляризации деполяризация частично достигается размешиванием жидкости или вращением электродов. Полностью она не может быть устранена из-за упоминавшегося ранее диффузионного слоя жидкости, окружающего электроды. Концентрационная поляризация сильно уменьшается при применении насыщенного раствора с избытком твердой соли. Это использовано в некоторых технических элементах и в стандартном элементе Вестона; для этой цели в последний вводят кристаллы твердого сернокислого кадмия. Для катодной реакции восстановления деполяризаторами могут служить разнообразные окислители. Например, водородный электрод деполяризуется кислородом воздуха или такими окислителями, как MnO2 в элементе Лекланше, H2CrO4 в элементе Грене и HNO3 в элементе Бунзена. В качестве катодных деполяризаторов часто применяют разнообразные органические окислители, продукты восстановления которых и служат целью электролиза. Таким путем, например, получают на катоде анилин и другие промежуточные продукты восстановления из нитробензола. Анодными деполяризаторами, наоборот, служат разные восстановители, например этиловый спирт, окисляющийся до ацетальдегида и уксусной кислоты. Деполяризаторы снижают потенциалы разложения и уменьшают этим расход энергии при электролизе. 3.1.7. Перенапряжение Если потенциал выделения отличается от термодинамического обратимого электродного потенциала, то мы имеем перенапряжение. Поясним это явление несколькими примерами. Черненая платина, насыщенная водородом под атмосферным давлением, дает в растворе с активностью H+, равной единице, водородный электрод, потенциал которого в водородной шкале равен нулю. Этот электрод почти совершенно обратим. Выделение водорода на катоде из черненой платины, если сила тока не очень велика, начинается при том же потенциале. С точки зрения термодинамики равновесных процессов замена платины другим нерастворимым металлом не должна влиять на величину потенциала разложения, поскольку такой металл не участвует в электродном процессе и служит лишь проводником электронов. На самом деле уже замена черненой платины гладкой платиной вызывает повышение потенциала разложения водорода на 0,2 В, а на ртути он растет еще значительно больше. Этот избыточный потенциал, повышающий положение водорода в ряду напряжений, и называется перенапряжением. Перенапряжение водорода можно найти как электродвижущую силу разложения в цепи, составленной из данного водородного электрода и другого обратимого водородного электрода. Осуществить обратимые кислородные электроды вообще невозможно. На любом металле кислород дает перенапряжение, которое увеличивает его потенциал разложения, т.е. понижает его в ряду напряжений. На гладкой платине перенапряжение кислорода равно примерно 0,5 В. Обратимая электродвижущая сила кислородно-водородного элемента при атмосферном давлении равна 1,23 В. Если при электродах из гладкой платины опыт дает для электродвижущей силы разложения 1,7 В, то это объясняется тем, что к ней прибавляются перенапряжение кислорода, а также небольшое перенапряжение водорода. Измерять перенапряжение можно разными способами. Чаще всего применяют методы, описанные в параграфе 3.14. Такие измерения производились многократно и не всегда с согласными результатами, так как перенапряжение сильно зависит от чистоты металла и состояния его поверхности. Иногда различают перенапряжение, отвечающее началу выделения пузырьков газа (или другого продукта электролиза) на электроде, и перенапряжения, которое отвечает изгибу на кривой напряжения. Обе величины могут не совпадать из-за пересыщения или других осложняющих причин. Так как перенапряжение, особенно водородное, имеет большое теоретическое и прикладное значение, то ему было посвящено много экспериментальных и теоретических исследований. Несмотря на это многие стороны вопроса продолжают и сейчас оставаться неясными. |
